Una vía terciaria para la oxidación del etanol es llevada a cabo por la catalasa, una enzima peroxisomal que también cataliza la eliminación del peróxido de hidrógeno (H2O2). Aunque la catalasa tiene un papel mucho menor en la oxidación del alcohol que la ADH o la CYP2E1, es importante en la función cerebral, ya que se ha descubierto que la inhibición de la catalasa disminuye la tasa de oxidación del etanol a acetaldehído por parte del cerebro (3).
En condiciones de alta concentración de peróxido de hidrógeno, la catalasa trabaja para convertir dos moléculas de H2O2 en dos moléculas de agua. La primera molécula de H2O2 entra en el sitio activo donde oxida el hierro del hemo para producir un grupo oxiférrico con un radical de porfirina π-catiónico y una molécula de agua. Una segunda molécula de peróxido de hidrógeno entra entonces en el sitio activo y se oxida a oxígeno molecular y agua. Sin embargo, en concentraciones bajas de H2O2, se producirá una vía alternativa debido a la naturaleza fuertemente oxidante del grupo oxiférrico formado tras la oxidación de la primera molécula de H2O2. Los radicales hidroxilo saldrán del canal hacia el sitio activo y oxidarán las moléculas de etanol a moléculas de acetaldehído fuera del sitio activo (10).
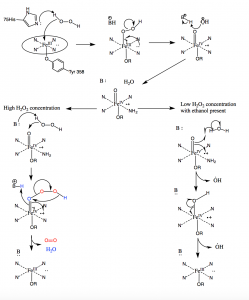
Figura 10: Mecanismo de la catalasa. En condiciones de alta concentración de peróxido de hidrógeno, la catalasa sigue el mecanismo de la izquierda para oxidar dos moléculas de peróxido. Bajo concentraciones bajas de peróxido de hidrógeno, la catalasa sigue el mecanismo radical de la derecha y produce dos radicales hidroxilo.
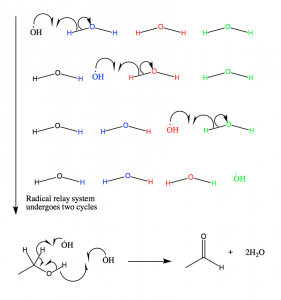
Figura 11: Los radicales hidroxilo producidos en el mecanismo radical de la catalasa se canalizan fuera del sitio activo a través de este mecanismo. Los radicales reaccionan entonces con el etanol, que se mantiene en las proximidades del sitio activo. Si el etanol no está presente, se oxida el NADPH.
El sitio activo de la catalasa es una fracción de hemo con His-75 que juega un papel importante en la actividad catalítica; utiliza un relé de carga (residuos Tyr358, Arg354, His218 y Asp348) para llevar a cabo las reacciones sin interrumpir la unión del peróxido. Cuando se forma el grupo oxiférrico, el sistema de relevo de carga se inicia mediante el movimiento continuo de los electrones del enlace de coordinación de un enlace a otro. La resonancia atribuida al movimiento de los electrones del enlace de coordinación permite que se forme una nube de electrones alrededor del centro de hierro en la que los electrones pueden ser donados a las reacciones catalíticas (10).
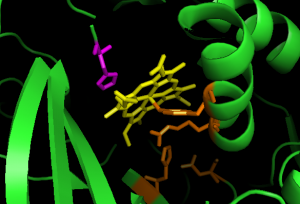
Figura 12: El sitio activo de la catalasa contiene un hemo (amarillo) con His75 catalítico en el lado distal (púrpura), y varios residuos, Tyr358, Arg354, His218 y Asp348, que contribuyen a un sistema de relevo de carga en el lado proximal, mostrado en naranja (archivo pdb: 1qqw).
0 comentarios