Una via terziaria per l’ossidazione dell’etanolo è svolta dalla catalasi, un enzima perossisomiale che catalizza anche la rimozione del perossido di idrogeno (H2O2). Anche se la catalasi ha un ruolo molto più piccolo nell’ossidazione dell’alcol rispetto all’ADH o al CYP2E1, è importante nella funzione cerebrale, poiché si è scoperto che l’inibizione della catalasi diminuisce il tasso di ossidazione dell’etanolo ad acetaldeide nel cervello (3).
In condizioni di alta concentrazione di perossido di idrogeno, la catalasi lavora per convertire due molecole di H2O2 in due molecole di acqua. La prima molecola di H2O2 entra nel sito attivo dove ossida il ferro eme per produrre un gruppo ossiferrilico con un radicale porfirinico π-cationico e una molecola di acqua. Una seconda molecola di perossido di idrogeno entra quindi nel sito attivo e viene ossidata a ossigeno molecolare e acqua. In basse concentrazioni di H2O2, tuttavia, si verificherà un percorso alternativo a causa della forte natura ossidante del gruppo oxyferryl formato dopo che la prima molecola di H2O2 è ossidata. I radicali idrossilici usciranno dal canale verso il sito attivo e ossideranno le molecole di etanolo in molecole di acetaldeide al di fuori del sito attivo (10).
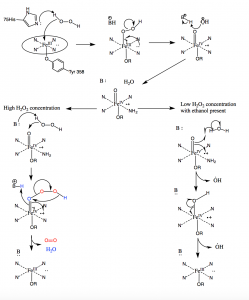
Figura 10: Meccanismo della catalasi. In condizioni di alto perossido di idrogeno, la catalasi segue il meccanismo sulla sinistra per ossidare due molecole di perossido. Sotto basse concentrazioni di perossido di idrogeno, la catalasi segue il meccanismo radicale sulla destra e produce due radicali idrossili.
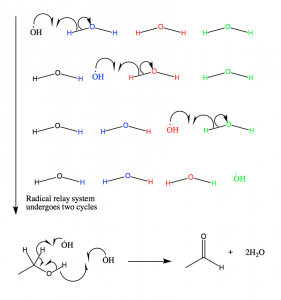
Figura 11: I radicali idrossili prodotti nel meccanismo radicale della catalasi sono incanalati fuori dal sito attivo attraverso questo meccanismo. I radicali reagiscono poi con l’etanolo, che è tenuto in prossimità del sito attivo. Se l’etanolo non è presente, il NADPH viene ossidato.
Il sito attivo della catalasi è un’eme con His-75 che gioca un ruolo importante nell’attività catalitica; utilizza un relè di carica (residui Tyr358, Arg354, His218 e Asp348) per effettuare le reazioni senza interrompere il legame del perossido. Quando si forma il gruppo ossiferrilico, il sistema di relè di carica si avvia attraverso il movimento continuo degli elettroni del legame di coordinazione da un legame all’altro. La risonanza attribuita al movimento degli elettroni del legame di coordinazione permette di formare una nuvola di elettroni intorno al centro del ferro in cui gli elettroni possono essere donati alle reazioni catalitiche (10).
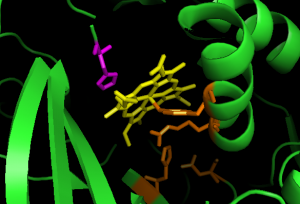
Figura 12: Il sito attivo della catalasi contiene un eme (giallo) con His75 catalitico sul lato distale (viola), e diversi residui, Tyr358, Arg354, His218 e Asp348, che contribuiscono ad un sistema di relè di carica sul lato prossimale, mostrato in arancione (file pdb: 1qqw).
0 commenti