Objetivos de aprendizaje
- Definir el \ (pH).
- Determinar el pH de las soluciones ácidas y básicas.
- Determinar la concentración de iones de hidrógeno (hidronio) a partir del pH y viceversa.
Los valores de la concentración molar de hidrógeno \(\) pueden ser notablemente diferentes de una solución acuosa a otra. Por ello, los químicos definieron una nueva escala que indica sucintamente las concentraciones de cualquiera de estos dos iones. Se trata de la escala de \N pH. Es el rango de valores de 0 a 14 que describe la acidez o la basicidad de una solución. Se puede utilizar \(pH\) para determinar rápidamente si una determinada solución acuosa es ácida, básica o neutra.
El pH es una escala logarítmica. Una solución que tiene un pH de 1,0 tiene 10 veces el como una solución con un pH de 2,0, que a su vez tiene 10 veces el como una solución con un pH de 3,0 y así sucesivamente.
Atención: La escala de ph no tiene límites
El ph suele estar (aunque no siempre) entre 0 y 14. Conociendo la dependencia del ph de \(\), podemos resumirlo así:
- Si el ph < 7, entonces la solución es ácida.
- Si el ph = 7, entonces la solución es neutra.
- Si el ph > 7, entonces la solución es básica.

Figura \N(\PageIndex{1}) La escala de pH.
La Figura \(\PageIndex{2}\) ilustra la relación entre el pH y la concentración de iones de hidrógeno, junto con algunos ejemplos de varias soluciones. Debido a que las concentraciones de iones de hidrógeno son generalmente menores que uno (por ejemplo, \ (1,3 \ ~ veces 10^ {3}, M\)), el logaritmo del número será un número negativo. Para facilitar aún más el trabajo con el pH, éste se define como el logaritmo negativo de \(\), lo que dará un valor positivo para el pH.
La fórmula general para determinar a partir del pH es la siguiente:
= 10-pH
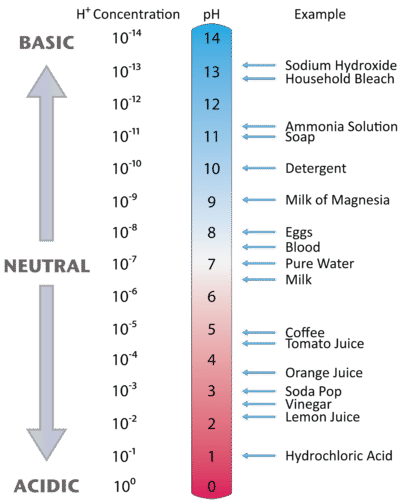
Figura \(\PageIndex{2}) Los valores de \(pH) para varios materiales comunes con la correspondiente concentración de iones hidrógeno, .
Ejemplo \(\PageIndex{1})
Etiqueta cada solución como ácida, básica o neutra basándote sólo en el \(pH\) indicado.
- Leche de magnesia, pH = 10.5
- agua pura, pH = 7
- vino, pH = 3,0
- Con un pH superior a 7, la leche de magnesia es básica. (La leche de magnesia es en gran parte Mg(OH)2.)
- El agua pura, con un pH de 7, es neutra.
- Con un pH inferior a 7, el vino es ácido.
Respuesta
Ejercicio \(\PageIndex{1})
Identificar cada sustancia como ácida, básica o neutra basándose únicamente en el \(pH) indicado.
- Sangre humana con \N(pH) = 7,4
- Amoníaco doméstico con \N(pH) = 11,0
- Cerezas con \N(pH) = 3.6
Respuesta a básica Respuesta b básica Respuesta c ácida
Tabla \(\PageIndex{1}): da los valores típicos de pH de algunas sustancias comunes. Observa que en la lista hay varios alimentos, y la mayoría de ellos son ácidos.
| Sustancia | pH |
|---|---|
| ácido estomacal | 1.7 |
| zumo de limón | 2.2 |
| vinagre | 2.9 |
| soda | 3,0 |
| vino | 3.5 |
| café, negro | 5.0 |
| leche | 6,9 |
| agua pura | 7.0 |
| sangre | 7,4 |
| agua de mar | 8.5 |
| leche de magnesia | 10.5 |
| solución de amoníaco | 12,5 |
| 1,0 M NaOH | 14.0 |
| *Los valores reales pueden variar en función de las condiciones | |
Ejemplo \N(\PageIndex{2}\):
¿Cuál es el para una solución acuosa cuyo pH es 6?
Solución
El valor de pH de 6 denota que el exponente de 10 es -6. Por lo tanto, la respuesta es
= 1,0 x 10-6M
Ejercicio
Cuál es el para una disolución acuosa cuyo pH es 11?
Respuesta
= 1.0 × 10-11 M
Ejemplo \(\PageIndex{3})
¿Cuál es el pH de una disolución acuosa cuya concentración de iones hidrógeno es de 1,0 x 10-7M? Es la solución ácida, básica o neutra.
Solución
La concentración de iones hidrógeno es de 1,0 x 10-7M. El exponente de 10 es -7, lo que denota que pH= -(-7) = 7. La disolución es neutra.
Ejercicio \N(\PageIndex{3})
¿Cuál es el pH de una disolución acuosa cuya concentración de iones hidrógeno es 1,0 x 10-3M? Es la solución ácida, básica o neutra.
Solución
La concentración de iones hidrógeno es de 1,0 x 10-3M. El exponente de 10 es -3, lo que denota que pH= -(-3) = 3. La solución es ácida.
Contribuidores y atribuciones
-
Peggy Lawson (Oxbow Prairie Heights School). Financiado por el Consorcio de Tecnología Educativa de Saskatchewan.
-
Fundación CK-12 por Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson y Jean Dupon.
- Template:OpenStax
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
0 comentarios