P>Objectivos de Aprendizagem
ul>
li>Determinar o pH de soluções ácidas e básicas.
Valores de concentração molares de hidrogénio \(\) podem ser marcadamente diferentes de uma solução aquosa para outra. Assim, os químicos definiram uma nova escala que indica sucintamente as concentrações de qualquer um destes dois iões. Isto é conhecido como a escala de pH. A gama de valores de 0 a 14 que descreve a acidez ou basicidade de uma solução. Pode utilizar \(pH) para fazer uma determinação rápida se uma dada solução aquosa é ácida, básica ou neutra.
pH é uma escala logarítmica. Uma solução que tem um pH de 1,0 tem 10 vezes o como solução com um pH de 2,0, que por sua vez tem 10 vezes o como solução com um pH de 3,0 e assim por diante.
Aviso: A escala de pH não tem limites
pH está normalmente (mas nem sempre) entre 0 e 14. Sabendo a dependência do pH de \(\), podemos resumir da seguinte forma:
- se pH < 7, então a solução é ácida.
- se pH = 7, então a solução é neutra.
- se pH > 7, então a solução é básica.

Figure \(\PageIndex{1}}) A escala de pH.
Figure \\(\PageIndex{2}} ilustra a relação entre pH e a concentração de iões de hidrogénio, juntamente com alguns exemplos de várias soluções. Uma vez que as concentrações de iões de hidrogénio são geralmente inferiores a uma (por exemplo ^(1,3 ^{-3},M^)), o registo do número será um número negativo. Para tornar o pH ainda mais fácil de trabalhar, o pH é definido como o log negativo de ^(^), o que dará um valor positivo para o pH.
A fórmula geral para determinar a partir do pH é a seguinte:
= 10-pH
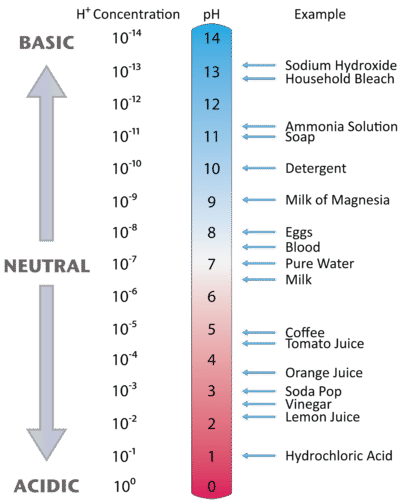
Figure \(\PageIndex{2}) Os valores de \P(pH) para vários materiais comuns com a correspondente concentração de iões de hidrogénio, .
Exemplo \(\PageIndex{1})
p>Etiqueta cada solução como ácida, básica, ou neutra com base apenas no indicado \(pH\).
- leite de magnésia, pH = 10.5
- água pura, pH = 7
- vinho, pH = 3,0
Resposta
- Com um pH superior a 7, o leite de magnésia é básico. (O leite de magnésia é em grande parte Mg(OH)2.)
- com um pH de 7, a água pura é neutra.
- com um pH inferior a 7, o vinho é ácido.
Exercicio \(\PageIndex{1})
p>P>Identificar cada substância como ácida, básica, ou neutra com base apenas no indicado \(pH\PageIndex{1}).
- sangue humano com \(pH\) = 7,4
- amónio doméstico com \(pH\) = 11,0
amoníaco com \(pH\) = 3.6
Resposta básica b Resposta básica c Ácido
Tábua \\(\PageIndex{1}}: dá os valores típicos de pH de algumas substâncias comuns. Note-se que vários artigos alimentares estão na lista, e a maioria deles são ácidos.
| Substância | pH |
|---|---|
| ácido estomacal | 1.7 |
| sumo de limão | 2.2 |
| vinagre | 2.9 |
| soda | 3.0 |
| wine | 3.5 |
| café, preto | 5.0 |
| milk | 6.9 |
| água pura | 7.0 |
| sangue | 7.4 |
| água do mar | 8.5 |
| leite de magnésia | 10.5 |
| solução de amónia | 12.5 |
| 1.0 M NaOH | 14.0 |
| *Os valores reais podem variar dependendo das condições | |
0 comentários