Objectifs pédagogiques
- Définir le \(pH\).
- Déterminer le pH des solutions acides et basiques.
- Déterminer la concentration en ions hydrogène (hydronium) à partir du pH et inversement.
Les valeurs de concentration molaire de l’hydrogène \(\) peuvent être sensiblement différentes d’une solution aqueuse à l’autre. Les chimistes ont donc défini une nouvelle échelle qui indique succinctement les concentrations de l’un ou l’autre de ces deux ions. C’est ce qu’on appelle l’échelle de pH. Il s’agit de l’intervalle de valeurs de 0 à 14 qui décrit l’acidité ou la basicité d’une solution. Vous pouvez utiliser le \(pH\) pour déterminer rapidement si une solution aqueuse donnée est acide, basique ou neutre.
Le pH est une échelle logarithmique. Une solution qui a un pH de 1,0 a 10 fois le comme une solution avec un pH de 2,0, qui à son tour a 10 fois le comme une solution avec un pH de 3,0 et ainsi de suite.
Avertissement : L’échelle de ph n’a pas de limites
Le pH est généralement (mais pas toujours) compris entre 0 et 14. Connaissant la dépendance du pH par rapport à \(\), on peut résumer ainsi :
- Si le pH < 7, alors la solution est acide.
- Si le pH = 7, alors la solution est neutre.
- Si le pH > 7, alors la solution est basique.

Figure \(\PageIndex{1}\) L’échelle de pH.
La figure \(\PageIndex{2}\) illustre la relation entre le pH et la concentration en ions hydrogène, ainsi que quelques exemples de diverses solutions. Comme les concentrations en ions hydrogène sont généralement inférieures à un (par exemple : \(1,3 \times 10^{-3}\,M\)), le logarithme du nombre sera un nombre négatif. Pour rendre le pH encore plus facile à travailler, le pH est défini comme le log négatif de \(\), ce qui donnera une valeur positive pour le pH.
La formule générale pour déterminer du pH est la suivante :
= 10-pH
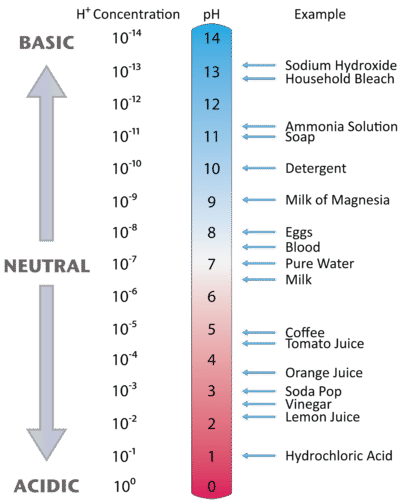
Figure \(\PageIndex{2}\) Les valeurs de \(pH\) pour plusieurs matériaux courants avec la concentration en ions hydrogène correspondante, .
Exemple \(\PageIndex{1}\)
Etiqueter chaque solution comme acide, basique ou neutre en se basant uniquement sur le \(pH\) indiqué.
- lait de magnésie, pH = 10.5
- Eau pure, pH = 7
- Vin, pH = 3,0
Réponse
- Avec un pH supérieur à 7, le lait de magnésie est basique. (Le lait de magnésie est en grande partie constitué de Mg(OH)2.)
- L’eau pure, avec un pH de 7, est neutre.
- Avec un pH inférieur à 7, le vin est acide.
Exercice \(\PageIndex{1}\)
Identifiez chaque substance comme acide, basique ou neutre en vous basant uniquement sur le \(pH\) indiqué.
- Sang humain avec \(pH\) = 7,4
- Ammoniaque domestique avec \(pH\) = 11,0
- Cerises avec \(pH\) = 3.6
Réponse a basique Réponse b basique Réponse c acide
Tableau \(\PageIndex{1}\) : donne les valeurs de pH typiques de quelques substances courantes. Notez que plusieurs aliments figurent dans la liste, et que la plupart d’entre eux sont acides.
| Substance | pH | acide stomacal | 1.7 | jus de citron | 2.2 | vinaigre | 2.9 |
|---|---|
| soda | 3,0 |
| vin | 3.5 | café, noir | 5.0 |
| lait | 6,9 |
| eau pure | 7.0 |
| sang | 7,4 |
| eau de mer | 8.5 | lait de magnésie | 10.5 |
| solution d’ammoniaque | 12,5 |
| 1,0 M NaOH | 14.0 |
| *Les valeurs réelles peuvent varier selon les conditions | |
Exemple \(\PageIndex{2}\) :
Quel est le pour une solution aqueuse dont le pH est de 6 ?
Solution
La valeur du pH de 6 dénote que l’exposant de 10 est -6. La réponse est donc
= 1,0 x 10-6M
Exercice \(\PageIndex{2}\)
Quel est le pour une solution aqueuse dont le pH est de 11 ?
Réponse
= 1.0 × 10-11 M
Exemple \(\PageIndex{3}\):
Quel est le pH d’une solution aqueuse dont la concentration en ions hydrogène est de 1,0 x 10-7M ? La solution est-elle acide, basique ou neutre.
Solution
La concentration en ions hydrogène est de 1,0 x 10-7M. L’exposant de 10 est -7, ce qui dénote que pH= -(-7) = 7. La solution est neutre.
Exercice \(\PageIndex{3}\)
Quel est le pH d’une solution aqueuse dont la concentration en ions hydrogène est de 1,0 x 10-3M ? La solution est-elle acide, basique ou neutre.
Solution
La concentration en ions hydrogène est de 1,0 x 10-3M. L’exposant de 10 est -3, ce qui dénote que pH= -(-3) = 3. La solution est acide.
Contributeurs et attributions
-
Peggy Lawson (école Oxbow Prairie Heights). Financé par le Saskatchewan Educational Technology Consortium.
-
CK-12 Foundation par Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson et Jean Dupon.
- Template:OpenStax
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
.
0 commentaire