Une voie tertiaire d’oxydation de l’éthanol est réalisée par la catalase, une enzyme peroxysomale qui catalyse également l’élimination du peroxyde d’hydrogène (H2O2). Bien que la catalase ait un rôle beaucoup plus faible dans l’oxydation de l’alcool que l’ADH ou le CYP2E1, elle est importante dans la fonction cérébrale car on a constaté que l’inhibition de la catalase diminuait le taux d’oxydation de l’éthanol en acétaldéhyde par le cerveau (3).
Dans des conditions de concentration élevée de peroxyde d’hydrogène, la catalase travaille pour convertir deux molécules de H2O2 en deux molécules d’eau. La première molécule de H2O2 entre dans le site actif où elle oxyde le fer héminique pour produire un groupe oxyferryl avec un radical porphyrine π-cationique et une molécule d’eau. Une deuxième molécule de peroxyde d’hydrogène entre ensuite dans le site actif et est oxydée en oxygène moléculaire et en eau. Toutefois, à de faibles concentrations de H2O2, une autre voie se produit en raison de la nature fortement oxydante du groupe oxyferryle formé après l’oxydation de la première molécule de H2O2. Les radicaux hydroxyles vont sortir du canal vers le site actif et oxyder les molécules d’éthanol en molécules d’acétaldéhyde à l’extérieur du site actif (10).
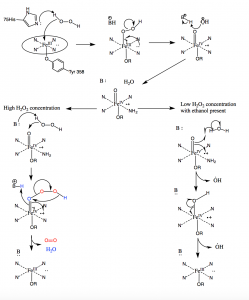
Figure 10 : Mécanisme de la catalase. Dans des conditions de peroxyde d’hydrogène élevé, la catalase suit le mécanisme de gauche pour oxyder deux molécules de peroxyde. Dans des conditions de faible concentration de peroxyde d’hydrogène, la catalase suit le mécanisme radicalaire de droite et produit deux radicaux hydroxyles.
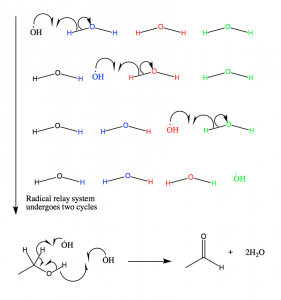
Figure 11 : Les radicaux hydroxyles produits dans le mécanisme radicalaire de la catalase sont canalisés hors du site actif par ce mécanisme. Les radicaux réagissent ensuite avec l’éthanol, qui est maintenu à proximité du site actif. Si l’éthanol n’est pas présent, le NADPH est oxydé.
Le site actif de la catalase est un fragment d’hème avec His-75 jouant un rôle majeur dans l’activité catalytique ; il utilise un relais de charge (résidus Tyr358, Arg354, His218 et Asp348) afin d’effectuer les réactions sans perturber la liaison du peroxyde. Lorsque le groupe oxyferryl est formé, le système de relais de charge est initié par le mouvement continu des électrons de la liaison de coordination d’une liaison à l’autre. La résonance attribuée au mouvement des électrons de la liaison de coordination permet la formation d’un nuage d’électrons autour du centre du fer dans lequel les électrons peuvent être donnés aux réactions catalytiques (10).
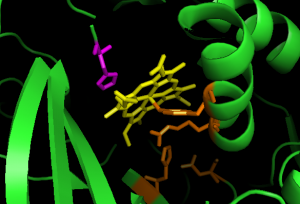
Figure 12 : Le site actif de la catalase contient un hème (jaune) avec la His75 catalytique sur le côté distal (violet), et plusieurs résidus, Tyr358, Arg354, His218 et Asp348, contribuant à un système de relais de charge sur le côté proximal, représentés en orange (fichier pdb : 1qqw).
0 commentaire