Obiettivi di apprendimento
- Definire \(pH).
- Determinare il pH di soluzioni acide e basiche.
- Determinare la concentrazione dello ione idrogeno (idronio) dal pH e viceversa.
I valori della concentrazione molare di idrogeno \(\) possono essere marcatamente diversi da una soluzione acquosa all’altra. Così i chimici hanno definito una nuova scala che indica succintamente le concentrazioni di uno di questi due ioni. Questa è conosciuta come la scala \(pH\). La gamma di valori da 0 a 14 che descrive l’acidità o la basicità di una soluzione. Puoi usare \(pH\) per determinare rapidamente se una data soluzione acquosa è acida, basica o neutra.
pH è una scala logaritmica. Una soluzione che ha un pH di 1.0 ha 10 volte il valore di una soluzione con un pH di 2.0, che a sua volta ha 10 volte il valore di una soluzione con un pH di 3.0 e così via.
Attenzione: La scala del ph non ha limiti
il pH è solitamente (ma non sempre) compreso tra 0 e 14. Conoscendo la dipendenza del pH da \(\), possiamo riassumere come segue:
- Se pH < 7, allora la soluzione è acida.
- Se pH = 7, allora la soluzione è neutra.
- Se pH > 7, allora la soluzione è basica.

Figura \(\PageIndex{1}) La scala del pH.
La figura \(\PageIndex{2}) illustra la relazione tra il pH e la concentrazione di ioni idrogeno, insieme ad alcuni esempi di varie soluzioni. Poiché le concentrazioni di ioni idrogeno sono generalmente inferiori a uno (per esempio \(1.3 \volte 10^{-3},M\)), il log del numero sarà un numero negativo. Per rendere il pH ancora più facile da lavorare, il pH è definito come il log negativo di \(\), che darà un valore positivo per il pH.
La formula generale per determinare il pH è la seguente:
= 10-pH
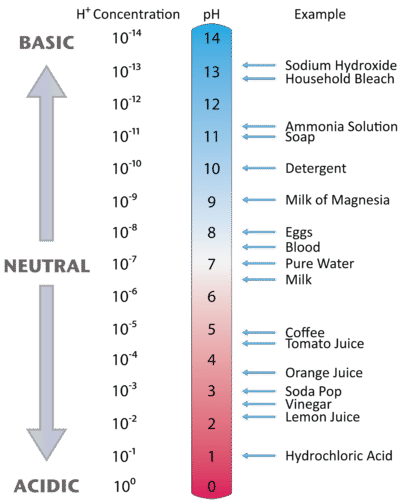
Figura \(\PageIndex{2}}) I valori di \(pH\) per diversi materiali comuni con la corrispondente concentrazione di ioni idrogeno, .
Esempio \(\PageIndex{1})
Etichettare ogni soluzione come acida, basica, o neutra basandosi solo sul \(pH) dichiarato.
- latte di magnesia, pH = 10.5
- acqua pura, pH = 7
- vino, pH = 3.0
Risposta
- Con un pH maggiore di 7, il latte di magnesia è basico. (Il latte di magnesia è in gran parte Mg(OH)2.)
- L’acqua pura, con un pH di 7, è neutra.
- Con un pH inferiore a 7, il vino è acido.
Esercizio \PageIndex{1})
Identifica ogni sostanza come acida, basica, o neutra basandoti solo sul \PH dichiarato.
- sangue umano con \(pH) = 7.4
- ammoniaca domestica con \(pH) = 11.0
- ciliegie con \(pH) = 3.6
Risposta a basico Risposta b basico Risposta c acido
Tabella \(\PageIndex{1}\): fornisce i valori tipici di pH di alcune sostanze comuni. Nota che diversi alimenti sono sulla lista, e la maggior parte di essi sono acidi.
| Sostanza | pH |
|---|---|
| acido dello stomaco | 1.7 |
| succo di limone | 2.2 |
| aceto | 2.9 |
| soda | 3.0 |
| vino | 3.5 |
| caffè, nero | 5.0 |
| latte | 6.9 |
| acqua pura | 7.0 |
| sangue | 7.4 |
| acqua di mare | 8.5 |
| latte di magnesia | 10.5 |
| soluzione di ammoniaca | 12.5 |
| 1.0 M NaOH | 14.0 |
| *I valori effettivi possono variare a seconda delle condizioni | |
Esempio \(\PageIndex{2}\):
Qual è il per una soluzione acquosa il cui pH è 6?
Soluzione
Il valore di pH di 6 denota che l’esponente di 10 è -6. Quindi la risposta è
= 1.0 x 10-6M
Esercizio \(\PageIndex{2})
Qual è il valore di una soluzione acquosa il cui pH è 11?
Risposta
= 1.0 × 10-11 M
Esempio \(\PageIndex{3}\):
Qual è il pH di una soluzione acquosa la cui concentrazione di ioni idrogeno è 1,0 x 10-7M? La soluzione è acida, basica o neutra.
Soluzione
La concentrazione di ioni idrogeno è 1,0 x 10-7M. L’esponente di 10 è -7, che denota che pH= -(-7) = 7. La soluzione è neutra.
Esercizio \(\PageIndex{3})
Qual è il pH di una soluzione acquosa la cui concentrazione di ioni idrogeno è 1,0 x 10-3M? La soluzione è acida, basica o neutra.
Soluzione
La concentrazione di ioni idrogeno è 1,0 x 10-3M. L’esponente di 10 è -3, che denota che pH= -(-3) = 3. La soluzione è acida.
Contribuenti e attribuzioni
-
Peggy Lawson (Oxbow Prairie Heights School). Finanziato dal Saskatchewan Educational Technology Consortium.
-
CK-12 Foundation di Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, e Jean Dupon.
- Template:OpenStax
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
0 commenti