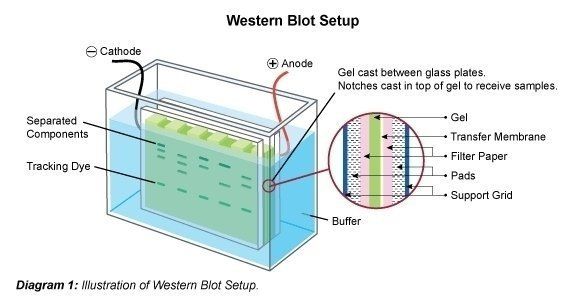
El Western Blotting (también llamado immunoblotting) es una técnica utilizada para el análisis de proteínas individuales en una mezcla de proteínas (por ejemplo, un lisado celular). En el Western blotting (inmunoblotting) la mezcla de proteínas se aplica a una electroforesis en gel en una matriz portadora (SDS-PAGE, PAGE nativa, enfoque isoeléctrico, electroforesis en gel 2D, etc.) para clasificar las proteínas por tamaño, carga u otras diferencias en las bandas de proteínas individuales. A continuación, las bandas de proteínas separadas se transfieren a una membrana portadora (por ejemplo, nitrocelulosa, nylon o PVDF). Este proceso se denomina blotting. Las proteínas se adhieren a la membrana en el mismo patrón en el que han sido separadas debido a las interacciones de cargas. Las proteínas en este inmunoblot son entonces accesibles para la unión de anticuerpos para su detección.
El término Western Blotting se basa en un juego de palabras. El southern blot, que es un método para detectar secuencias específicas de ADN, recibe su nombre de Ed Southern, quien describió por primera vez este procedimiento. El western blot (inmunoblot), así como el northern blot (para la detección de ARN), juegan con el significado de este nombre.
Diferentes tipos de electroforesis en gel para proteínas
Se puede elegir entre diferentes tipos de electroforesis en gel para proteínas dependiendo del criterio por el que se deban separar las proteínas. Algunos métodos electroforéticos comúnmente utilizados son: SDS-PAGE, native-PAGE y enfoque isoeléctrico.
SDS-PAGE:
Se trata de un método desnaturalizante ya que trata las proteínas con un detergente aniónico SDS (sodiumdodcylsulfate). La estructura secundaria y terciaria se destruye con este proceso. Además, el SDS se adhiere a las proteínas y, por tanto, cubre sus cargas químicas, lo que hace que las proteínas tengan una carga igualmente negativa. Por lo tanto, la siguiente separación se produce únicamente por el tamaño de las cadenas polipeptídicas en el gel de poliacrilamida.
Tampón SDS-PAGE y kits recomendados
Las proteínas nativas, desplegadas y no desnaturalizadas pueden separarse utilizando este método. Este método permite la separación de proteínas que son inaccesibles por otros métodos. Un ejemplo sería la separación de proteínas modificadas y no modificadas del mismo tipo (por ejemplo, el estado fosforilado frente al no fosforilado de una proteína). La PAGE nativa también puede utilizarse para confirmar conformaciones biológicamente relevantes, como las formas di-, tri- o tetraméricas de las proteínas (al contrario que la SDS-PAGE, que separaría las cadenas peptídicas individuales y desnaturalizadas). Este método también puede detectar diferentes complejos de diferentes proteínas.
La separación mediante PAGE nativo depende de una serie de parámetros como la carga, el tamaño y la estructura 3D de la proteína. Se necesita un tampón adecuado para mantener el plegado 3D de la proteína. La aplicabilidad del tampón depende del punto isoeléctrico y de las cargas de la proteína.
Focalización isoeléctrica:
Este método se basa en el hecho de que una proteína tiene una carga específica a determinados valores de pH. Dependiendo del pH los grupos funcionales ácidos y básicos contribuyen aumentando o disminuyendo la carga total de la proteína. El punto isoeléctrico se define como el punto en el que la carga total de la molécula es cero, porque hay una cantidad igual de cargas negativas y positivas en la molécula.
Se necesitan geles de gradiente especiales para el enfoque isoeléctrico ya que el pH cambia de ácido a básico a lo largo de un gradiente dentro del gel. Debido a una carga eléctrica conectada al gel, la proteína se desplaza hasta el punto del gel en el que la carga del gel es igual a la de la proteína, y la carga total es igual a cero, es decir, el punto isoeléctrico. Por lo tanto, este método se utiliza para separar las proteínas por sus cargas, así como para determinar el punto isoeléctrico de una proteína objetivo. La separación se produce por la carga de la proteína o por el número de grupos básicos y ácidos que contiene la proteína.
Los métodos mencionados anteriormente para la electroforesis en gel de las proteínas también pueden combinarse para separar las proteínas. La elección de los métodos depende de los requisitos específicos del experimento.
Blotting
Después de la separación de la mezcla de proteínas, las bandas de polipéptidos se transfieren a un soporte de membrana. Para ello, la membrana se une al gel y este llamado sándwich se transfiere a una cámara de electroforesis. Es posible que una parte del SDS se elimine y que la proteína vuelva a saturarse parcialmente, es decir, que recupere su estructura 2D y 3D. Sin embargo, la carga eléctrica aplicada hace que las proteínas se desplacen fuera del gel verticalmente en la dirección en la que se desplazaron en el gel, sobre la membrana. De este modo, las bandas de proteínas se unen a la membrana. Las bandas «manchadas» están ahora disponibles para ser tratadas posteriormente (por ejemplo, para la detección de proteínas específicas con anticuerpos específicos).
Immunodetección
La identificación de anticuerpos específicos es posible después de la separación y el blotting de las proteínas. Los anticuerpos específicos (monoclonales o policlonales) se unen a «su» banda de proteínas. Los anticuerpos de unión inespecífica se eliminan mediante el lavado con tampones que contienen detergentes. Además, las bolsas de unión inespecífica pueden bloquearse antes de añadir los anticuerpos específicos.
Por lo general, primero se aplican anticuerpos primarios, que luego son reconocidos por un anticuerpo secundario. El anticuerpo secundario se conjuga con color, radiactividad o una enzima para su detección. También se utilizan anticuerpos conjugados con biotina para este fin.
Buffer de bloqueo recomendado &Buffer de lisis para Western Blotting
En ocasiones puede ser ventajoso utilizar anticuerpos primarios policlonales, ya que dichos anticuerpos reconocen varios epítopos, al contrario que los anticuerpos monoclonales que están restringidos en su afinidad de unión. Después de la inmunodetección es posible desprender el anticuerpo de la membrana para su posterior análisis con otros anticuerpos (por ejemplo, para detectar otros anticuerpos específicos de la mezcla de proteínas investigada).
El análisis del western blot se lleva a cabo entonces utilizando una variedad de sistemas de imagen diferentes (por ejemplo, luminiscencia, reacción de color, autorradiografía).
La identificación de una proteína de interés en un Western blot depende, entre otros factores, de su peso molecular. Para ello, las proteínas separadas electroforéticamente en la muestra se comparan con un estándar de peso molecular de composición conocida.
Marcadores recomendados & Controles para Western Blotting
El método Western blotting (inmunoblot) conlleva varias ventajas en comparación con otros ensayos inmunoabsorbentes (ISA), como por ejemplo ELISA.
El Western blotting (immunoblot) amplía la idea de ELISA al permitir la separación de la mezcla de proteínas por tamaño, carga y/o conformación. El método de stripping descrito permite la detección de varias dianas, al contrario que el ELISA, en el que sólo se puede detectar una proteína. Como la electoforesis en gel de las proteínas separa las proteínas en bandas, se puede determinar el tamaño de la proteína/polipéptido objetivo. También es posible (semi)cuantificar la proteína de interés ejecutando un estándar de cantidad interna en paralelo con las muestras en el gel. Del mismo modo, se puede comparar el contenido de proteínas de las muestras («la muestra A contiene más proteínas que la muestra B»).
Una desventaja del western blot (inmunoblot) es que requiere mucho tiempo (comparado con el ELISA) y tiene una alta demanda en términos de experiencia del experimentador. Además, requiere la optimización de las condiciones experimentales (es decir, aislamiento de proteínas, tampones, tipo de separación, concentración del gel, etc.).
Hay muchos tipos y métodos diferentes de western blotting (inmunoblot). Por lo tanto, abarca temas y aplicaciones muy diferentes.
0 comentarios