La disponibilidad y el uso del aborto con medicamentos
El aborto con medicamentos, también conocido como aborto médico o aborto con píldoras, es un protocolo de interrupción del embarazo que consiste en la toma de dos fármacos diferentes, la mifepristona y el misoprostol, que pueden utilizarse de forma segura hasta los primeros 70 días (10 semanas) de embarazo. Desde que la Administración de Alimentos y Medicamentos de EE.UU. (FDA) aprobó por primera vez el fármaco en el año 2000, su uso en Estados Unidos ha crecido rápidamente, y más de un tercio de los abortos con 8 semanas de gestación o menos son abortos farmacológicos. Aunque este protocolo implica la toma de dos medicamentos, y no implica un procedimiento médico, está sujeto a muchas de las mismas restricciones específicas de los proveedores de abortos que otros métodos de aborto, tanto a nivel estatal como federal. Esta hoja informativa proporciona una visión general del aborto con medicamentos, con un enfoque en las regulaciones federales y estatales relativas a su provisión y cobertura, y el papel de la droga en los abortos autogestionados.
¿Qué es un aborto con medicamentos?
El régimen de aborto con medicamentos más común en los Estados Unidos implica el uso de dos medicamentos diferentes: mifepristona y misoprostol. La mifepristona, vendida bajo la marca Mifeprex y también conocida como la píldora abortiva, RU-486, bloquea la progesterona, una hormona esencial para el desarrollo de un embarazo, y por lo tanto evita que un embarazo existente progrese. El misoprostol, que se toma entre 24 y 48 horas después de la mifepristona, actúa para vaciar el útero provocando calambres y hemorragias, de forma similar a un aborto espontáneo. Se suele programar una visita de seguimiento una o dos semanas después, para confirmar que el embarazo se ha interrumpido mediante una ecografía o un análisis de sangre. El aborto farmacológico es un método seguro y altamente eficaz de interrupción del embarazo si las píldoras se administran a las 9 semanas de gestación o menos, el embarazo se interrumpe con éxito el 99,6% de las veces, con un riesgo de complicaciones mayores del 0,4%, y una tasa de mortalidad asociada inferior al 0,001% (0,00064%).
Protocolo de la FDA
Hasta 2019, la mifepristona sólo se vendía bajo la marca Mifeprex, fabricada por los Laboratorios Danco. La FDA aprobó por primera vez Mifeprex en el año 2000, y en 2016, la FDA aprobó un nuevo régimen basado en la evidencia y la etiqueta del medicamento, que guía la práctica clínica actual. Este régimen aprueba el uso de abortos médicos hasta 70 días (10 semanas) de embarazo (Tabla 1).
| Tabla 1: Régimen de mifepristona y misoprostol de la FDA | |
| Máx. edad gestacional | Hasta 70 días FUM* (10 semanas) |
| Dosificación de mifepristona | 200 mg (un comprimido), por vía oral |
| Administración de mifepristona | Dispensada en la consulta; No se especifica dónde debe tomarse la medicación (en casa o en el entorno clínico) |
| Dosis de misoprostol | 800µg (4 comprimidos), tomados por vía bucal (colocados en la mejilla) o vaginal |
| Tiempo de administración de misoprostol | 24-48 horas después de mifepristona por vía bucal, o 6-72 horas después de la mifepristona por vía vaginal |
| Administración de misoprostol | Tomado en casa |
| Visita de seguimiento | 7-14 días después de la mifepristona, sin lugar especificado |
| Requisitos del prescriptor | Por o bajo la supervisión de un prescriptor que haya sido certificado por el fabricante |
| Nota: *LMP – Última menstruación | |
| Fuente: FDA, Información sobre Mifeprex (mifepristona), febrero de 2018. | |
Evaluación de Riesgos y Estrategias de Mitigación (REMS)
La mifepristona no puede ser dispensada por las farmacias minoristas como la mayoría de los otros medicamentos; en su lugar, las pacientes embarazadas sólo pueden obtener el medicamento directamente de un proveedor médico certificado que haya rellenado un formulario de acuerdo de prescripción del fabricante sobre el uso adecuado del medicamento. Esto se debe a que la FDA ha aplicado una Estrategia de Evaluación y Mitigación de Riesgos (REMS, por sus siglas en inglés) para Mifeprex desde 2011 (Ver Recuadro 1).
Cuadro 1: ¿Qué son las REMS y ETASU?
Desde 2007, la FDA tiene la autoridad para exigir a los fabricantes de medicamentos programas de Evaluación y Mitigación de Riesgos (REMS, por sus siglas en inglés) para medicamentos específicos con el fin de garantizar que sus beneficios superen sus riesgos. La FDA debe tener en cuenta una serie de factores a la hora de determinar la necesidad de un REMS, entre los que se incluyen: la gravedad de la enfermedad o afección a tratar, el tamaño de la población que se espera que utilice el medicamento, la duración prevista del tratamiento y la gravedad de los efectos adversos. Actualmente hay 61 programas REMS aprobados por la FDA que suelen ser necesarios para los fármacos que se sabe que están asociados a posibles complicaciones o contraindicaciones graves, como los antipsicóticos, los opioides, la testosterona y los fármacos utilizados para tratar el cáncer, el acné y la esclerosis múltiple. Estos programas pueden incluir una guía de medicación, un prospecto para el paciente y/o un plan de comunicación para educar a los proveedores sobre el uso seguro del fármaco.
Si la FDA decide que estas medidas no son suficientes para permitir la comercialización del fármaco de forma segura, la agencia puede exigir una versión más estricta del REMS, que incluya uno o más Elementos para Asegurar el Uso Seguro (ETASU). Más de la mitad de los programas REMS actualmente aprobados tienen uno o más ETASU. Las directrices de la FDA estipulan que un ETASU «debe ser proporcional al riesgo grave específico enumerado en el etiquetado del medicamento, y no debe ser indebidamente gravoso para el acceso al medicamento, especialmente para los pacientes con enfermedades graves o que ponen en peligro su vida y que tienen dificultades para acceder a la asistencia sanitaria».
Una serie de organizaciones, como el Colegio Americano de Obstetras y Ginecólogos (ACOG), apoyan la eliminación de las regulaciones REMS para la mifepristona, que sostienen que son médicamente innecesarias e impiden el acceso al aborto médico. La ex comisionada de la FDA, Jane Henney, y la médica Helene D Gayle publicaron una perspectiva en la que argumentan que la FDA debería reevaluar las regulaciones REMS, a la luz de los estudios que muestran que la mifepristona es segura y efectiva. Algunos defensores sugieren que el proceso REMS limita el grupo de proveedores y, en consecuencia, retrasa la atención a las pacientes embarazadas, ya que deben buscar proveedores certificados. Por último, algunos proveedores están desafiando la designación REMS para la mifepristona en los tribunales.
Las directrices y la etiqueta de la FDA para Mifeprex se aplican igualmente al genérico aprobado. El programa REMS aprobado por la FDA para Mifeprex, y ahora, el genérico de mifepristona, también incluye Elementos para Asegurar el Uso Seguro (ETASU), una versión más fuerte de REMS, y contiene tres disposiciones:
- La mifepristona debe dispensarse a los pacientes sólo en determinados entornos sanitarios, concretamente en clínicas, consultorios médicos y hospitales, por un prescriptor certificado o bajo su supervisión;
- Un proveedor debe convertirse en un prescriptor certificado completando y enviando un Formulario de Acuerdo del Prescriptor al distribuidor específico, Danco Laboratories o GenBioPro, que confirma que es capaz de evaluar la duración de un embarazo, diagnosticar embarazos ectópicos y proporcionar un aborto quirúrgico en el caso de un aborto incompleto;
- El prescriptor certificado debe obtener un Formulario de Acuerdo del Paciente firmado por la mujer antes de dispensar el medicamento, como documentación de las condiciones de uso seguro.1
- Tras el cambio de etiqueta de 2016, el proveedor ya no está obligado a dar a cada mujer una copia de la Guía de Medicación de Mifeprex.
← Volver al texto
El 3 de octubre de 2017, la Unión Americana de Libertades Civiles (ACLU) presentó una demanda, en nombre de un grupo de proveedores, contra la FDA desafiando los requisitos REMS para la mifepristona. Estos demandantes citan la baja tasa de complicaciones asociadas a los abortos médicos y afirman que otros fármacos con riesgos similares o más graves no tienen restricciones REMS, y son indebidamente gravosos para los pacientes que intentan acceder al fármaco, en particular para los pacientes de zonas rurales o carentes de servicios médicos. El Tribunal de Distrito de Hawái está esperando a tomar medidas en este caso hasta que el Tribunal Supremo emita una decisión en el caso June Medical Services LLC v. Russo, que implica tanto la «capacidad de terceros» de los proveedores para presentar desafíos legales en nombre de sus pacientes, como la evaluación de la «carga indebida» en los casos de aborto. En mayo de 2020, la ACLU presentó otra demanda que cuestiona el requisito REMS de que la mifepristona se dispense en persona; esta fue presentada en nombre del Colegio Americano de Obstetras y Ginecólogos (ACOG), además de otras organizaciones.
Disponibilidad
Las regulaciones federales y estatales han limitado efectivamente el uso de la mifepristona, particularmente en las áreas desatendidas sin una clínica cercana. Los estudios demuestran que los proveedores de abortos con medicamentos se concentran principalmente en los lugares donde ya existe el aborto quirúrgico. Muchas leyes estatales que regulan a los proveedores de abortos se aplican a todos los tipos de procedimientos de aborto. Por ejemplo, 17 estados exigen que la clínica cumpla normas estructurales comparables a las de los centros quirúrgicos ambulatorios, como el mantenimiento de quirófanos estándar, mesas de examen quirúrgico, etc. Siete estados exigen que los proveedores de servicios de aborto tengan privilegios de admisión en hospitales o un acuerdo alternativo. Muchos estados también han aprobado leyes específicamente relacionadas con el aborto con medicamentos, como los requisitos específicos de asesoramiento y de los proveedores. En la actualidad, los 33 estados sólo permiten a los médicos autorizados dispensar píldoras de mifepristona (Figura 1). Las investigaciones demuestran que los médicos de práctica avanzada (APC), como las enfermeras profesionales, los asistentes médicos o las enfermeras-parteras, pueden dispensar píldoras abortivas con la misma seguridad que los médicos, pero sólo se les permite hacerlo en 17 estados y en DC.
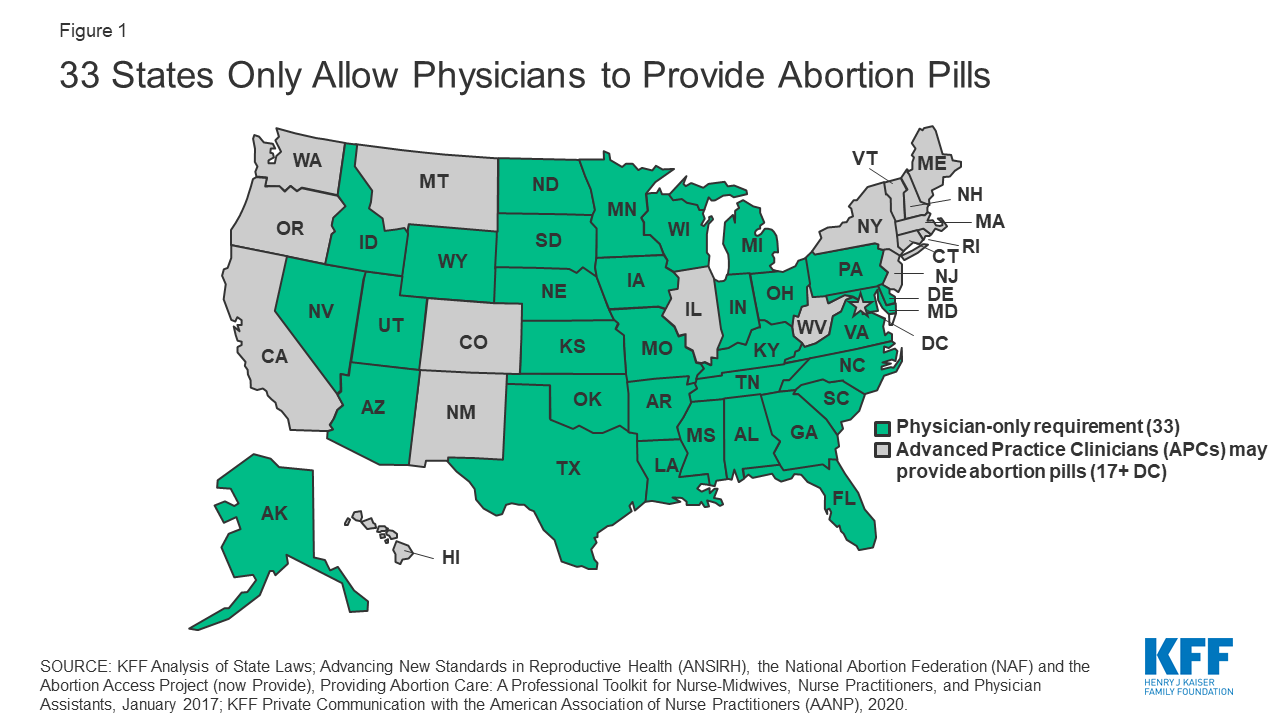
Figura 1: 33 estados sólo permiten a los médicos suministrar píldoras abortivas
Arkansas, Idaho, Kentucky, Nebraska, Oklahoma, Dakota del Sur y Utah han promulgado leyes que obligan a los proveedores a aconsejar a las pacientes que el aborto con medicamentos puede revertirse si se les administra una dosis alta de progesterona después de tomar mifepristona, a pesar de la falta de evidencia científica que apoye esta afirmación. Se aprobaron leyes similares en Arizona, Dakota del Norte y Kansas, pero los tribunales bloquearon las leyes en Arizona y Dakota del Norte, y el gobernador vetó el proyecto de ley en Kansas.
Cobertura y costes del seguro
La cobertura del seguro para el aborto está muy regulada tanto a nivel federal como estatal. Desde 1977, la Enmienda Hyde federal prohíbe el uso de cualquier fondo federal para el aborto, a menos que el embarazo sea resultado de una violación, incesto o si se determina que pone en peligro la vida de la mujer. Después de que la FDA aprobara el Mifeprex en 2000, esta ley también se aplicó a los abortos con medicamentos. Sin embargo, un estudio de 2019 de la Oficina de Rendición de Cuentas del Gobierno de Estados Unidos (GAO) descubrió que 14 programas estatales de Medicaid no cubren la mifepristona ni siquiera en los casos de violación, incesto y peligro para la vida, como exige la enmienda Hyde.
Los estados también regulan los seguros privados totalmente asegurados, incluidos los planes de los Mercados de la Ley de Atención Asequible (ACA). 11 estados limitan la cobertura del aborto en los planes de seguros privados – algunos de estos estados siguen las excepciones de Hyde, mientras que otros son más restrictivos. En 2020, 33 estados no tenían planes del Mercado de la ACA que ofrecieran cobertura para el aborto, y 26 estados lo prohibían categóricamente. Varios planes que ofrecían cobertura para procedimientos de aborto no cubrían el aborto con medicamentos, y algunos planes que sí ofrecían cobertura para el aborto tenían diferencias en los límites gestacionales, los límites anuales/de por vida de las reclamaciones y la cobertura de la mifepristona. Por el contrario, seis estados (California, Illinois, Maine, Nueva York, Oregón y Washington) exigen que todos los planes de salud privados regulados por el estado (incluidos los planes del mercado) incluyan la cobertura del aborto. Los planes autoasegurados no están regulados por la ley estatal de seguros, y la ley federal no prohíbe ni exige la cobertura del aborto en los planes autoasegurados. Aunque no se han realizado investigaciones recientes sobre la cobertura del aborto ofrecida por los planes totalmente asegurados en los 33 estados restantes y el Distrito de Columbia, Danco Laboratories ofrece una recopilación de las políticas de los pagadores estatales y cómo se relacionan con Mifeprex.
En 2014, la cantidad media pagada por un aborto con medicamentos hasta las 10 semanas fue de 535 dólares, mientras que la cantidad media pagada por un aborto en una clínica y con anestesia local fue de 508 dólares. Aunque Danco Laboratories no hace público el coste de Mifeprex, los proveedores informan de que Mifeprex les cuesta alrededor de 90 dólares la píldora. GenBioPro, el fabricante del medicamento genérico mifepristona, tampoco informa del coste de su píldora, pero ha declarado que quiere reducir los costes para quienes eligen el aborto con medicamentos.
Para quienes no tienen cobertura para el aborto, existen otros medios limitados de ayuda financiera, promocionados tanto en la página web de Danco como de GenBioPro. La Federación Nacional del Aborto, así como los fondos locales para el aborto, a veces pueden cubrir parte del coste de un aborto (incluido el viaje) para una persona embarazada. Fuera de estas fuentes de financiación o de una clínica con escala de honorarios, hay pocas opciones para ayudar con los costos del aborto.
Uso
Aunque la tasa general de aborto ha seguido disminuyendo, el uso del aborto con medicamentos ha aumentado mucho a lo largo de los años, y ahora constituye aproximadamente el 41% de todos los abortos a las 8 semanas de gestación o menos (Figura 2).
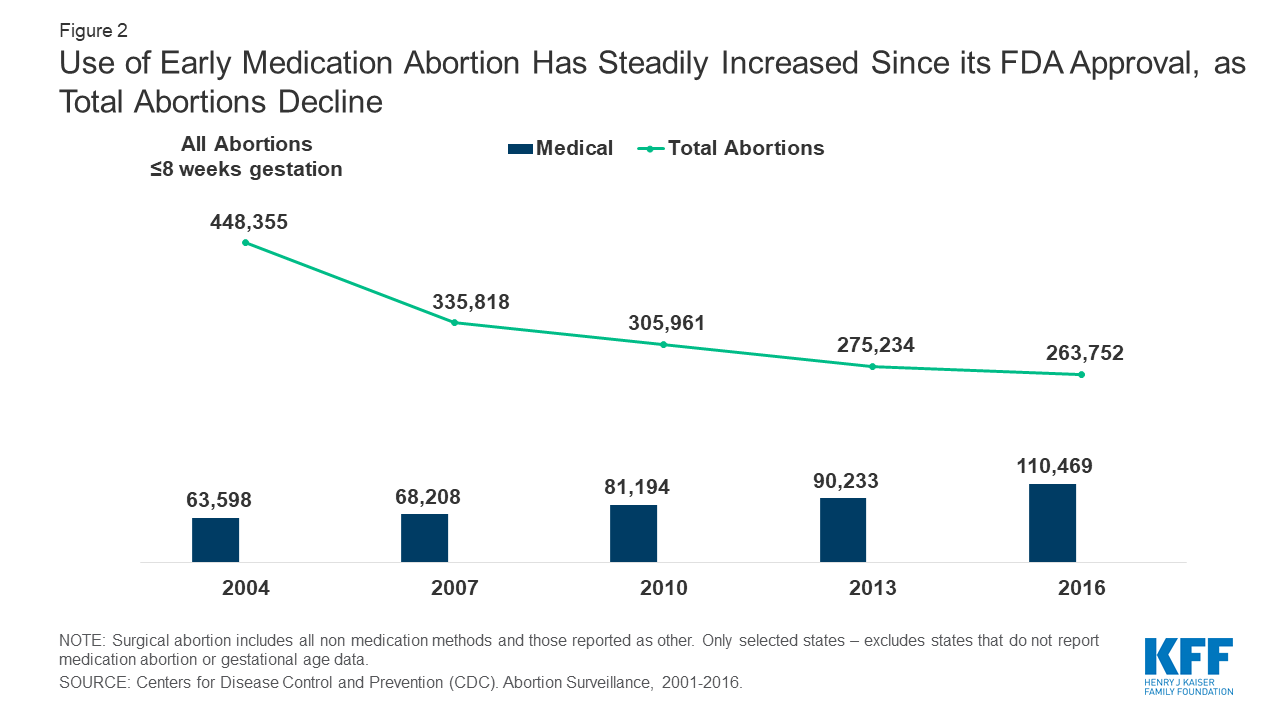
Figura 2: El uso del aborto farmacológico temprano ha aumentado constantemente desde su aprobación por la FDA, mientras que el total de abortos disminuye
Según Danco Laboratories, en 2016, más de 2,75 millones de mujeres en los Estados Unidos han utilizado Mifeprex desde su aprobación por la FDA en 2000. Los datos de los Centros para el Control y la Prevención de Enfermedades (CDC) muestran que, de 2007 a 2016, los abortos notificados con 8 semanas de gestación o menos aumentaron un 2,5%, mientras que los abortos notificados entre 9 y 13 semanas disminuyeron un 7,9%. Un Informe del Instituto Guttmacher de 2017 encontró que el aborto con medicamentos realizado hasta las 9 semanas de gestación representó el 39% de todos los abortos no hospitalarios.
Telemedicina
La telemedicina, o telesalud, puede utilizarse para ampliar el acceso a los servicios de salud en áreas donde el número de proveedores es limitado. Muchas mujeres, en particular las que viven en comunidades rurales, tienen que recorrer largas distancias para obtener servicios de aborto, lo que ha despertado el interés por el potencial de la telemedicina para ampliar el acceso al aborto con medicamentos. Dado que la etiqueta más reciente de la FDA permite a las mujeres tomar las píldoras después de salir de la clínica, la telemedicina ha surgido como una opción viable para ampliar la disponibilidad del aborto a las mujeres que no pueden viajar a la clínica o que, por otras razones, desean abortar en la intimidad de su propio hogar.
Como parte de los esfuerzos para limitar el acceso al aborto, muchos estados han tomado medidas para bloquear el uso de la telemedicina para el aborto. Seis estados, Arizona, Arkansas, Idaho, Missouri, Luisiana y Virginia Occidental, han aprobado leyes que prohíben específicamente la telemedicina para la práctica del aborto. Además, otros 15 estados han promulgado leyes que exigen que el clínico que proporciona un aborto con medicamentos esté físicamente presente durante el procedimiento, prohibiendo efectivamente el uso de la telemedicina para dispensar medicamentos para el aborto a distancia (Figura 3).

Figura 3: 18 Estados tienen políticas que restringen la telemedicina para el aborto con medicamentos
Aborto autogestionado
El aborto autogestionado, a veces referido como aborto «autoinducido» o «en casa», es cuando una persona termina un embarazo fuera del ámbito de la atención médica, generalmente ordenando píldoras abortivas en línea. Esta práctica es ilegal en Estados Unidos, pero está permitida en otros países. Las mujeres pueden intentar gestionar su propio aborto por muchas razones, como las barreras de acceso a las clínicas, el coste, el transporte y la privacidad. El coste medio de los productos de mifepristona-misoprostol pedidos en línea es de aproximadamente 205 dólares, aproximadamente la mitad del coste medio de un aborto en una clínica. Las barreras legales, como la amenaza de cargos penales, para el aborto autogestionado afectan tanto a las personas embarazadas como a quienes las ayudan a interrumpir su embarazo.
Women Help Women, que ya opera para proporcionar píldoras a las mujeres en otros países, lanzó recientemente Self-managed Abortion; Safe and Supported (SASS), para proporcionar información sobre el aborto autogestionado con medicamentos a las mujeres de Estados Unidos. Sin embargo, debido a las barreras legales, no envían píldoras a las mujeres de Estados Unidos. Algunos proyectos, como la Campaña del Plan C, trabajan ahora para informar a las mujeres de EE.UU. sobre los abortos autogestionados, incluyendo cómo tomar adecuadamente los medicamentos, cómo pueden acceder a los fondos para pagarlos y una lista de minoristas en línea con reseñas sobre el precio, el tiempo de envío, la calidad del producto y la supervisión de los médicos. La FDA ha emitido cartas de advertencia a algunas de estas organizaciones, incluyendo Aidaccess.org y RAblon, pidiéndoles que cesen inmediatamente la introducción de medicamentos abortivos en los Estados Unidos, ya que la mifepristona sólo puede ser dispensada legalmente utilizando el protocolo REMS.
Conclusión
Aunque las tasas generales de aborto disminuyen, el uso del aborto con medicamentos ha crecido significativamente desde su aprobación por la FDA en 2000. La disponibilidad del fármaco puede haber desplazado el momento medio en que se producen los abortos a una fase más temprana del embarazo. Sin embargo, su uso se ha visto limitado por la normativa federal y estatal. Entre ellas, el requisito REMS de la FDA, la prohibición de la telemedicina y los requisitos para la dispensación en persona de la mifepristona, así como los requisitos para las visitas de asesoramiento en persona y otras pruebas no recomendadas médicamente para la seguridad. Mientras que algunos estados siguen imponiendo regulaciones que restringen el acceso, otros están explorando formas de aumentar el acceso permitiendo que los proveedores clínicos no médicos prescriban la mifepristona y probando la eficacia de la telemedicina para ampliar el acceso a los servicios de aborto para quienes los buscan.
0 comentarios