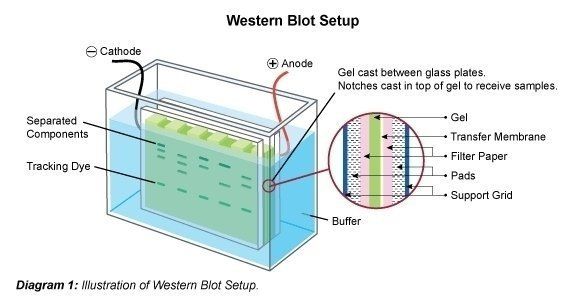
Le Western Blotting (également appelé immunoblotting) est une technique utilisée pour l’analyse de protéines individuelles dans un mélange de protéines (par exemple, un lysat cellulaire). Dans le Western blotting (immunoblotting), le mélange de protéines est appliqué à une électrophorèse sur gel dans une matrice de support (SDS-PAGE, native PAGE, focalisation isoélectrique, électrophorèse sur gel 2D, etc.) pour trier les protéines en fonction de leur taille, de leur charge ou d’autres différences dans les bandes de protéines individuelles. ) pour trier les protéines en fonction de leur taille, de leur charge ou d’autres différences entre les bandes de protéines individuelles. Les bandes de protéines séparées sont ensuite transférées sur une membrane de support (par exemple, nitrocellulose, nylon ou PVDF). Ce processus s’appelle le blotting. Les protéines adhèrent à la membrane de la même manière qu’elles ont été séparées en raison des interactions de charges. Les protéines présentes sur cet immunoblot sont alors accessibles à la fixation des anticorps pour la détection.
Les anticorps sont utilisés pour détecter les protéines cibles sur le western blot (immunoblot). Les anticorps sont conjugués à des marqueurs fluorescents ou radioactifs ou à des enzymes qui donnent une réaction ultérieure avec un réactif appliqué, conduisant à une coloration ou une émission de lumière, permettant la détection.
Le terme Western Blotting est basé sur un jeu de mots. Le southern blot, qui est une méthode de détection de séquences d’ADN spécifiques, doit son nom à Ed Southern, qui a été le premier à décrire cette procédure. Le western blot (immunoblot), ainsi que le northern blot (pour la détection de l’ARN), jouent sur la signification de ce nom.
Différents types d’électrophorèse sur gel pour les protéines
On peut choisir parmi différents types d’électrophorèse sur gel pour les protéines en fonction des critères selon lesquels les protéines doivent être séparées. Certaines méthodes d’électrophorèse couramment utilisées sont : SDS-PAGE, native-PAGE et la focalisation isoélectrique.
SDS-PAGE:
C’est une méthode dénaturante car elle traite les protéines avec un détergent anionique SDS (sodiumdodcylsulfate). Les structures secondaires et tertiaires sont détruites par ce procédé. De plus, le SDS lie les protéines et couvre ainsi leurs charges chimiques, ce qui conduit à des protéines de même charge négative. Par conséquent, la séparation suivante se produit uniquement par la taille des chaînes polypeptidiques dans le gel de polyacrylamide.
Tampon et trousses SDS-PAGE recommandés
PAGE Native:
Les protéines natives, dépliées et non dénaturées peuvent être séparées par cette méthode. Cette méthode permet de séparer des protéines qui sont inaccessibles par d’autres méthodes. Un exemple serait la séparation de protéines modifiées et non modifiées de même nature (par exemple l’état phosphorylé versus l’état non phosphorylé d’une protéine). La PAGE native peut également être utilisée pour confirmer les conformations biologiquement pertinentes, comme les formes di-, tri- ou tétramériques des protéines (contrairement à la SDS-PAGE, qui séparerait les chaînes peptidiques individuelles et dénaturées). Cette méthode permet également de détecter différents complexes de différentes protéines.
La séparation par PAGE native dépend d’un certain nombre de paramètres tels que la charge, la taille et la structure 3D de la protéine. Un tampon approprié est nécessaire pour maintenir le repliement 3D de la protéine. L’applicabilité du tampon dépend du point isoélectrique et des charges de la protéine.
Focalisation isoélectrique :
Cette méthode s’appuie sur le fait qu’une protéine a une charge spécifique à certaines valeurs de pH. En fonction du pH, les groupes fonctionnels acides et basiques contribuent en augmentant ou en diminuant la charge totale de la protéine. Le point isoélectrique est défini comme le point où la charge totale de la molécule est nulle, car il y a une quantité égale de charges négatives et positives dans la molécule.
Des gels à gradient spéciaux sont nécessaires pour la focalisation isoélectrique car le pH change d’acide à basique le long d’un gradient dans le gel. En raison d’une charge électrique connectée au gel, la protéine se déplace vers le point du gel où la charge du gel est égale à celle de la protéine, et où la charge totale est égale à zéro, c’est-à-dire le point isoélectrique. Cette méthode est donc utilisée pour séparer les protéines en fonction de leur charge, ainsi que pour déterminer le point isoélectrique d’une protéine cible. La séparation se produit en raison de la charge de la protéine ou par le nombre de groupes basiques et acides que la protéine contient.
Les méthodes d’électrophorèse sur gel des protéines mentionnées ci-dessus peuvent également être combinées pour séparer les protéines. Le choix des méthodes dépend des exigences spécifiques de l’expérience.
Blotting
Après la séparation du mélange de protéines, les bandes polypeptidiques sont transférées sur un support membranaire. A cet effet, la membrane est fixée au gel et ce soi-disant sandwich est transféré dans une chambre d’électrophorèse. Il est possible qu’une partie du SDS soit éliminée par lavage et que la protéine se renature partiellement, c’est-à-dire qu’elle retrouve sa structure 2D et 3D. Cependant, la charge électrique appliquée fait que les protéines sortent du gel verticalement par rapport à la direction dans laquelle elles ont voyagé sur le gel, sur la membrane. Les bandes de protéines sont ainsi liées à la membrane. Les bandes « blottées » sont maintenant disponibles pour être traitées ultérieurement (par exemple pour la détection de protéines spécifiques avec des anticorps spécifiques).
Immunodétection
L’identification d’anticorps spécifiques est possible après la séparation et le blotting des protéines. Les anticorps spécifiques (mono- ou polyclonaux) se fixent sur « leur » bande de protéines. Les anticorps ne se liant pas spécifiquement sont éliminés par lavage avec des tampons contenant des détergents. En outre, les poches de liaison non spécifiques peuvent être bloquées avant l’ajout d’anticorps spécifiques.
On commence généralement par appliquer des anticorps primaires, qui sont ensuite reconnus par un anticorps secondaire. L’anticorps secondaire est conjugué à une couleur, une radioactivité ou une enzyme pour la détection. Les anticorps conjugués à la biotine sont également utilisés à cette fin.
Tampons de blocage recommandés &Tampons de lyse pour le Western Blotting
Il peut parfois être avantageux d’utiliser des anticorps primaires polyclonaux car ces anticorps reconnaissent plusieurs épitopes, contrairement aux anticorps monoclonaux qui sont limités dans leur affinité de liaison. Après l’immunodétection, il est possible de décoller l’anticorps de la membrane pour une analyse ultérieure avec d’autres anticorps (par exemple, afin de détecter d’autres anticorps spécifiques du mélange de protéines étudié).
L’analyse du western blot est ensuite réalisée à l’aide de différents systèmes d’imagerie (par exemple, luminescence, réaction colorée, autoradiographie).
L’identification d’une protéine d’intérêt dans un western blot repose entre autres facteurs sur son poids moléculaire. A cette fin, les protéines séparées par électrophorèse dans l’échantillon sont comparées à un standard de poids moléculaire de composition connue.
Marqueurs recommandés & Contrôles pour le Western Blotting
Pourquoi Western Blotting (Immunoblot)?
La méthode de Western Blotting (immunoblot) comporte divers avantages par rapport à d’autres tests immunosorbants (ISA), comme par exemple ELISA.
Le Western blotting (immunoblot) développe l’idée de l’ELISA en permettant la séparation du mélange de protéines par taille, charge, et/ou conformation. La méthode de stripping décrite permet la détection de plusieurs cibles, contrairement à l’ELISA où une seule protéine peut être détectée. Comme l’électrophorèse sur gel des protéines sépare les protéines en bandes, on peut déterminer la taille de la protéine/polypeptide cible. Il est également possible de (semi-)quantifier la protéine d’intérêt en analysant une quantité standard interne en parallèle avec les échantillons dans le gel. De même, la teneur en protéines des échantillons peut être comparée (« l’échantillon A contient plus de protéines que l’échantillon B »).
Un inconvénient du western blotting (immunoblot) est qu’il prend du temps (par rapport à l’ELISA) et qu’il est très exigeant en termes d’expérience de l’expérimentateur. En outre, elle nécessite d’optimiser les conditions expérimentales (c’est-à-dire l’isolement des protéines, les tampons, le type de séparation, la concentration du gel, etc.)
Il existe de nombreux types et méthodes différents de western blotting (immunoblot). Par conséquent, il couvre des sujets et des applications très différents.
.
0 commentaire