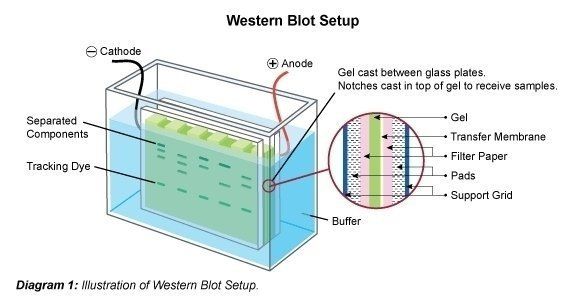
Western Blotting (também chamada immunoblotting) é uma técnica utilizada para análise de proteínas individuais numa mistura de proteínas (por exemplo, um lisado de células). Em Western blotting (immunoblotting) a mistura de proteínas é aplicada a uma electroforese em gel numa matriz transportadora (SDS-PAGE, PAGE nativo, focalização isoeléctrica, electroforese em gel 2D, etc.) para classificar as proteínas por tamanho, carga, ou outras diferenças nas bandas proteicas individuais. As bandas proteicas separadas são então transferidas para uma membrana portadora (por exemplo, nitrocelulose, nylon ou PVDF). Este processo chama-se “blotting”. As proteínas aderem à membrana no mesmo padrão em que foram separadas, devido a interacções de cargas. As proteínas deste immunoblot são então acessíveis para a ligação de anticorpos para detecção.
Antibodies are used to detect target proteins on the western blot (immunoblot). Os anticorpos são conjugados com etiquetas fluorescentes ou radioactivas ou enzimas que dão uma reacção subsequente com um reagente aplicado, levando a uma coloração ou emissão de luz, permitindo a detecção.
O termo Western Blotting é baseado num jogo de palavras. A mancha sul, que é um método para detectar sequências específicas de ADN, tem o nome de Ed Southern, que primeiro descreveu este procedimento. A mancha ocidental (immunoblot), bem como a mancha norte (para a detecção do RNA), jogam com o significado deste nome.
Diferentes Tipos de Electroforese de Gel para Proteínas
Pode-se escolher entre diferentes tipos de electroforese de gel para proteínas, dependendo do critério pelo qual as proteínas devem ser separadas. Alguns métodos electroforéticos comummente utilizados são: SDS-PAGE, focalização nativa-PAGE e isoeléctrica.
SDS-PAGE:
Este é um método de desnaturalização pois trata as proteínas com detergente aniónico SDS (sulfato de sódio). A estrutura secundária e terciária são destruídas por este processo. Além disso, o SDS liga as proteínas e assim cobre as suas cargas químicas, levando a proteínas igualmente carregadas negativamente. Portanto, a seguinte separação acontece unicamente pelo tamanho das cadeias de polipeptídeos no gel de poliacrilamida.
Buffer e Kits de SDS-PAGE recomendados
Nativo PAGE:
Proteínas nativas, desdobradas, e não desnaturadas podem ser separadas utilizando este método. Este método permite a separação de proteínas que são inacessíveis por outros métodos. Um exemplo seria a separação de proteínas modificadas e não modificadas do mesmo tipo (por exemplo, fosforiladas versus não fosforiladas de uma proteína). A PAGE nativa também pode ser usada para confirmar conformações biologicamente relevantes, como formas de proteínas di-, tri-, ou tetraméricas (ao contrário da SDS-PAGE, que separaria as cadeias de peptídeos individuais e desnaturados). Este método pode também detectar diferentes complexos de diferentes proteínas.
A separação usando PAGE nativa depende de vários parâmetros tais como a carga, tamanho e estrutura 3D da proteína. É necessário um tampão adequado para manter a dobragem 3D da proteína. A aplicabilidade do tampão depende do ponto isoeléctrico e das cargas da proteína.
Foco isoeléctrico:
Este método baseia-se no facto de uma proteína ter uma carga específica a certos valores de pH. Dependendo do pH, os grupos ácidos e funcionais básicos contribuem aumentando ou diminuindo a carga total da proteína. O ponto isoeléctrico é definido como o ponto onde a carga total da molécula é zero, porque há uma quantidade igual de cargas negativas e positivas na molécula.
São necessários géis de gradiente especial para a focalização isoeléctrica à medida que o pH muda de ácido para básico ao longo de um gradiente dentro do gel. Devido a uma carga eléctrica ligada ao gel, a proteína viaja até ao ponto no gel onde a carga do gel é igual à da proteína, e a carga total é igual a zero, ou seja, o ponto isoeléctrico. Assim, este método é utilizado para separar as proteínas pelas suas cargas, bem como para determinar o ponto isoeléctrico de uma proteína alvo. A separação ocorre devido à carga da proteína ou pelo número de grupos básicos e ácidos que a proteína contém.
Os métodos acima mencionados para electroforese em gel de proteínas também podem ser combinados para separar proteínas. A escolha dos métodos depende dos requisitos específicos da experiência.
Blotting
Após a separação da mistura de proteínas, as bandas de polipéptidos são transferidas para um portador de membrana. Para este efeito, a membrana é ligada ao gel e esta chamada sanduíche é transferida para uma câmara de electroforese. É possível que algumas das SDS sejam lavadas, e a proteína se renove parcialmente, ou seja, recupera a sua estrutura 2D e 3D. Contudo, a carga eléctrica aplicada faz com que as proteínas saiam do gel verticalmente para a direcção em que viajaram no gel, para a membrana. As bandas proteicas são assim ligadas à membrana. As bandas “manchadas” estão agora disponíveis para serem tratadas posteriormente (por exemplo, para a detecção de proteínas específicas com anticorpos específicos).
Immunodetecção
A identificação de anticorpos específicos é possível após a separação e a mancha das proteínas. Os anticorpos específicos (mono ou policlonais) ligam-se à “sua” faixa de proteínas. Os anticorpos de ligação não específica são removidos por lavagem com tampões contendo detergente. Além disso, as bolsas de ligação não específica podem ser bloqueadas antes da adição de anticorpos específicos.
Os anticorpos primários são normalmente aplicados primeiro, que são depois reconhecidos por um anticorpo secundário. O anticorpo secundário é conjugado com cor, radioactividade ou uma enzima para detecção. Os anticorpos conjugados com biotina são também utilizados para este fim.
Tampão de bloqueio recomendado &Tampão de lise para Western Blotting
Ocasionalmente pode ser vantajoso utilizar anticorpos policlonais primários, uma vez que tais anticorpos reconhecem vários epitopos, ao contrário dos anticorpos monoclonais que são restritos na sua afinidade de ligação. Após a imunodetecção é possível retirar o anticorpo da membrana para posterior análise com outros anticorpos (por exemplo, a fim de detectar outros anticorpos específicos da mistura de proteínas sob investigação).
A análise da mancha ocidental é então realizada utilizando uma variedade de diferentes sistemas de imagem (por exemplo, luminescência, reacção de cor, autorradiografia).
A identificação de uma proteína de interesse num western blot depende, entre outros factores, do seu peso molecular. Para tal, as proteínas separadas electroforicamente na amostra são comparadas com um padrão de peso molecular de uma composição conhecida.
Marcadores recomendados & Controlos para Western Blotting
Porquê Western Blotting (Immunoblot)?
O método western blotting (immunoblot) implica várias vantagens em comparação com outros ensaios de imunoabsorção (ISAs), como por exemplo ELISA.
O western blotting (immunoblot) expande a ideia do ELISA ao permitir a separação da mistura de proteínas por tamanho, carga, e/ou conformação. O método de despojamento descrito permite a detecção de vários alvos, ao contrário do ELISA onde apenas uma proteína pode ser detectada. Como o gel electophoreis das proteínas separa as proteínas em bandas, é possível determinar o tamanho da proteína/polpéptido alvo. Também é possível quantificar (semi-)a proteína de interesse, executando um padrão interno de quantidade em paralelo com as amostras no gel. Da mesma forma, o conteúdo proteico das amostras pode ser comparado (“amostra A contém mais proteína do que a amostra B”).
Uma desvantagem do western blotting (immunoblot) é que é demorado (comparado com o ELISA) e tem uma grande procura em termos de experiência do experimentador. Além disso, requer a optimização das condições experimentais (ou seja, isolamento proteico, tampões, tipo de separação, concentração de gel, etc.).
Existem muitos tipos e métodos diferentes para a blotting ocidental (immunoblot). Por conseguinte, cobre tópicos e aplicações muito diferentes.
0 comentários