A Disponibilidade e Uso de Aborto Medicamentoso
- div> há 10 meses atrás
Aborto medicamentoso, também conhecido como aborto medicinal ou aborto com comprimidos, é um protocolo de interrupção da gravidez que envolve a toma de dois medicamentos diferentes, Mifepristone e Misoprostol, que podem ser usados com segurança até aos primeiros 70 dias (10 semanas) de gravidez. Desde que a U.S. Food and Drug Administration (FDA) aprovou a droga pela primeira vez em 2000, o seu uso nos Estados Unidos cresceu rapidamente, com mais de um terço dos abortos com 8 semanas de gestação ou menos sendo abortos medicamentosos. Embora este protocolo implique tomar dois medicamentos, e não envolva um procedimento médico, está sujeito a muitas das mesmas restrições específicas do fornecedor de abortos que outros métodos de aborto, tanto a nível estadual como federal. Esta ficha informativa fornece uma visão geral do aborto medicamentoso, com enfoque nos regulamentos federais e estatais relativos ao seu fornecimento e cobertura, e o papel da droga no aborto auto-gerido.
O que é um aborto medicamentoso?
O regime de aborto medicamentoso mais comum nos Estados Unidos envolve o uso de dois medicamentos diferentes: mifepristone e misoprostol. A mifepristona, vendida sob a marca Mifeprex e também conhecida como a pílula abortiva, RU-486, bloqueia a progesterona, uma hormona essencial para o desenvolvimento de uma gravidez, impedindo assim que uma gravidez existente progrida. O Misoprostol, tomado 24-48 horas após a mifepristona, funciona para esvaziar o útero causando cólicas e hemorragias, semelhante a um aborto prematuro. Uma visita de acompanhamento é tipicamente agendada uma ou duas semanas mais tarde, para confirmar que a gravidez foi interrompida através de ultra-sons ou teste sanguíneo. O aborto medicamentoso é um método seguro e altamente eficaz de interrupção da gravidez se os comprimidos forem administrados com 9 semanas de gestação ou menos, a gravidez é interrompida com sucesso 99,6% do tempo, com um risco de 0,4% de complicações maiores, e uma taxa de mortalidade associada inferior a 0,001% (0,00064%).
FDA Protocol
até 2019, a mifepristone só foi vendida sob a marca Mifeprex, fabricada pelos Laboratórios Danco. A FDA aprovou pela primeira vez o Mifeprex em 2000, e em 2016, a FDA aprovou um novo regime baseado em provas e rótulo de medicamentos, que orienta a prática clínica actual. Este regime aprova o uso de abortos médicos até 70 dias (10 semanas) de gravidez (Tabela 1).
| Tabela 1: Regime FDA Mifepristone e Misoprostol | |
| Max. idade gestacional | Primavera a 70 dias LMP* (10 semanas) |
| 200mg (um comprimido), tomado oralmente | |
| Dispensado no escritório; Onde o medicamento deve ser tomado (em casa ou em ambiente clínico) não é especificado | |
| Dosagem de misoprostol | 800µg (4 comprimidos), tomados por via bucal (colocados na bochecha) ou vaginal |
| Misoprostol timing | 24-48 horas após a mifepristone por via bucal, ou 6-72 horas após a mifepristone vaginally |
| Administração de misoprostol | Taken at home |
| Visita de acompanhamento | 7-14 dias após a mifepristone, nenhum local especificado |
| Prescriber requirements | Por ou sob a supervisão de um prescritor que tenha sido certificado pelo fabricante |
| Fonte: FDA, Mifeprex (mifepristone) Information, Fevereiro de 2018. | |
Estratégias de Avaliação de Risco e Mitigação (REMS)
Mifepristone não pode ser administrada por farmácias de venda a retalho como a maioria dos outros medicamentos; pelo contrário, as pacientes grávidas só podem obter o medicamento directamente de um fornecedor médico certificado que tenha preenchido um formulário de acordo de prescrição do fabricante sobre o uso correcto do medicamento. Isto deve-se ao facto de a FDA ter aplicado uma Estratégia de Avaliação e Mitigação de Riscos (REMS) para o Mifeprex desde 2011 (Ver Caixa 1).
br>
br>>br>Desde 2007, a FDA tem tido autoridade para exigir programas de Avaliação e Estratégia de Mitigação de Riscos (REMS) dos fabricantes de medicamentos para medicamentos específicos, a fim de assegurar que os seus benefícios superem os seus riscos. A FDA deve considerar uma variedade de factores ao determinar a necessidade de um REMS, incluindo: a gravidade da doença ou condição a ser tratada, o tamanho da população que se espera que utilize o medicamento, a duração esperada do tratamento, e a gravidade dos acontecimentos adversos. Existem actualmente 61 programas REMS aprovados pela FDA que são tipicamente necessários para medicamentos que se sabe estarem associados a potenciais complicações graves ou contra-indicações, tais como antipsicóticos, opiáceos, testosterona, e medicamentos utilizados para tratar cancro, acne, e esclerose múltipla. Estes programas podem incluir um guia de medicamentos, um folheto informativo para pacientes, e/ou um plano de comunicação para educar os fornecedores sobre o uso seguro do medicamento.
Se a FDA decidir que estas medidas não são suficientes para permitir que o medicamento esteja no mercado em segurança, a agência pode exigir uma versão mais rigorosa de REMS, incluindo um ou mais Elementos para Garantir o Uso Seguro (ETASU). Mais de metade dos programas de REMS actualmente aprovados têm um ou mais ETASU. As directrizes da FDA estipulam que um ETASU “deve ser proporcional ao risco grave específico listado na rotulagem do medicamento, e não deve ser indevidamente oneroso no acesso ao medicamento, especialmente para pacientes com doenças graves ou potencialmente fatais e que têm dificuldade em aceder aos cuidados de saúde”
Uma variedade de organizações, como o Colégio Americano de Obstetras e Ginecologistas (ACOG), apoiam a eliminação dos regulamentos de REMS para mifepristone, que mantêm serem medicamente desnecessários e impedem o acesso ao aborto medicamentoso. A ex-comissária da FDA, Jane Henney, e a médica Helene D Gayle publicaram uma perspectiva argumentando que a FDA deveria reavaliar os regulamentos REMS, à luz de estudos que mostram que a mifepristona é segura e eficaz. Alguns defensores sugerem que o processo REMS limita o conjunto de provedores e consequentemente atrasa os cuidados a pacientes grávidas, uma vez que estes devem procurar provedores certificados. Finalmente, alguns provedores estão a desafiar em tribunal a designação REMS para mifepristone.
As directrizes e o rótulo da FDA para o Mifeprex aplicam-se igualmente aos genéricos aprovados. O programa REMS aprovado pela FDA para o Mifeprex, e agora, o genérico mifepristone, inclui também o Elemento para Garantir a Utilização Segura (ETASU), uma versão mais forte de REMS, e contém três disposições:
- Mifepristone deve ser distribuído aos pacientes apenas em determinados ambientes de cuidados de saúde, especificamente clínicas, consultórios médicos, e hospitais, por ou sob a supervisão de um prescritor certificado;
- Um fornecedor deve tornar-se um prescritor certificado ao preencher e enviar um Formulário de Acordo de Prescriber ao distribuidor específico, os Laboratórios Danco ou GenBioPro, que confirma que são capazes de avaliar a duração de uma gravidez, diagnosticar gravidezes ectópicas, e fornecer aborto cirúrgico no caso de um aborto incompleto;
li>O prescritor certificado deve obter um Formulário de Acordo de Paciente assinado pela mulher antes de dispensar o medicamento, como documentação das condições de utilização segura.1
A 3 de Outubro de 2017, a União Americana das Liberdades Civis (ACLU) entrou com uma acção judicial, em nome de um grupo de fornecedores, contra a FDA, desafiando os requisitos REMS para mifepristone. Estes queixosos citam a baixa taxa de complicações associadas aos abortos médicos e afirmam que outros medicamentos com riscos semelhantes ou mais graves não têm restrições de REMS, e são indevidamente onerosos para os pacientes que tentam ter acesso ao medicamento, particularmente pacientes em áreas rurais ou medicamente desprovidas de nervos. O Tribunal Distrital do Havai está à espera de tomar medidas neste caso até que o Supremo Tribunal emita uma decisão em Junho Medical Services LLC v. Russo, que envolve tanto a “posição de terceiros” dos prestadores de serviços a fim de trazer desafios legais em nome dos seus pacientes, como a avaliação do “ónus indevido” em casos de aborto. Em Maio de 2020, a ACLU interpôs outra acção judicial contestando a exigência do REMS de que a mifepristone fosse dispensada pessoalmente; esta foi apresentada em nome do American College of Obstetricians and Gynecologists (ACOG), para além de outras organizações.
Availability
Regulamentos federais e estatais limitaram efectivamente o uso da mifepristone, particularmente em áreas mal servidas sem uma clínica próxima. Estudos mostram que os prestadores de serviços de aborto medicamentoso se concentram principalmente onde o aborto cirúrgico já está disponível. Muitas leis estatais que regulam os prestadores de serviços de aborto aplicam-se a todos os tipos de procedimentos de aborto. Por exemplo, 17 estados exigem que a clínica cumpra padrões estruturais comparáveis aos centros cirúrgicos ambulatórios, tais como a manutenção de salas de cirurgia padrão, mesas de exames cirúrgicos, e mais. Sete estados exigem que os prestadores de serviços de aborto tenham privilégios de admissão hospitalar ou um arranjo alternativo em vigor. Muitos estados também aprovaram leis especificamente relacionadas com o aborto medicamentoso, tais como aconselhamento específico e requisitos dos prestadores de serviços. Actualmente, os 33 estados permitem apenas aos médicos licenciados a distribuição de pílulas de mifepristone (Figura 1). A investigação demonstra que os clínicos avançados (APCs), tais como enfermeiros, médicos assistentes, ou enfermeiras-médicas, podem dispensar pílulas de aborto com a mesma segurança que os médicos podem, mas só estão autorizados a fazê-lo em 17 estados e CD.
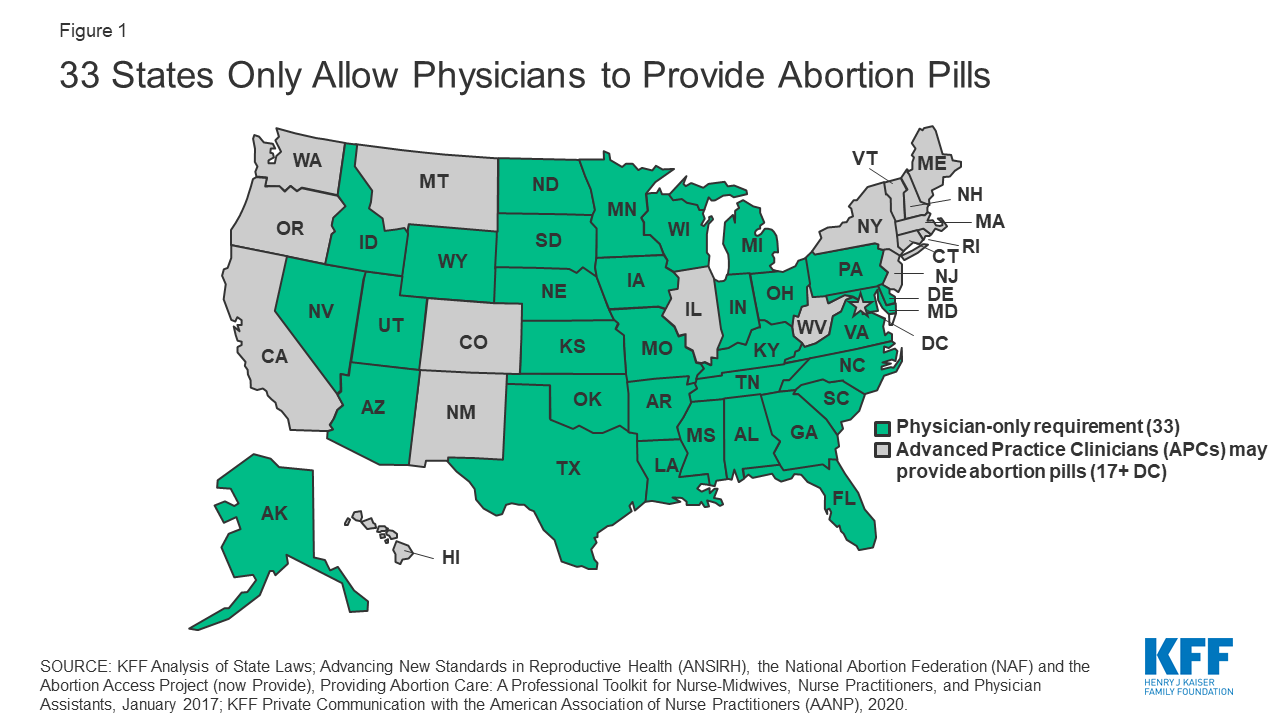
Figure 1: 33 Estados Só permitem aos médicos fornecer comprimidos de aborto
Arkansas, Idaho, Kentucky, Nebraska, Oklahoma, Dakota do Sul, e Utah promulgaram leis que exigem aos médicos que aconselhem os pacientes que o aborto medicamentoso pode ser invertido se for administrada uma dose elevada de progesterona após a ingestão de mifepristona, apesar da falta de provas científicas que apoiem esta alegação. Leis semelhantes foram aprovadas no Arizona, Dakota do Norte, e Kansas, com os tribunais a bloquear as leis no Arizona e Dakota do Norte, e o Governador a vetar a lei no Kansas.
Cobertura de seguro e Custos
A cobertura de seguro para o aborto é fortemente regulamentada tanto a nível federal como estadual. Desde 1977, a Emenda federal Hyde proibiu o uso de quaisquer fundos federais para o aborto, a menos que a gravidez seja resultado de violação, incesto, ou se estiver determinado a pôr em perigo a vida da mulher. Após a FDA ter aprovado o Mifeprex em 2000, esta lei também se aplicou aos abortos de medicamentos. No entanto, um estudo de 2019 do U.S. Government Accountability Office (GAO) descobriu que 14 programas estatais Medicaid não cobrem a mifepristone mesmo nos casos de violação, incesto, e perigo de vida como é exigido pela emenda Hyde.
Os Estados também regulamentam os seguros privados totalmente segurados, incluindo os planos sobre os mercados da Affordable Care Act (ACA). 11 estados limitam a cobertura do aborto em planos de seguros privados – alguns destes estados seguem as excepções de Hyde, enquanto outros são mais restritivos. Em 2020, 33 estados não tinham planos da ACA Marketplace que oferecessem cobertura contra o aborto, com 26 estados a proibirem-no categoricamente. Vários planos que ofereciam cobertura para procedimentos de aborto não cobriam o aborto medicamentoso, e alguns planos que ofereciam cobertura de aborto tinham diferenças nos limites gestacionais, limites anuais/limites de tempo de vida para reclamações, e cobertura de mifepristone. Pelo contrário, seis estados (Califórnia, Illinois, Maine, Nova Iorque, Oregon, e Washington) exigem que todos os planos de saúde privados regulados pelo estado (incluindo os planos de Marketplace) incluam a cobertura do aborto. Os planos com seguro próprio não são regulados pela lei estadual de seguros, e a lei federal não proíbe nem exige a cobertura do aborto nos planos com seguro próprio. Embora não tenha havido investigação recente sobre a cobertura do aborto oferecida pelos planos totalmente segurados nos restantes 33 estados e no Distrito de Columbia, os Laboratórios Danco oferecem uma colecção de apólices de pagamento estaduais e a forma como se relacionam com o Mifeprex.
Em 2014, o montante médio pago por um aborto medicamentoso até 10 semanas foi de $535, enquanto o montante médio pago por um aborto numa clínica e anestesia local foi de $508. Embora os Laboratórios Danco não tornem público o custo do Mifeprex, os prestadores relatam que o Mifeprex lhes custa cerca de $90 por comprimido. GenBioPro, o fabricante do medicamento genérico mifepristone também não relata o custo da sua pílula, mas declarou que quer reduzir os custos para aqueles que escolhem aborto medicamentoso.
Para aqueles que não têm cobertura de aborto, há outros meios limitados de apoio financeiro, promovidos tanto na Danco como no website do GenBioPro. A National Abortion Federation, bem como os fundos locais para o aborto, podem por vezes cobrir alguns dos custos de um aborto (incluindo viagens) para uma pessoa grávida. Fora destas fontes de financiamento ou de uma clínica com escala de taxas deslizante, existem poucas opções para ajudar com os custos do aborto.
Use
p>P>Embora a taxa global de aborto tenha continuado a diminuir, o uso de aborto medicamentoso tem aumentado muito ao longo dos anos, e representa agora cerca de 41% de todos os abortos com 8 semanas de gestação ou menos (Figura 2).
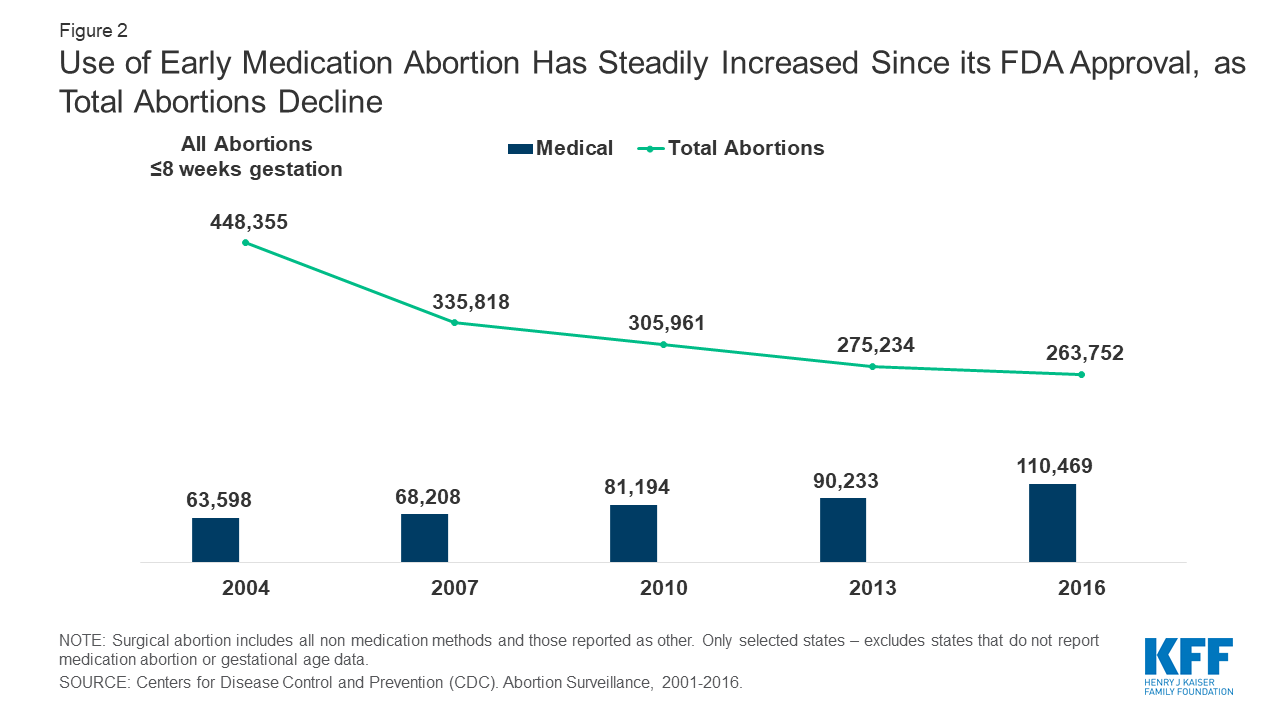 p>Figure 2: O uso de aborto medicamentoso precoce tem aumentado de forma constante desde a sua aprovação pela FDA, à medida que os abortos totais diminuem
p>Figure 2: O uso de aborto medicamentoso precoce tem aumentado de forma constante desde a sua aprovação pela FDA, à medida que os abortos totais diminuem De acordo com os Laboratórios Danco, até 2016, mais de 2,75 milhões de mulheres nos Estados Unidos utilizaram o Mifeprex desde a sua aprovação pela FDA em 2000. Dados dos Centros de Controlo e Prevenção de Doenças (CDC) mostram que, de 2007 a 2016, os abortos notificados com 8 semanas de gestação ou menos aumentaram 2,5%, enquanto que os abortos notificados entre 9-13 semanas diminuíram 7,9%. Um Relatório do Guttmacher Institute de 2017 revelou que o aborto medicamentoso realizado até 9 semanas de gestação representava 39% de todos os abortos não hospitalares.
Telemedicina
Telemedicina, ou telesaúde, pode ser utilizado para expandir o acesso aos serviços de saúde em áreas onde o número de prestadores é limitado. Muitas mulheres, particularmente as que vivem em comunidades rurais, têm de percorrer longas distâncias para obter serviços de aborto, o que tem suscitado interesse no potencial da telemedicina para expandir o acesso ao aborto medicamentoso. Uma vez que o mais recente rótulo da FDA permite às mulheres tomarem os comprimidos após saírem da clínica, a telemedicina surgiu como uma opção viável para expandir a disponibilidade do aborto a mulheres que não podem viajar para a clínica ou por outras razões desejam fazer um aborto na privacidade da sua própria casa.
Como parte dos esforços para limitar o acesso ao aborto, muitos estados tomaram medidas para bloquear o uso da telemedicina para o aborto. Seis estados, Arizona, Arkansas, Idaho, Missouri, Louisiana, e Virgínia Ocidental, aprovaram leis que proíbem especificamente a telemedicina para a prestação de serviços de aborto. Além disso, 15 outros estados promulgaram leis que exigem que o médico que fornece um aborto medicamentoso esteja fisicamente presente durante o procedimento, proibindo efectivamente o uso de telemedicina para dispensar medicamentos para aborto à distância (Figura 3).

Figure 3: 18 Estados têm políticas que restringem a telemedicina para o aborto medicamentoso
Aborto auto-gerido
Aborto auto-gerido, por vezes referido como aborto “auto-induzido” ou “em casa”, é quando uma pessoa termina uma gravidez fora do ambiente de cuidados médicos, tipicamente encomendando comprimidos de aborto online. Esta prática é ilegal nos Estados Unidos, mas é permitida em alguns outros países. As mulheres podem procurar gerir o seu próprio aborto por muitas razões, incluindo barreiras de acesso às clínicas, custo, transporte, e privacidade. O custo médio dos produtos mifepristone-misoprostol encomendados online é de aproximadamente $205, cerca de metade do custo médio de uma clínica de aborto. Barreiras legais, tais como a ameaça de acusações criminais, ao aborto auto-gerido afectam tanto as pessoas grávidas como as que as ajudam a terminar a sua gravidez.
Women Help Women, que já opera para fornecer comprimidos a mulheres noutros países, lançou recentemente o Self-managed Abortion; Safe and Supported (SASS), para fornecer informação sobre aborto medicamentoso auto-gerido a mulheres nos Estados Unidos da América. Contudo, devido a barreiras legais, não enviam comprimidos às mulheres nos Estados Unidos da América. Alguns projectos, tais como a Campanha Plan C, estão agora a trabalhar para informar as mulheres nos EUA sobre abortos auto-geridos, incluindo como tomar os medicamentos de forma apropriada, como podem ter acesso a fundos para os pagar, e uma lista de retalhistas online com revisões de preço, tempo de envio, qualidade do produto, e supervisão médica. A FDA emitiu cartas de aviso a algumas destas organizações, incluindo Aidaccess.org e RAblon, pedindo-lhes que cessassem imediatamente a introdução de medicamentos abortivos nos EUA, uma vez que a mifepristone só pode ser legalmente dispensada usando o protocolo REMS.
Conclusion
Even, uma vez que as taxas globais de aborto diminuem, o uso de medicamentos abortivos tem crescido significativamente desde a sua aprovação pela FDA em 2000. A disponibilidade do medicamento pode ter deslocado o tempo médio de abortos para mais cedo na gravidez. No entanto, a sua aceitação tem sido limitada pelos regulamentos federais e estaduais. Incluindo o requisito REMS da FDA, proibições de telemedicina e requisitos para a dispensa de mifepristone pessoalmente, e requisitos para visitas de aconselhamento presencial e outros testes que não são medicamente recomendados para segurança. Enquanto alguns estados continuam a impor regulamentos que restringem o acesso, outros estão a explorar formas de aumentar o acesso, permitindo aos prestadores clínicos não médicos prescrever a mifepristona e testar a eficácia da telemedicina para expandir o acesso aos serviços de aborto para aqueles que os procuram.
Endnotes
Segundo a alteração do rótulo de 2016, o prestador já não é obrigado a dar a cada mulher uma cópia do Guia de Medicação Mifeprex.
← Voltar ao texto
0 comentários