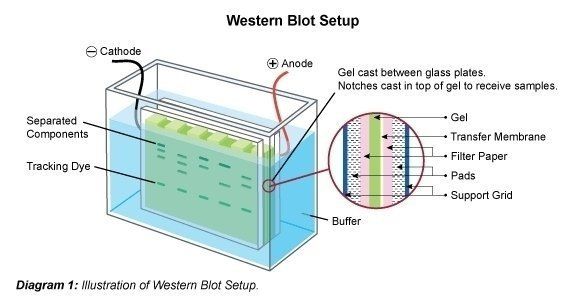
Il Western Blotting (chiamato anche immunoblotting) è una tecnica usata per l’analisi di singole proteine in una miscela proteica (per esempio un lisato cellulare). Nel Western blotting (immunoblotting) la miscela proteica viene applicata a un’elettroforesi su gel in una matrice di supporto (SDS-PAGE, native PAGE, focalizzazione isoelettrica, elettroforesi su gel 2D, ecc.) per ordinare le proteine in base alle dimensioni, alla carica o ad altre differenze nelle bande proteiche individuali. Le bande proteiche separate vengono poi trasferite su una membrana di supporto (ad esempio nitrocellulosa, nylon o PVDF). Questo processo è chiamato blotting. Le proteine aderiscono alla membrana nello stesso modo in cui sono state separate a causa delle interazioni delle cariche. Le proteine su questo immunoblot sono quindi accessibili per il legame degli anticorpi per il rilevamento.
Gli anticorpi sono usati per rilevare le proteine target sul western blot (immunoblot). Gli anticorpi sono coniugati con etichette o enzimi fluorescenti o radioattivi che danno una successiva reazione con un reagente applicato, portando ad una colorazione o emissione di luce, permettendo la rilevazione.
Il termine Western Blotting si basa su un gioco di parole. Il southern blot, che è un metodo per rilevare specifiche sequenze di DNA, prende il nome da Ed Southern, che per primo ha descritto questa procedura. Il western blot (immunoblot), così come il northern blot (per il rilevamento di RNA), giocano sul significato di questo nome.
Diversi tipi di elettroforesi su gel per le proteine
Si può scegliere tra diversi tipi di elettroforesi su gel per le proteine a seconda dei criteri con cui le proteine devono essere separate. Alcuni metodi elettroforetici comunemente usati sono: SDS-PAGE, native-PAGE e focalizzazione isoelettrica.
SDS-PAGE:
Questo è un metodo denaturante poiché tratta le proteine con un detergente anionico SDS (sodiododilsolfato). La struttura secondaria e terziaria viene distrutta da questo processo. Inoltre, l’SDS lega le proteine e quindi copre le loro cariche chimiche, portando a proteine ugualmente caricate negativamente. Quindi la seguente separazione avviene esclusivamente in base alla dimensione delle catene polipeptidiche nel gel di poliacrilammide.
Tampone e kit SDS-PAGE consigliati
Native PAGE:
Le proteine native, unfolded e non denaturate possono essere separate utilizzando questo metodo. Questo metodo permette la separazione di proteine che sono inaccessibili con altri metodi. Un esempio potrebbe essere la separazione di proteine modificate e non modificate dello stesso tipo (ad esempio, lo stato fosforilato rispetto a quello non fosforilato di una proteina). La PAGINA Nativa può anche essere usata per confermare conformazioni biologicamente rilevanti, come forme di-, tri-, o tetrameriche di proteine (contrariamente alla SDS-PAGE, che separerebbe le catene peptidiche individuali e denaturate). Questo metodo può anche rilevare diversi complessi di diverse proteine.
La separazione tramite PAGE nativa dipende da una serie di parametri come la carica, la dimensione e la struttura 3D della proteina. Un buffer adatto è necessario per mantenere il ripiegamento 3D della proteina. L’applicabilità del buffer dipende dal punto isoelettrico e dalle cariche della proteina.
Focalizzazione isoelettrica:
Questo metodo si basa sul fatto che una proteina ha una carica specifica a certi valori di pH. A seconda del pH i gruppi funzionali acidi e basici contribuiscono aumentando o diminuendo la carica totale della proteina. Il punto isoelettrico è definito come il punto in cui la carica totale della molecola è zero, perché c’è una quantità uguale di cariche negative e positive nella molecola.
Per la focalizzazione isoelettrica sono necessari speciali gel a gradiente, poiché il pH cambia da acido a basico lungo un gradiente all’interno del gel. A causa di una carica elettrica collegata al gel, la proteina viaggia verso il punto del gel in cui la carica del gel è uguale a quella della proteina, e la carica totale è uguale a zero, cioè il punto isoelettrico. Quindi, questo metodo è usato per separare le proteine in base alle loro cariche, così come per determinare il punto isoelettrico di una proteina bersaglio. La separazione avviene in base alla carica della proteina o al numero di gruppi basici e acidi che la proteina contiene.
I suddetti metodi per l’elettroforesi su gel delle proteine possono anche essere combinati per separare le proteine. La scelta dei metodi dipende dai requisiti specifici dell’esperimento.
Blotting
Dopo la separazione della miscela proteica le bande polipeptidiche vengono trasferite su un supporto a membrana. A questo scopo la membrana è attaccata al gel e questo cosiddetto sandwich viene trasferito in una camera di elettroforesi. È possibile che una parte dell’SDS venga lavata via e che la proteina si rinaturalizzi parzialmente, cioè riacquisti la sua struttura 2D e 3D. Tuttavia, la carica elettrica applicata fa sì che le proteine escano dal gel verticalmente nella direzione in cui hanno viaggiato sul gel, sulla membrana. Le bande proteiche sono così legate alla membrana. Le bande “blottate” sono ora disponibili per essere trattate ulteriormente (ad esempio per la rilevazione di proteine specifiche con anticorpi specifici).
Immunodetection
L’identificazione di anticorpi specifici è possibile dopo la separazione e il blotting delle proteine. Gli anticorpi specifici (mono- o policlonali) si legano alla “loro” banda di proteine. Gli anticorpi non specificamente legati vengono rimossi mediante lavaggio con tamponi contenenti detergenti. Inoltre, le tasche di legame aspecifiche possono essere bloccate prima dell’aggiunta di anticorpi specifici.
Di solito si applicano prima gli anticorpi primari, che vengono poi riconosciuti da un anticorpo secondario. L’anticorpo secondario è coniugato con colore, radioattività o un enzima per la rilevazione. Anche gli anticorpi coniugati con biotina sono utilizzati a questo scopo.
Bagnoschiuma consigliati & Buffer di lisi per Western Blotting
Talvolta può essere vantaggioso utilizzare anticorpi primari policlonali poiché tali anticorpi riconoscono diversi epitopi, contrariamente agli anticorpi monoclonali che sono limitati nella loro affinità di legame. Dopo l’immunodetection è possibile togliere l’anticorpo dalla membrana per ulteriori analisi con altri anticorpi (ad esempio per rilevare altri anticorpi specifici della miscela proteica in esame).
L’analisi del western blot viene poi effettuata utilizzando una varietà di sistemi di imaging diversi (ad esempio luminescenza, reazione a colori, autoradiografia).
L’identificazione di una proteina di interesse in un Western blot si basa, tra gli altri fattori, sul suo peso molecolare. A questo scopo, le proteine separate elettroforeticamente nel campione sono confrontate con uno standard di peso molecolare di composizione nota.
Marcatori consigliati & Controlli per Western Blotting
Perché Western Blotting (Immunoblot)?
Il metodo western blotting (immunoblot) comporta diversi vantaggi rispetto ad altri test immunosorbenti (ISA), come ad esempio l’ELISA.
Il Western blotting (immunoblot) espande l’idea dell’ELISA permettendo la separazione della miscela proteica per dimensione, carica e/o conformazione. Il metodo di stripping descritto permette la rilevazione di diversi bersagli, contrariamente all’ELISA dove solo una proteina può essere rilevata. Poiché l’elettroforesi del gel delle proteine separa le proteine in bande, si può determinare la dimensione della proteina/peptide target. È anche possibile (semi-)quantificare la proteina di interesse eseguendo uno standard quantitativo interno in parallelo con i campioni nel gel. Allo stesso modo, il contenuto proteico dei campioni può essere confrontato (“il campione A contiene più proteine del campione B”).
Uno svantaggio del western blotting (immunoblot) è che richiede molto tempo (rispetto all’ELISA) e un’elevata esperienza da parte dello sperimentatore. Inoltre, richiede l’ottimizzazione delle condizioni sperimentali (cioè isolamento delle proteine, tamponi, tipo di separazione, concentrazione del gel, ecc.)
Ci sono molti tipi e metodi diversi per il western blotting (immunoblot). Quindi, copre argomenti e applicazioni molto diversi.
0 commenti