John J. Chen, MD, PhD; Ryan M. Tarantola, MD; Christine N. Kay, MD; Vinit B. Mahajan, MD, PhD
Actualizado por Jason P. Kam, MD,
publicado originalmente: 30 de agosto de 2011
actualizado: 14 de septiembre de 2016
Queja principal: Luces giratorias y parpadeantes
Historia de la enfermedad actual
Una mujer de 57 años se presentó en la clínica de Oftalmología del UIHC quejándose de fotopsias centrales bilaterales durante los últimos dos años. Padecía el síndrome de Sjogren y artritis inflamatoria y estaba en tratamiento con prednisona y metotrexato. Anteriormente fue tratada con hidroxicloroquina (Plaquenil) 200mg bid (6,5mg/kg) durante 10 años, que se suspendió un año antes de la presentación.
Antecedentes oculares: Ninguno
Historia médica: Síndrome de Sjogren y artritis inflamatoria, taquicardia supraventricular, ansiedad, depresión, enfermedad de úlcera péptica
Medicamentos: prednisona, metotrexato, amitriptilina, ranitidina, estradiol, tizanidina, diltiazem, Restasis
Alergias: codeína, droperidol
Historia familiar: enfermedad cardíaca, artritis, cáncer
Historia social: alcohol ocasional pero no consumo de tabaco o drogas intravenosas.
Revisión de sistemas:
Visión borrosa, halos, sequedad ocular, sequedad de boca, reflujo gastroesofágico, dolor articular
EXAMEN OCULAR
Audiencia visual
- Ojo derecho (OD): 20/30
- Ojo izquierdo (OS): 20/25
- OD: 15 mmHg
- OS: 15 mmHg
Pupilas: Reactivas a la luz en cada ojo de 5 mm en la oscuridad a 2 mm en la luz. Sin defecto pupilar aferente relativo (DPA).
Movimientos extraoculares: Completos, ambos ojos (OU)
Campos visuales de confrontación: Completos OU
Presión intraocular
Externo
Examen con lámpara de hendidura
- Párpado/Pestañas: normal
- Conjuntiva/Esclerótica: normal
- Córnea: clara, sin verticillata
- Cámara anterior: profunda y tranquila
- Iris: normal
- Lente: 1+ NS
- Vítreo: normal
Examen de fondo de ojo dilatado
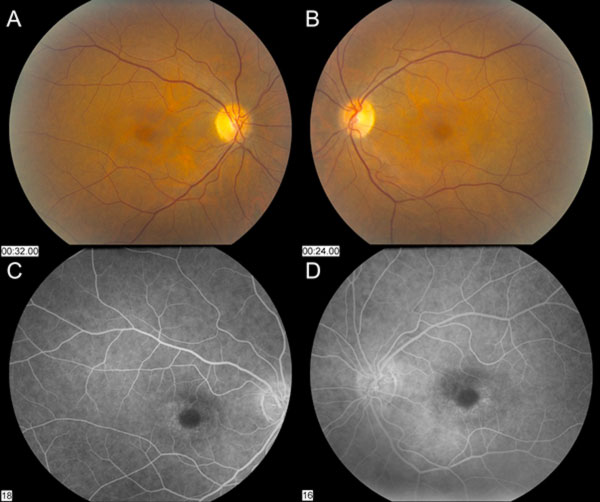
Los nervios ópticos parecían sanos con una relación de 0.3 en la relación copa-disco. Había una leve despigmentación paracentral del EPR en la mácula que salvaba la fóvea central OU. Los vasos y el examen periférico eran normales OU (Figura 1). No había desprendimiento de vítreo posterior, desgarros de retina ni desprendimientos de retina.
Pruebas auxiliares
Figura 1: Las fotos de fondo de ojo demuestran una leve despigmentación paracentral del EPR que salva la fóvea central tanto en el ojo derecho (A) como en el izquierdo (B). La angiografía con fluoresceína muestra hiperfluorescencia parafoveal OU (C y D).
Figura 1: Las fotos de fondo de ojo demuestran una leve despigmentación paracentral del EPR que no afecta a la fóvea central tanto en el ojo derecho (A) como en el izquierdo (B). La angiografía con fluoresceína muestra hiperfluorescencia parafoveal OU (C y D). (haga clic en la imagen para mayor resolución)
Diagnóstico: Toxicidad retiniana inducida por hidroxicloroquina
La cloroquina (CQ) y la hidroxicloroquina (Plaquenil) (HCQ) se han utilizado durante muchos años, inicialmente para el tratamiento de la malaria, pero ahora más comúnmente para el tratamiento de enfermedades inflamatorias como la artritis reumatoide y el lupus . En la actualidad, se está considerando su uso para nuevas enfermedades como la diabetes, las enfermedades cardíacas y las terapias complementarias contra el cáncer.
La cloroquina y la hidroxicloroquina pertenecen a la familia de las quinolonas y comparten indicaciones clínicas y efectos secundarios similares, incluida la toxicidad para la retina. La toxicidad retiniana inducida por la cloroquina se describió por primera vez en 1959 y los efectos tóxicos para la retina de la hidroxicloroquina se describieron posteriormente en 1967 . La hidroxicloroquina tiene una toxicidad retiniana significativamente menor y ha sustituido en gran medida a la cloroquina como tratamiento de la enfermedad inflamatoria. Desgraciadamente, el daño retiniano de estos medicamentos es en gran medida irreversible, por lo que es fundamental detectar la toxicidad retiniana de forma precoz con la esperanza de limitar el alcance de la pérdida visual.
Signos/síntomas
Las manifestaciones oculares de la hidroxicloroquina incluyen verticillata corneal y toxicidad retiniana. Los verticilos son depósitos de sales en la córnea dentro del epitelio corneal. Esta afección no causa síntomas y es reversible con la suspensión del medicamento. El hallazgo de verticillata corneal no tiene correlación con la toxicidad retiniana y no es una indicación para suspender el medicamento. El sello distintivo de la toxicidad por hidroxicloroquina es la retinopatía pigmentaria bilateral. Los pacientes con hallazgos retinianos tempranos suelen ser asintomáticos a pesar de tener sutiles escotomas paracentrales. En una fase posterior de la enfermedad, los pacientes pueden desarrollar una maculopatía bilateral en forma de ojo de buey, caracterizada por un anillo de despigmentación del epitelio pigmentario de la retina (EPR) en la mácula, que evita la fóvea, y que suele ir acompañada de escotomas paracentrales y centrales. La toxicidad de la hidroxicloroquina en su fase final provoca una atrofia generalizada del EPR y de la retina, con pérdida de la visión central, de la visión periférica y de la visión nocturna. Estudios recientes han demostrado que los pacientes de ascendencia asiática desarrollan un daño inicial en una distribución extramacular más periférica cerca de las arcadas, más frecuentemente en la región inferotemporal con los correspondientes defectos de campo superonasal. Los pacientes afroamericanos e hispanos muestran un patrón predominantemente paravoveal similar al de los sujetos europeos .
Los cambios del fondo de ojo en la biomicroscopía, incluyendo la maculopatía en forma de ojo de buey, son indicativos de una toxicidad retiniana inducida por la hidroxicloroquina bastante avanzada, que es en gran medida irreversible a pesar de la interrupción de la medicación. Puede producirse un deterioro continuo de la función visual tras la interrupción de la hidroxicloroquina, posiblemente debido a la lenta eliminación de la retina y del sistema. El cribado es importante para detectar la toxicidad retiniana temprana antes de que se produzcan cambios funduscópicos notables con el fin de limitar la cantidad de pérdida visual. La visión central puede preservarse si se reconoce el daño antes de que haya cambios en el epitelio pigmentario de la retina (EPR).
Mecanismo
El mecanismo de la CQ y la HCQ es poco conocido. Las moléculas se unen a la melanina del EPR provocando cambios metabólicos y efectos tóxicos. Los depósitos afectan a la retina externa, a la capa de fotorreceptores y al EPR, pero preservan la retina interna.
Prevalencia
Aunque se cree que la toxicidad retiniana por hidroxicloroquina es poco frecuente, estudios recientes sugieren que puede tener una prevalencia mayor de la que se reconocía anteriormente. En un amplio estudio se examinaron pacientes con más de 5 años de uso de HCQ que fueron evaluados con campos visuales 10-2 o con tomografía de coherencia óptica de dominio espectral (OCT SD). La prevalencia global de toxicidad en este grupo fue del 7,5%, con una amplia variación en la dosis diaria y la duración del uso. Más allá de este punto, el riesgo aumenta bruscamente hasta el 20% después de 20 años. El riesgo es menor con una dosis más baja, sin embargo no existe una verdadera dosis segura para una mayor duración de uso.
Otro estudio de 4000 pacientes encontró una prevalencia de 6,8/1000 pacientes. Los factores de riesgo que aumentan la probabilidad de retinopatía por hidroxicloroquina incluyen la dosis diaria, la dosis acumulada, la enfermedad renal o hepática, la edad y la enfermedad retiniana previa . Una dosis diaria de >6,5mg/kg (peso corporal ideal) sitúa a los pacientes en mayor riesgo, pero una dosis diaria inferior a este nivel no impidió que el paciente desarrollara toxicidad tras muchos años de tratamiento. Una dosis acumulada de >1000g de hidroxicloroquina o 460g de cloroquina fue probablemente el mayor factor de riesgo, que se alcanzó típicamente después de 5-7 años de una dosis típica . Sin embargo, ha habido informes de casos de pacientes con toxicidad por hidroxicloroquina tan pronto como 1,9 meses después de iniciar el tratamiento .
| Dosis diaria | |
|
HCQ |
>5.0 mg/kg de peso real |
CQ |
>2.3 mg/kg de peso real |
Duración del uso |
>5 años; sin otros factores de riesgo |
|
Enfermedad renal |
Disminución de la tasa de filtración glomerular (TFG) |
Fármacos concomitantes |
Tamam. |
Uso de tamoxifeno |
Enfermedad macular |
Aumento de la susceptibilidad a la toxicidad |
|
Edad |
No hay asociación significativa entre la edad y el riesgo de toxicidad |
Enfermedad hepática |
Sin asociación clara entre enfermedad hepática y toxicidad |
|
Genética |
No hay asociación clara con factores genéticos y toxicidad |
El riesgo más crítico de toxicidad es la dosis diaria excesiva por peso . La dosis >5,0mg/kg aumenta el riesgo de toxicidad. La duración del uso también es un factor de riesgo crítico. Las recomendaciones anteriores de 2011 señalaban que la dosis acumulada (dosis diaria x duración en años) era un indicador de riesgo, sin embargo, la evaluación más precisa es sobre la base de la duración del uso en relación con la dosis diaria por peso real, como se ve en la figura siguiente. Otro cambio con respecto a las recomendaciones de 2011 fue que el peso real era mejor que el peso ideal para el cálculo de la dosis y se consiguió un menor riesgo con dosis de 5 mg/kg de peso real .
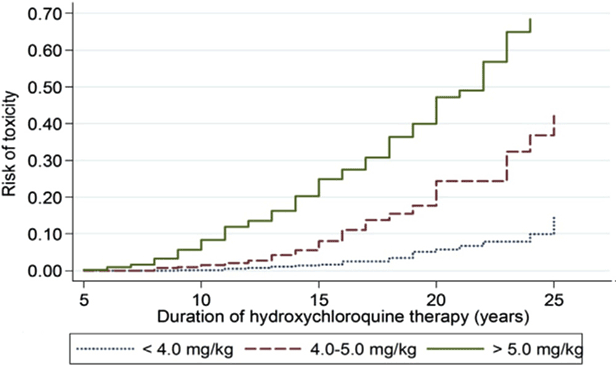
Figura 6: Esta es una curva de Kaplan Meier que muestra el riesgo acumulado de retinopatía a lo largo del tiempo, con diferentes niveles de uso de hidroxicloroquina (HCQ). Cuando el uso está entre 4,0 y 5,0 mg/kg, el riesgo es muy bajo en los primeros 5 a 10 años, pero aumenta notablemente a partir de entonces. Reproducido de Melles y Marmor, 2014
La HCQ es eliminada por los riñones y, por tanto, la enfermedad renal aumenta el riesgo de toxicidad. Por lo tanto, puede ser necesario ajustar tanto la dosis como la frecuencia de las revisiones. El uso de tamoxifeno (utilizado en el tratamiento del cáncer de mama) aumenta el riesgo de toxicidad aproximadamente 5 veces) . No se conoce el mecanismo de esta relación. Los pacientes con enfermedades subyacentes de la retina pueden tener un mayor riesgo de toxicidad, pero no hay datos específicos que lo confirmen. Sin embargo, la maculopatía sí dificulta la aplicación e interpretación del cribado.
Directrices de cribado
La Academia Americana de Oftalmología (AAO) ha proporcionado recientemente recomendaciones revisadas para el cribado que incorporan los nuevos avances tecnológicos que permiten una detección más temprana de la enfermedad en 2016.
|
Línea de tiempo |
Pruebas auxiliares |
Pruebas de referencia |
Dentro del primer año de uso |
Campos visuales y SD OCT si hay maculopatía |
|---|---|---|
|
Prueba anual |
Comienza después de 5 años de uso pero antes si hay presencia de factores de riesgo importantes |
Tanto HVF 10-2 y SD-OCT; pruebas opcionales (según necesidad): mfERG y/o FAF |
Examen de referencia: Todos los pacientes deben someterse a un examen oftalmológico de referencia dentro del primer año de iniciar el tratamiento con HCQ o CQ, con una evaluación exhaustiva de los factores de riesgo y un examen del fondo de ojo de la mácula para descartar una enfermedad subyacente. Se recomienda un campo visual basal y una OCT SD si existen anomalías (por ejemplo, lesiones maculares, glaucoma, etc.) que puedan afectar a las pruebas de cribado.
Control anual: El riesgo de toxicidad es raro en los primeros años de tratamiento con HCQ y CQ. En ausencia de factores de riesgo importantes, el cribado puede posponerse durante 5 años. La toxicidad se desarrolla lentamente y un examen anual después del quinto año es suficiente. Se recomienda un cribado más temprano para los pacientes con cualquiera de los factores de riesgo mencionados anteriormente. Los exámenes de cribado anuales incluyen biomicroscopía, campo visual 10-2 automatizado y tomografía de coherencia óptica de dominio espectral (SD-OCT) con autofluorescencia de fondo de ojo (FAF) y/o electrorretinograma multifocal (mfERG) opcionales según sea necesario.
El campo visual Humphrey 10-2 es sensible para detectar defectos sutiles del campo visual paracentral y se recomienda durante todas las visitas de cribado. Se recomienda la prueba SITA con gráficos de desviación de patrones. Los patrones de prueba más amplios 24-2 o 30-2 son necesarios para los pacientes asiáticos debido a la posibilidad de manifestaciones extramaculares de toxicidad. Los patrones de prueba grandes sólo prueban 4 puntos centralmente. En las directrices de la AAO para los pacientes asiáticos no se menciona la realización de pruebas con patrones de prueba 10-2 y grandes.
SD-OCT: a diferencia de la tomografía de coherencia óptica en el dominio del tiempo, la SD-OCT tiene la resolución para detectar el adelgazamiento localizado de la retina en la región parafoveal. En la SD-OCT, la pérdida o el adelgazamiento de la capa fotorreceptora parafoveal y perifoveal y la alteración focal de las laminaciones del segmento externo son consistentes con la toxicidad. Estos cambios en la SD-OCT pueden observarse antes de que se presenten anomalías funduscópicas. Las exploraciones de ángulo más amplio o las exploraciones a través de las arcadas vasculares son importantes para los ojos asiáticos .
Pruebas adicionales útiles
Electrorretinograma multifocal (mf-ERG): Esta prueba permite detectar la depresión parafoveal o extramacular localizada en la retinopatía temprana . Tiene una sensibilidad similar a la de los campos visuales y puede proporcionar una confirmación objetiva de la sospecha de pérdida de campo paracentral.
Autofluorescencia de fondo de ojo (FAF): La toxicidad temprana por hidroxicloroquina también puede detectarse en la autofluorescencia como un anillo de señal aumentado dentro de las regiones parafoveal y extramacular, que es indicativo de disfunción de los fotorreceptores y del EPR. Una enfermedad más avanzada conducirá a la pérdida de autofluorescencia dentro de estas regiones debido a la pérdida de fotorreceptores y del EPR, a menudo con hiperfluorescencia circundante .
Pruebas no recomendadas: Las directrices recientes desaconsejan la biomicroscopía sola, la fotografía del fondo de ojo, la tomografía de coherencia óptica en el dominio del tiempo, la angiografía con fluoresceína, el electrorretinograma de campo completo, la rejilla de Amsler, la prueba de visión en color y el electrooculograma . Se cree que todas estas pruebas tienen una sensibilidad inadecuada para detectar la toxicidad de la HCQ/CQ en una fase lo suficientemente temprana como para evitar una pérdida de visión significativa.
En resumen, la toxicidad de la retina inducida por la hidroxicloroquina es probablemente más frecuente de lo que se creía. Una vez que se pensó que era seguro a una dosis diaria de <6,5mg/kg/día , los estudios más recientes muestran que muchos años de tratamiento con hidroxicloroquina a una «dosis segura» todavía puede conducir a la toxicidad . Las directrices más recientes establecen que la dosis diaria >5mg/kg de peso real/día puede provocar toxicidad. La toxicidad en la retina es irreversible y puede progresar tras el cese de la hidroxicloroquina, por lo que el cribado temprano es importante para limitar la posible pérdida de visión. Se recomienda un cribado inicial y un cribado anual después de cinco años. Las modalidades de pruebas auxiliares, como el SD-OCT, el mfERG y la autofluorescencia, proporcionan herramientas de cribado sensibles que complementan el 10-2 HVF en la detección de la toxicidad temprana de la hidroxicloroquina.
Historia clínica completa y evolución
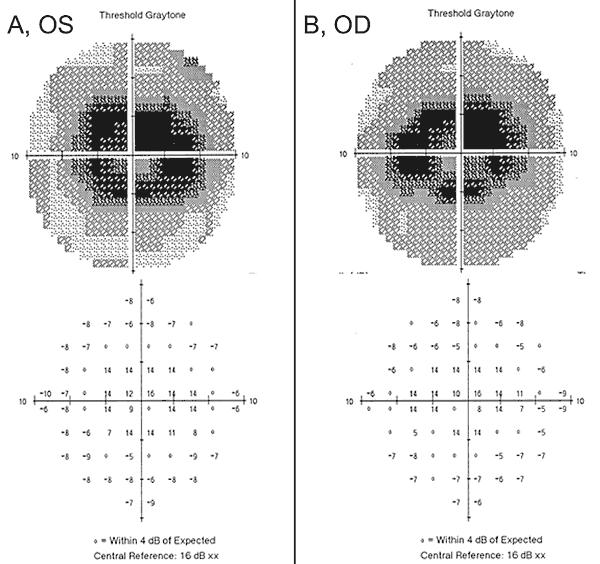
Nuestro paciente destaca algunos de los nuevos hallazgos en la toxicidad retiniana por hidroxicloroquina, incluyendo la importancia del cribado temprano con las herramientas apropiadas descritas anteriormente, la falta de sensibilidad de algunas de las pruebas obsoletas, y el potencial de empeoramiento a pesar de la interrupción de la medicación ofensiva. Cuando nuestra paciente se presentó inicialmente con halos y remolinos de luz a un proveedor externo, tenía una agudeza visual normal y no tenía defectos en la rejilla de Amsler, en las pruebas de visión del color o en el examen de fondo de ojo con dilatación. Además, su HVF de 24-2 un año antes demostró cambios paracentrales no específicos y se consideró completa. Un año después, se obtuvo una FVH de 10-2 que mostraba densos escotomas paracentrales bilaterales (Figura 2), a pesar de que la agudeza visual, la rejilla de Amsler y las pruebas de visión en color eran normales. Al detectarse los defectos del campo visual, se suspendió la hidroxicloroquina. Estaba tomando hidroxicloroquina > 5,0 mg/kg/día con una duración de 10 años con una dosis acumulada de 1460g lo que la ponía en mayor riesgo de toxicidad retiniana por hidroxicloroquina.
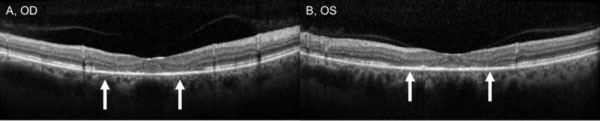
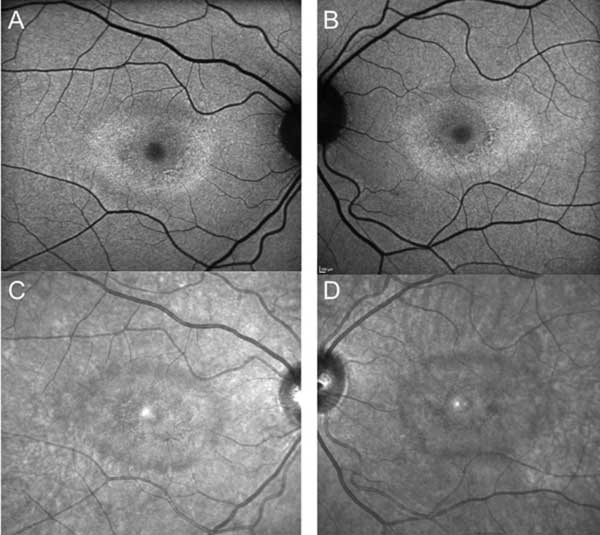
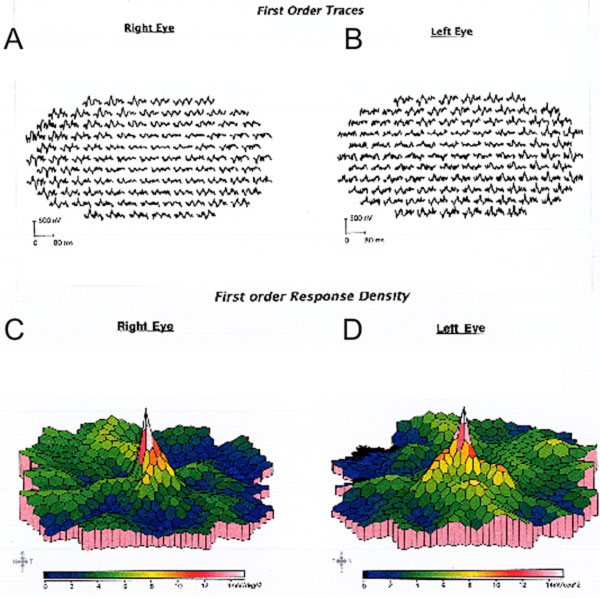
A pesar de la suspensión de la hidroxicloroquina, el seguimiento de un año reveló un leve empeoramiento de la agudeza visual hasta 20/30 OD y 20/25 OS, con nuevas anomalías en la rejilla de Amsler y déficits en las pruebas de visión del color. En la biomicroscopía se observó una sutil despigmentación del EPR parafoveal, que se puso de manifiesto por la hiperfluorescencia en la angiografía con fluoresceína (Figura 1). La repetición de la prueba de HVF 10-2 demostró los densos escotomas paracentrales. La SD-OCT mostró la pérdida de la unión del segmento interno/externo parafoveal, el adelgazamiento de la capa nuclear externa parafoveal y la pérdida de la depresión foveal normal, característica de la toxicidad retiniana por hidroxicloroquina (Figura 3). Las imágenes de autofluorescencia mostraron un anillo de hiperautofluorescencia en la región parafoveal que correspondía al daño de los fotorreceptores y a la disfunción del EPR (Figura 4). El MfERG demostró una disminución de la señal a nivel central en ambos ojos (Figura 5). Nuestro paciente demuestra la importancia de utilizar las nuevas herramientas de cribado recomendadas para la detección de la toxicidad temprana de la hidroxicloroquina. La HVF 10-2, la SD-OCT, la autofluorescencia o la mfERG podrían haber detectado la toxicidad retiniana por hidroxicloroquina el día en que presentó los síntomas y posiblemente antes, limitando potencialmente la cantidad de pérdida visual.
Diagnóstico diferencial
- Degeneración macular asociada a la edad
- Distrofia coroidea areolar central
- Enfermedad de Stargardt
- Distrofia de bastones de cono
- Distrofia anular concéntrica benigna
- Control de referencia en el plazo de 1 año desde el inicio de la medicación.
- Control anual después de cinco años si no hay factores de riesgo.
- Biomicroscopía, HVF 10-2 y SD-OCT en el cribado anual. Pruebas complementarias opcionales si no hay factores de riesgo u otras comorbilidades oculares en el cribado inicial, aunque se suelen realizar.
- Pruebas complementarias opcionales y útiles:
- Autofluorescencia de fondo
- mfERG.
- Signos precoces: Defectos del campo visual en HVF 10-2 (normalmente paracentral), adelgazamiento perifoveal y parafoveal de la retina con pérdida de la unión entre el segmento interno y el externo en SD-OCT, aumento o disminución de la señal en la autofluorescencia, depresión del ERG central/paracentral en mfERG, +/- cambios en la rejilla de Amsler, +/- cambios sutiles en el EPR, +/- disminución de la visión del color
- Signos tardíos: Disminución de la agudeza visual, maculopatía de ojo de buey, hiperfluorescencia paracentral en la angiografía con fluoresceína, adelgazamiento de la retina externa paracentral en la OCT de dominio temporal, defectos de la FV paracentral de 24-2 HVF, disminución de la señal en el ERG de campo completo.
- HCQ: dosis diaria >5 mg/kg de peso real
- CQ: >2.3 mg/kg de peso real
- Duración >5 años de uso
- Sin dosis acumulativa específica
- Enfermedad renal con disminución de la tasa de filtración glomerular.
- Uso de tamofixeno (concomitante)
- Disminución de la visión
- Fotopsias
- Deslumbramiento
- Metamorfopsia
- Paracentral escotomas
- Disminución de la visión nocturna
- Disminución de la visión de los colores
- No hay tratamiento para revertir la toxicidad por cloroquina o hidroxicloroquina.
- Recomendar el cese de la medicación, pero la función visual raramente se recupera, especialmente en las últimas fases de la enfermedad. Puede producirse un deterioro continuado de la función visual durante un año después de suspender la hidroxicloroquina, posiblemente debido a la lenta eliminación del medicamento de la retina y el organismo.
- Tehrani R, Ostrowski RA, Hariman R, Jay WM: Ocular toxicity of hydroxychloroquine. Semin Ophthalmol 2008, 23(3):201-209.
- Marmor MF, Kellner U, Lai TY, Lyons JS, Melles RB, Mieler WF: Recomendaciones sobre el cribado de la retinopatía por cloroquina e hidroxicloroquina (Revisión 2016). Ophthalmology 2016, 123:1386-1394.
- Hobbs HE, Sorsby A, Freedman A: Retinopatía tras el tratamiento con cloroquina. Lancet 1959, 2(7101):478-480.
- Shearer RV, Dubois EL: Cambios oculares inducidos por la terapia a largo plazo con hidroxicloroquina (plaquenil). Am J Ophthalmol 1967, 64(2):245-252.
- Gass JDM: Stereoscopic atlas of macular diseases : diagnosis and treatment, 4th edn. Louis: Mosby; 1997.
- Melles RB, Marmor MF. Retinopatía pericentral y diferencias raciales en la toxicidad de la hidroxicloroquina. Ophthalmology 2015;122:110-6.
- Melles RB, Marmor MF. El riesgo de retinopatía tóxica en pacientes con tratamiento a largo plazo con hidroxicloroquina. JAMA Ophthalmol 2014;132:1453-60.
- Wolfe F, Marmor MF: Tasas y predictores de toxicidad retiniana por hidroxicloroquina en pacientes con artritis reumatoide y lupus eritematoso sistémico. Arthritis Care Res (Hoboken) 2010, 62(6):775-784.
- Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF: Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy. Ophthalmology 2011, 118(2):415-422.
- Lyons JS, Severns ML: Detección de la toxicidad retiniana temprana por hidroxicloroquina mejorada por el análisis de la relación de anillos de la electrorretinografía multifocal. Am J Ophthalmol 2007, 143(5):801-809.
- Yam JC, Kwok AK: Ocular toxicity of hydroxychloroquine. Hong Kong Med J 2006, 12(4):294-304.
- Michaelides M, Stover NB, Francis PJ, Weleber RG: Toxicidad retiniana asociada a la hidroxicloroquina y a la cloroquina: factores de riesgo, cribado y progresión a pesar del cese del tratamiento. Arch Ophthalmol 2011, 129(1):30-39.
- Chen E, Brown DM, Benz MS, Fish RH, Wong TP, Kim RY, Major JC: Tomografía de coherencia óptica de dominio espectral como prueba eficaz de cribado de la retinopatía por hidroxicloroquina (el signo del «platillo volante»). Clin Ophthalmol 2010, 4:1151-1158.
- Kellner U, Renner AB, Tillack H: Fundus autofluorescence and mfERG for early detection of retinal alterations in patients using chloroquine/hydroxychloroquine. Invest Ophthalmol Vis Sci 2006, 47(8):3531-3538.
- Lai TY, Chan WM, Li H, Lai RY, Lam DS: Multifocal electroretinographic changes in patients receiving hydroxychloroquine therapy. Am J Ophthalmol 2005, 140(5):794-807.
- Bernstein HN: Ocular safety of hydroxychloroquine. Ann Ophthalmol 1991, 23(8):292-296.
.rod dystrophy
Control recomendado
|
SignosFactores de riesgo: |
SINTOMAS |
Tratamiento |
Formato de citación sugerido:
Kam JP. Revisión de EyeRounds.org. 14 de septiembre de 2016; Disponible en: http://EyeRounds.org/cases/139-plaquenil-toxicity.htm.
0 comentarios