US Pharm. 2011;36(4):HS2-HS6.
Las neuropatías ópticas son trastornos del nervio óptico que implican la degeneración del mismo.1 La neuropatía óptica no debe confundirse con la neuritis óptica. Ambas pueden provocar problemas de visión; la neuritis óptica implica la inflamación del nervio óptico, mientras que la neuropatía óptica se refiere al daño por cualquier causa. La neuritis óptica es una de las muchas causas de la neuropatía óptica.
Las neuropatías ópticas pueden ser hereditarias o adquiridas. Las etiologías adquiridas de la neuropatía óptica incluyen los tipos isquémico, nutricional y tóxico.1,2 La neuropatía óptica inducida por fármacos es del tipo tóxico. Los mecanismos de la neuropatía óptica inducida por fármacos incluyen la disfunción mitocondrial, la interrupción del flujo sanguíneo al nervio óptico y mecanismos desconocidos.2
Los síntomas comunes de la neuropatía óptica incluyen la disminución de la visión en el campo central, que suele ser bilateral pero puede ser unilateral en algunos casos; los defectos del campo visual y la inflamación del nervio óptico.3 El inicio suele ser lento e indoloro.2
En la neuropatía óptica inducida por fármacos, la retirada del fármaco causante puede conducir al alivio de los síntomas.3,4 Dado que muchos de los medicamentos conocidos como causantes de la neuropatía óptica son comunes, es importante que los farmacéuticos sean conscientes de este efecto adverso para derivar a los pacientes con estos síntomas de manera oportuna y evitar un daño mayor y permanente.
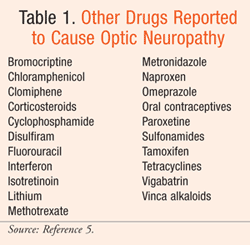
Fármacos que pueden causar neuropatía óptica
Muchos fármacos comúnmente prescritos han sido implicados en la neuropatía óptica. Aquí se comentan los agentes que tienen más información de apoyo: los inhibidores de la fosfodiesterasa tipo 5 (PDE-5), la amiodarona, el linezolid, el etambutol y la isoniazida. En la TABLA 1.5 se enumeran otros fármacos de los que se ha informado que causan neuropatía óptica
Inhibidores de la PDE-5: Esta clase de fármacos ha revolucionado el tratamiento de la disfunción eréctil (DE) en los varones. Actualmente hay tres agentes disponibles: el sildenafilo (Viagra), el tadalafilo (Cialis) y el vardenafilo (Levitra). Ejercen su acción mediante la inhibición selectiva de la PDE tipo 5. Considerados agentes de primera línea para el tratamiento de la disfunción eréctil, se prescriben con mucha frecuencia, y aproximadamente 40 millones de varones en todo el mundo reciben tratamiento para la disfunción sexual con inhibidores de la PDE-5.6 Aunque el sildenafilo, el tadalafilo y el vardenafilo son específicos para la PDE 5, se ha demostrado que estos agentes tienen efectos inhibidores sobre la PDE 6, una isoenzima que se expresa en los bastones y conos del ojo. Se ha teorizado que la inhibición de la PDE 6 da lugar a las numerosas alteraciones visuales asociadas a esta clase de fármacos.7-9 Los inhibidores de la PDE-5 representan aproximadamente el 19% de los informes de la FDA sobre toxicidades oculares asociadas a fármacos, lo que los convierte en la clase de fármacos más comúnmente notificada asociada a esta toxicidad.10
NAION: La vigilancia posterior a la comercialización ha relacionado los inhibidores de la PDE-5 con la neuropatía óptica isquémica anterior no arterítica (NAION). Esta posible relación ha suscitado controversia. Desde el año 2000, se han publicado al menos 20 informes de casos que describen el uso de inhibidores de la PDE-5 y la sospecha de NAION.11,12 La mayor parte de la literatura publicada está relacionada con el uso de sildenafilo, ya que éste fue el primer agente de esta clase que se comercializó (el sildenafilo se introdujo en 1998, 5 años antes que el tadalafilo y el vardenafilo). Hasta la fecha, no se han publicado informes de casos relacionados con vardenafilo.
La NAION es un trastorno ocular bastante infrecuente en la población general que se produce de forma repentina, suele ser indolora y da lugar a una pérdida parcial irreversible de la visión.11,13 Aunque es la neuropatía óptica aguda más frecuente en personas mayores de 50 años, sólo se registran entre 1.500 y 6.000 casos anuales en Estados Unidos.14 La etiología de la NAION no se conoce bien, pero se cree que está causada por una escasez de suministro de sangre al nervio óptico. Un factor de riesgo bien establecido para el desarrollo de la NAION se da en individuos que tienen un disco pequeño y una copa fisiológica pequeña o ausente (es decir, cuando el nervio óptico es casi tan grande como la abertura en la parte posterior del ojo y el disco óptico parece «abarrotado»), también conocido como disco en riesgo o disco abarrotado. Otros factores de riesgo asociados son la diabetes, la hipertensión, la hipercolesterolemia, la aterosclerosis, la cardiopatía isquémica, la apnea del sueño y la hipotensión nocturna. Muchos de estos factores de riesgo también se asocian a la disfunción eréctil.8,11
De los casos de NAION notificados, la mayoría se produjeron en las 24 horas siguientes a la administración, normalmente al despertar por la mañana. Los pacientes presentaron visión borrosa y pérdida del campo visual.15 Además, se observó que la mayoría de los pacientes tenían disco apiñado como factor de riesgo junto con diversas enfermedades cardiovasculares, que se consideran factores de riesgo tanto para la NAION como para la DE.
En un estudio de cohorte retrospectivo que utilizó las bases de datos farmacéuticas y clínicas de la Administración Nacional de Salud de los Veteranos entre 2004 y 2005, se evaluó una cohorte de 2 años de hombres (aproximadamente 4 millones) que tenían al menos 50 años de edad sin antecedentes de enfermedad del nervio óptico.16 A aproximadamente el 11,5% de estos pacientes se les dispensó un inhibidor de la PDE-5; a la mayoría se les prescribió sildenafilo 100 mg. De esta cohorte, el 0,09% de los pacientes tenía un diagnóstico de nueva neuropatía óptica isquémica, con un riesgo relativo de 1,02 (intervalo de confianza del 95% , 0,92-1,12).
Otro estudio retrospectivo evaluó a 38 hombres con NAION y los comparó con 38 hombres sin antecedentes de la enfermedad.17 No hubo una diferencia general marcada en el uso de inhibidores de la PDE-5 en ninguno de los dos grupos; sin embargo, se observó una asociación significativa para aquellos pacientes con antecedentes de infarto de miocardio y uso de inhibidores de la PDE-5 y la aparición de NAION (P = 0,04). Del mismo modo, la incidencia de NAION fue mayor en aquellos pacientes con antecedentes de hipertensión y uso de inhibidores de la PDE-5, aunque esto no fue significativo (P = 0,07).17
El mecanismo de acción de este efecto adverso de los inhibidores de la PDE-5 no se comprende del todo, y esto se debe en parte a que el mecanismo de acción para el desarrollo de NAION no se conoce del todo. Se ha sugerido que la hipotensión nocturna puede desempeñar un papel en el desarrollo de la NAION, y que los inhibidores de la PDE-5 pueden potenciar este efecto, dando lugar en última instancia a la isquemia del nervio óptico.12,13,18
La incidencia de casos de NAION en hombres que utilizan inhibidores de la PDE-5 en todo el mundo coincide con la de la población general de Estados Unidos.14 La Organización Mundial de la Salud (OMS) y la FDA han identificado la asociación de la NAION y los inhibidores de la PDE-5 como una «posible» causalidad. Un acontecimiento adverso «posible» «se produce dentro de un plazo razonable tras la administración del fármaco, pero también podría explicarse por una enfermedad concurrente u otros fármacos o sustancias químicas». En 2005, la FDA recomendó que se actualizara el etiquetado del producto para incluir una declaración que describiera esta asociación temporal con el uso de los inhibidores de la PDE-5. Hasta la fecha, no existen pruebas convincentes que sugieran que el uso de inhibidores de la PDE-5 se asocie a una mayor incidencia de NAION.
Los pacientes que han experimentado un episodio de NAION deben evitar el uso de inhibidores de la PDE-5, ya que estos individuos pueden ser susceptibles de desarrollar NAION en el ojo contralateral.13,19,20 Algunos oftalmólogos conservadores también pueden recomendar que se evite el uso de estos agentes en aquellos pacientes que tengan un disco pequeño en riesgo, un criterio que puede requerir que todos los pacientes se sometan a un examen oftalmológico antes de iniciar el tratamiento.13 Los pacientes que estén utilizando inhibidores de la PDE-5 deben ser asesorados sobre el riesgo de desarrollo de NAION. Si notan una pérdida de visión repentina, deben interrumpir el uso del inhibidor de la PDE-5 y buscar atención médica inmediatamente. Todas las incidencias deben notificarse también a la FDA, incluyendo información sobre la duración y la dosis del fármaco, el tiempo transcurrido desde la ingestión del inhibidor de la PDE-5 hasta el inicio de los hallazgos y cualquier hallazgo del examen oftalmológico.19
Amiodarona: Este fármaco, un agente antiarrítmico de clase III utilizado principalmente para las arritmias ventriculares, ha sido implicado en varios tipos de cambios en la visión, incluyendo anormalidades en la córnea, efectos en la conjuntiva y neuropatía óptica, pero se desconoce el mecanismo exacto de la neuropatía óptica.21 Se han notificado cambios visuales con una prevalencia variable del 0% al 11,4% en pacientes que toman este fármaco; en un estudio se descubrió que la neuropatía óptica ocurría en el 1,79% de los pacientes.20 La afección suele aparecer de forma insidiosa, tarda meses en resolverse y se presenta de forma bilateral.4,21,22 Se ha observado que la neuropatía óptica inducida por la amiodarona es muy similar a la NAION, pero se diferencia de ésta en que la NAION suele tener un inicio rápido, una resolución rápida y una presentación unilateral.4,21 Distinguir el NAION de la neuropatía óptica inducida por amiodarona suele ser difícil.20
La información de prescripción de amiodarona recomienda realizar exámenes oftalmológicos regulares, incluso al inicio y luego cada 6 meses, a los pacientes que reciben el medicamento.4,23 Algunos autores han sugerido que puede estar justificado realizar exámenes oftalmológicos más frecuentes, cada 4 meses durante un máximo de un año tras el inicio del tratamiento.21 Como agente antiarrítmico, la amiodarona no suele ser intercambiable con otros fármacos, y la decisión de cambiar de terapia debe realizarse en consulta con el oftalmólogo y el cardiólogo del paciente.
Linezolid: este antibiótico de oxazolidinona se utiliza por su eficacia contra los organismos grampositivos, específicamente el Staphylococcus aureus resistente a la meticilina (SARM). Su seguridad general se ha demostrado en ensayos clínicos de hasta 28 días de tratamiento. La neuropatía óptica se ha asociado con el uso a largo plazo de linezolid, con una duración del tratamiento que oscila entre 5 y 11 meses en dosis de 600 a 1.200 mg/día, muy por encima de las duraciones de los ensayos clínicos estudiados de 28 días o menos.4,24 Sin embargo, la literatura más reciente informa de neuropatía óptica después de una duración más corta del tratamiento de sólo 16 días.25,26
Los síntomas son graduales, y hay un inicio indoloro de la pérdida de visión bilateral. La interrupción del linezolid ha conducido a la mejora de los síntomas visuales en todos los casos notificados. Se desconoce el mecanismo de la neuropatía óptica inducida por el linezolid, pero puede deberse a la toxicidad mitocondrial por la unión al ARNr 16S mitocondrial.27 El linezolid penetra bien en el sistema nervioso central y en el ojo, lo que puede provocar una mayor neurotoxicidad.24,28 La retirada del linezolid y el cambio de la terapia antibacteriana a otro agente puede ayudar a la recuperación, aunque en algunos casos puede ser necesario continuar con el linezolid para tratar adecuadamente ciertas infecciones.2 Se recomiendan exámenes oftalmológicos iniciales y periódicos para los pacientes que reciben un tratamiento a largo plazo con linezolid.4
Etambutol: Este fármaco, un agente de primera línea en el tratamiento y la prevención de la tuberculosis, causa numerosos efectos adversos oculares. Está bien documentado que causa neuropatía óptica hasta en el 5% de los pacientes que toman el fármaco.2 El mecanismo de este efecto adverso no está completamente claro, pero se ha especulado que está relacionado con la quelación del cobre en las células de la retina.4
La mayoría de los pacientes con este efecto adverso habían tomado dosis de 60 a 100 mg/kg/día con inicio de los síntomas después de 2 a 12 meses de tratamiento.4,29 La dosis diaria de etambutol aprobada por la FDA en el tratamiento de la tuberculosis es de 15 a 25 mg/kg/día. Se cree que la neuropatía óptica inducida por etambutol está relacionada con la dosis; se produce en tasas del 18% de los pacientes con una dosis de 35 mg/kg/día, del 5% al 6% con 25 mg/kg/día y menos del 1% con 15 mg/kg/día.30 Se recomienda ajustar la dosis en los pacientes con insuficiencia renal, ya que un aclaramiento inadecuado del fármaco puede provocar una toxicidad ocular adicional.
La pérdida de visión asociada a etambutol se ha notificado comúnmente como reversible; sin embargo, puede ser irreversible en ciertas poblaciones, incluyendo pacientes geriátricos y aquellos que recibieron el medicamento de forma crónica.30
Etambutol está contraindicado en pacientes con antecedentes de neuritis óptica a menos que el juicio clínico justifique su uso.31 Deben realizarse exámenes oftalmológicos iniciales y periódicos; la información de prescripción de etambutol recomienda exámenes mensuales para los pacientes que toman >15 mg/kg/día.31 Algunos autores han sugerido que las pruebas anuales pueden ser apropiadas para aquellos pacientes que toman <15 mg/kg/día, con un control más frecuente para aquellos con alto riesgo de desarrollar neuropatía óptica. Esto incluiría a los pacientes mayores de 60 años o menores de 16 años; aquellos con enfermedad renal, alcoholismo o neuropatía periférica; los que toman más de 15 mg/kg/día; o el tratamiento durante más de 6 meses.2 Los pacientes que presenten síntomas de neuropatía óptica deben ser evaluados, y el medicamento debe ser suspendido.
Isoniazida: Este antibiótico es otro fármaco utilizado en el tratamiento y prevención de la tuberculosis. Se ha notificado que causa neuropatía óptica; sin embargo, dado que la isoniazida se utiliza junto con el etambutol, que también está implicado en la neuropatía óptica, determinar la causa de los problemas de visión suele ser difícil.20 Se cree que la neuropatía óptica inducida por isoniazida es menos frecuente y reversible.2
Tratamiento
Una evaluación oftalmológica rápida es primordial, y eso, junto con la interrupción del fármaco agresor cuando sea posible, constituye la base del tratamiento de la neuropatía óptica inducida por fármacos.4 Aunque a menudo se recomienda la interrupción del fármaco, esto puede no ser siempre posible, ya que pueden ser necesarios medicamentos como la amiodarona, el linezolid y el etambutol para tratar al paciente de forma óptima. En estas circunstancias, es necesario un seguimiento cuidadoso y una atención continua por parte de un oftalmólogo.
Implicaciones
Muchos medicamentos pueden causar efectos adversos oculares, y los riesgos potenciales deben ser discutidos con los pacientes antes de iniciar la terapia. Los farmacéuticos se encuentran en la posición única de ser el proveedor de atención médica más accesible; pueden ser los que los pacientes consultarán más probablemente cuando experimenten efectos adversos debido a sus medicamentos. Puede que no sea posible conocer todos los efectos adversos oculares inducidos por los medicamentos, pero es importante reconocer que muchos medicamentos sistémicos pueden afectar a la salud ocular. La detección temprana puede prevenir o minimizar los daños graves. Los farmacéuticos deben ser conscientes de que la mayoría de los pacientes que experimentan una neuropatía óptica inducida por medicamentos presentarán una disminución de la visión.2 Se debe aconsejar a cualquier paciente que se queje de una disminución repentina e indolora de la visión que informe de estos cambios inmediatamente.
Además de ponerse en contacto con la FDA y el fabricante del medicamento, los farmacéuticos pueden notificar los casos sospechosos de neuropatía óptica inducida por medicamentos al Registro Nacional de Efectos Secundarios Oculares Inducidos por Medicamentos (www.eyedrugregistry.com). La información que será útil a la hora de notificar las reacciones adversas oculares incluye el nombre del fármaco, la duración y la dosis; el tiempo transcurrido desde la ingestión del fármaco hasta el inicio de los hallazgos; y cualquier hallazgo en el examen oftalmológico.
1. O’Neill EC, Danesh-Meyer HV, Connell PP, et al. La cabeza del nervio óptico en las neuropatías ópticas adquiridas. Nat Rev Neurol. 2010;6:221-236.
2. Lloyd MJ, Fraunfelder FW. Neuropatías ópticas inducidas por fármacos. Drugs Today. 2007;43:827-836.
3. Spiteri MA, James DG. Adverse ocular reactions to drugs. Postgrad Med J. 1983;59:343-349.
4. Li J, Tripathi RC, Tripathi BJ. Drug-induced ocular disorders. Drug Saf. 2008;21:127-141.
5. Kaakeh Y, Abel SR. Trastornos visuales. En: Tisdale JE, Miller DA, eds. Drug-Induced Diseases: Prevention, Detection, and Management. 2nd ed. Bethesda, MD: American Society of Health-Systems Pharmacists; 2010:
250-274.
6. Hatzimouratidis K, Hatzichristou D. Phosphodiesterase type 5 inhibitors: the day after. Eur Urol. 2007;51:75-89.
7. Lee M. Chapter 86. Disfunción eréctil. En: DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy: A Pathophysiologic Approach. 7th ed. New York, NY: McGraw-Hill; 2010. www.accesspharmacy.com/content.aspx?aID=3209583. Consultado el 24 de febrero de 2011.
8. Kerr NM, Danesh-Meyer HV. Inhibidores de la fosfodiesterasa y el ojo. Clin Experiment Ophthalmol. 2009;37:514-523.
9. Bischoff E. Potency, selectivity, and consequences of nonselectivity of PDE inhibition. Int J Impot Res. 2004;16(suppl 1):S11-S14.
10. Barbehenn E, Lurie P, Wolfe SM, et al. Petition to the FDA to require a black box warning for erectile dysfunction drugs sildenafil (Viagra), tadalafil (Cialis), vardenafil (Levitra) to warn of the potential for irreversible vision loss. Public Citizen. 20 de octubre de 2005. www.citizen.org/hrg1753. Consultado el 24 de febrero de 2011.
11. Laties AM. Trastornos de la visión e inhibidores de la fosfodiesterasa tipo 5: una revisión de la evidencia hasta la fecha. Drug Safety. 2009;32:1-18.
12. Danesh-Meyer HV, Levin HA. Fármacos para la disfunción eréctil y riesgo de neuropatía óptica isquémica anterior: ¿asociación casual o causal? Br J Ophthalmol. 2007;91:1551-1555.
13. Carter JE. Neuropatía óptica isquémica anterior y accidente cerebrovascular con el uso de inhibidores de la PDE-5 para la disfunción eréctil: ¿causa o coincidencia? J Neurol Sci. 2007;262:89-97.
14. Gorkin L, Hvidsten, Sobel RE, et al. Sildenafil citrate use and the incidence of nonarteritic anterior ischemic optic neuropathy. Int J Clin Pract. 2006;60:500-503.
15. Pomeranz HD, Bhavsar AR. Nonarteritic ischemic optic neuropathy developing soon after use of sildenafil (Viagra): a report of seven new cases. J Neurol Ophthalmol. 2005;25:9-13.
16. Margo CE, French DD. Ischemic optic neuropathy in male veterans prescribed phosphodiesterase-5 inhibitors. Am J Ophthalmol. 2007;143:538-539.
17. McGwin G, Vaphiades MS, Hall TA, et al. Non-arteritic anterior ischaemic optic neuropathy and the treatment of erectile dysfunction. Br J Ophthalmol. 2006;90:154-157.
18. Fraunfelder FW. Efectos secundarios visuales asociados a los agentes para la disfunción eréctil. Am J Ophthalmol. 2005;140:723-724.
19. McKoy JM, Bolden CR, Samaras A, et al. Sildenafil- and tadalafil-associated optic neuropathy: implications for men after prostate cancer treatment. Community Oncol. 2009;6:78-79.
20. Santaella RM, Fraunfelder FW. Efectos adversos oculares asociados a medicamentos sistémicos. Drugs. 2007;67:75-93.
21. Johnson LN, Krohel GB, Thomas ER. El espectro clínico de la neuropatía óptica asociada a la amiodarona. J Nat Med Assoc. 2004;96:1477-1491.
22. Mantyjarvi M, Tuppurainen K, Ikaheimo K. Ocular side effects of amiodarone. Surv Ophthalmol. 1998;42:360-366.
23. Prospecto de Cordarone (amiodarona HCl). Philadelphia, PA: Wyeth Pharmaceuticals, Inc; diciembre de 2010.
24. Jahaveri M, Khurana RN, O’Hearn TM, et al. Neuropatía óptica inducida por linezolid: ¿un trastorno mitocondrial? Br J Ophthalmol. 2007;91:111-115.
25. Azamfirei L, Copotoiu SM, Branzaniuc K, et al. Ceguera completa tras una neuropatía óptica inducida por el tratamiento a corto plazo con linezolid en un paciente que padece distrofia muscular. Pharmacoepidemiol Drug Saf. 2007;16:402-404.
26. Joshi L, Taylor SR, Large O, et al. Un caso de neuropatía óptica tras el uso de linezolid a corto plazo en un paciente con leucemia linfocítica aguda. Clin Infect Dis. 2009;48:e73-e74.
27. Narita M, Tsuji BT, Yu VL. Linezolid-associated peripheral and optic neuropathy, lactic acidosis, and serotonin syndrome. Pharmacotherapy. 2007;27:1189-1197.
28. Rucker JC, Hamilton SR, Bardenstein D, et al. Linezolid-associated toxic optic neuropathy. Neurology. 2006;66:595-598.
29. Melamud A, Kosmorsky GS, Lee MS. Ocular ethambutol toxicity. Mayo Clin Proc. 2003;78:1409-1411.
30. Kokkada SB, Barthakur R, Natarajan M, et al. Ocular side effects of antitubercular drugs-a focus on prevention, early detection and management. Kathmandu Univ Med J. 2005;3:438-441.
31. Prospecto de Myambutol (etambutol). Northport, NY: X-Gen Pharmaceuticals, Inc; mayo de 2007.
0 comentarios