Los potenciales de acción en las células receptoras viajan como impulsos nerviosos con diferentes velocidades
Cuando pisas un alfiler, esto activa una gran cantidad de mecanorreceptores, muchos de los cuales son nociceptores. Habrás notado que la sensación cambia con el tiempo. Primero sientes una fuerte punzada que te impulsa a retirar el pie, y sólo entonces sientes una oleada de más dolor. La punzada aguda se señala a través de las fibras A de conducción rápida, que se proyectan a la corteza somatosensorial. Esta parte del córtex está organizada somatotópicamente, es decir, las señales sensoriales se representan según el lugar del cuerpo del que proceden (véase la ilustración del homúnculo, Figura 2). El dolor desagradable que se siente tras la fuerte puñalada de un alfiler es una señal separada y simultánea que se envía desde los nociceptores del pie a través de las finas fibras C-dolor o Aδ a la corteza insular y a otras regiones cerebrales implicadas en el procesamiento de la emoción y la interocepción (véase la Figura 3a para una representación esquemática de esta vía). La experiencia de pisar un alfiler está compuesta, en otras palabras, por dos señales separadas: una señal discriminatoria que nos permite localizar el estímulo táctil y distinguir si se trata de una puñalada roma o afilada; y una señal afectiva que nos hace saber que pisar el alfiler es malo. Es habitual dividir el dolor en aspectos sensoriales-discriminatorios y afectivos-motivacionales (Auvray, Myin, & Spence, 2010). Esta distinción se corresponde, al menos en parte, con el modo en que esta información viaja desde la periferia hasta el sistema nervioso central y cómo se procesa en el cerebro (Price, 2000).

Figura 2. El Homúnculo: Homúnculo significa «hombrecito», y aquí se ve un modelo a escala del cuerpo humano distorsionado para reflejar el espacio relativo que ocupan las partes del cuerpo en la corteza somatosensorial. Como puede verse, los labios, las manos, los pies y los genitales envían más proyecciones somatosensoriales al cerebro que cualquier otra parte del cuerpo. Figura 2b. Mapa cortical del homúnculo sensorial: Las partes del cuerpo están representadas en lugares específicos de la corteza somatosensorial. Las representaciones se mapean somatotópicamente, con los pies localizados medialmente y los hombros y brazos lateralmente a la fisura interhemisférica. Las estructuras faciales se representan en una ubicación diferente a la del cuero cabelludo y la cabeza; la cara orientada «al revés» con la frente apuntando hacia los hombros.
El dolor es necesario para la supervivencia, pero nuestro cerebro puede detenerlo si lo necesita
En abril de 2003, el escalador Aron Ralston se encontró en el suelo del cañón Blue John, en Utah, obligado a tomar una decisión atroz: enfrentarse a una muerte lenta pero segura, o amputarse el brazo derecho. Cinco días antes se había caído por el cañón y desde entonces tenía el brazo derecho atrapado entre una roca de 800 libras y la escarpada pared de arenisca. Debilitado por la falta de comida y agua y a punto de rendirse, se le ocurrió como una epifanía que si se rompía los dos huesos del antebrazo podría conseguir cortar el resto con su navaja. La idea de liberarse y sobrevivir le entusiasmó tanto que pasó los siguientes 40 minutos completamente absorto en la tarea: primero rompiendo los huesos usando su cuerpo como palanca, luego metiendo los dedos en el brazo, pellizcando haces de fibras musculares y seccionándolos uno a uno, antes de cortar las arterias azules y los pálidos nervios «en forma de fideo». El dolor no era importante. Sólo el corte del grueso nervio principal blanco le hizo detenerse durante un minuto; el torrente de dolor, describe, era como meter todo el brazo «en una caldera de magma». Por fin se liberó, descendió a rapel por un acantilado y caminó otros 11 kilómetros hasta que fue rescatado por unos excursionistas (Ralston, 2010).
¿Cómo es posible hacer algo tan insoportablemente doloroso para uno mismo, como hizo Aron Ralston, y aún así conseguir caminar, hablar y pensar racionalmente después? La respuesta está en el cerebro, donde se interpretan las señales del cuerpo. Cuando percibimos las señales somatosensoriales y nociceptivas del cuerpo, la experiencia es altamente subjetiva y maleable por la motivación, la atención, la emoción y el contexto.
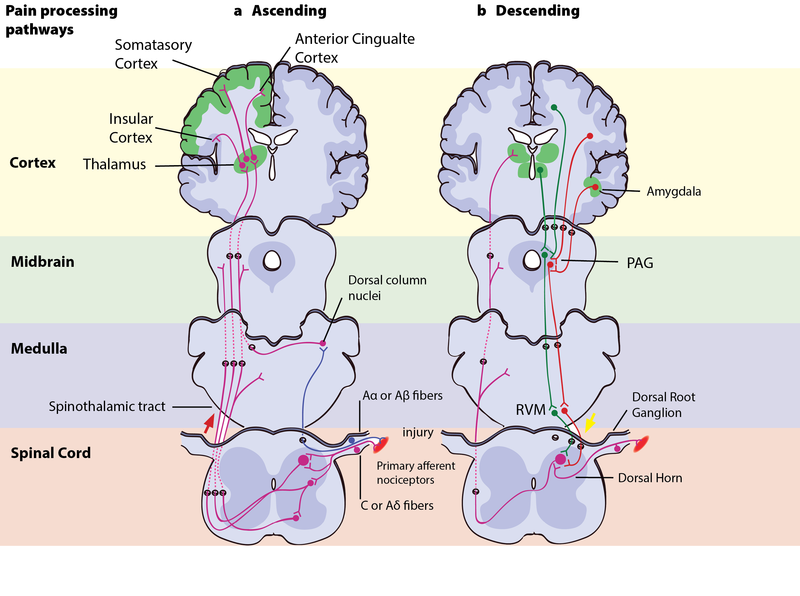
Figura 3. Vías de procesamiento del dolor. Izquierda – Vías ascendentes del dolor: Una lesión se señala simultáneamente a través de las fibras Aα o Aβ de conducción rápida y las fibras C o Aδ de conducción lenta. Las fibras A rápidas señalan la presión, el estiramiento y otros movimientos de los tejidos a la corteza somatosensorial a través de los núcleos de la columna dorsal. Las fibras C-dolor y Aδ envían información sobre el dolor desde los nociceptores del tejido o la piel, y transmiten estas señales a las neuronas de segundo orden del asta dorsal de la médula espinal. Las neuronas de segundo orden cruzan entonces al lado opuesto, donde forman el tracto espinotalámico ascendente. Este tracto proyecta las señales a los núcleos de la médula y el mesencéfalo en su camino hacia el tálamo (T). El tálamo transmite la información al córtex somatosensorial e insular, así como a las regiones corticales que median en diferentes aspectos de la experiencia del dolor, como las respuestas afectivas en el córtex cingulado. Derecha – Vías descendentes de modulación del dolor: La información del entorno y ciertos estados motivacionales pueden activar esta vía descendente. Varias áreas del prosencéfalo límbico, como el cíngulo anterior y la corteza insular, los núcleos de la amígdala y el hipotálamo (H), se proyectan al gris periacueductal (PAG) del cerebro medio, que luego modula la transmisión ascendente del dolor desde el sistema aferente del dolor de forma indirecta a través de la médula ventromedial rostral (RVM) en el tronco cerebral. Este sistema modulador produce analgesia mediante la liberación de opioides endógenos, y utiliza células ON y OFF para ejercer un control inhibitorio (verde) o facilitador (rojo) de las señales nociceptivas en el asta dorsal espinal.
El Modelo de Motivación-Decisión y la Modulación Descendente del Dolor
Según el modelo de motivación-decisión, el cerebro evalúa automática y continuamente los pros y los contras de cualquier situación, sopesando las amenazas inminentes y las recompensas disponibles (Fields, 2004, 2006). Cualquier cosa más importante para la supervivencia que evitar el dolor activa el sistema cerebral de modulación del dolor descendente -un sistema descendente que implica a varias partes del cerebro y del tronco cerebral- que inhibe la señalización nociceptiva para poder atender las acciones más importantes.
En el caso extremo de Aron, es probable que sus acciones se basaran en un proceso de decisión inconsciente de este tipo, teniendo en cuenta su estado homeostático (su hambre, su sed, la inflamación y el deterioro de su mano aplastada que afectaba lentamente al resto de su cuerpo), la información sensorial disponible (el dulce olor de su piel en proceso de disolución, el silencio que le rodeaba y que indicaba su soledad) y su conocimiento de las amenazas a las que se enfrentaba (la muerte o un dolor insoportable que no le mataría) frente a las posibles recompensas (la supervivencia, volver a ver a su familia). La historia de Aron ilustra la ventaja evolutiva de ser capaz de desconectar el dolor: El sistema modulador del dolor descendente nos permite seguir adelante con acciones potencialmente salvadoras de la vida.
Sin embargo, cuando uno ha alcanzado la seguridad o ha obtenido la recompensa, la curación es más importante. El mismo sistema descendente puede entonces «arrancar» la nocicepción del cuerpo para promover la curación y motivarnos a evitar acciones potencialmente dolorosas. Para facilitar o inhibir las señales nociceptivas del cuerpo, el sistema descendente de modulación del dolor utiliza un conjunto de células ON o OFF en el tronco cerebral, que regula la cantidad de señal nociceptiva que llega al cerebro. El sistema descendente depende de la señalización opioide, y los analgésicos como la morfina alivian el dolor a través de este circuito (Petrovic, Kalso, Petersson, & Ingvar, 2002).
El poder analgésico de la recompensa
Pensar en las cosas buenas, como sus seres queridos y la vida que le esperaba, fue probablemente fundamental para la supervivencia de Aron. La promesa de una recompensa puede ser suficiente para aliviar el dolor. Esperar que un tratamiento médico alivie el dolor (recibir menos dolor es a menudo el mejor resultado posible si se tiene dolor, es decir, es una recompensa) contribuye al efecto placebo: el alivio del dolor se debe, al menos en parte, al circuito de modulación descendente del cerebro, y dicho alivio depende del propio sistema opioide del cerebro (Eippert et al, 2009; Eippert, Finsterbusch, Bingel, & Buchel, 2009; Levine, Gordon, & Fields, 1978). Comer alimentos sabrosos, escuchar buena música o sentir un tacto agradable en la piel también disminuye el dolor tanto en animales como en humanos, presumiblemente a través del mismo mecanismo en el cerebro (Leknes & Tracey, 2008).
En un experimento ya clásico, Dum y Herz (1984) alimentaron a ratas con comida normal para ratas o las dejaron darse un festín de caramelos cubiertos de chocolate muy gratificantes (a las ratas les encantan los dulces) mientras estaban de pie sobre una placa de metal hasta que aprendieron exactamente lo que debían esperar cuando se colocaban allí. Cuando el plato se calentó hasta un nivel nocivo/doloroso, las ratas que esperaban caramelos soportaron la temperatura el doble de tiempo que las que esperaban comida normal. Además, este efecto quedaba completamente abolido cuando se bloqueaba el sistema opioide (de endorfinas) de las ratas con un fármaco, lo que indica que el efecto analgésico de la anticipación de la recompensa era causado por la liberación de endorfinas.
Para Aron el escalador, tanto el estrés de saber que la muerte era inminente como la anticipación de la recompensa que supondría sobrevivir probablemente inundaron su cerebro de endorfinas, contribuyendo a la ola de excitación y euforia que experimentó mientras realizaba la amputación «como un niño de cinco años desatado con sus regalos de Navidad» (Ralston, 2010). Esto alteró su experiencia del dolor por el daño tisular extremo que estaba causando y le permitió concentrarse en liberarse. Resulta que nuestro cerebro puede modular la percepción de lo desagradable que es el dolor, sin perder la capacidad de experimentar la intensidad de la sensación (Rainville, Duncan, Price, Carrier, & Bushnell, 1997; Rainville, Feine, Bushnell, & Duncan, 1992). Las recompensas sociales, como coger la mano de tu novio o novia, tienen efectos reductores del dolor. Incluso mirar una foto suya puede tener efectos similares; de hecho, ver una foto de una persona a la que nos sentimos cercanos no solo reduce las calificaciones subjetivas de dolor, sino también la actividad en áreas cerebrales relacionadas con el dolor (Eisenberger et al., 2011). Lo más habitual cuando se quiere ayudar a alguien en una experiencia dolorosa -estar presente y coger la mano de la persona- parece tener un efecto positivo medible.
El poder de la mente
El contexto del dolor y el tacto tiene un gran impacto en cómo lo interpretamos. Sólo hay que imaginar lo diferente que se sentiría Aron si alguien le amputara la mano en contra de su voluntad y sin ninguna razón discernible. El dolor prolongado de las lesiones puede ser más fácil de soportar si el incidente que las causa proporciona un contexto positivo -como una herida de guerra que atestigua el valor y el compromiso de un soldado- o el dolor fantasma de una mano que se cortó para permitir que la vida continuara.
El significado relativo del dolor se ilustra con un experimento reciente, en el que se administró el mismo calor moderadamente doloroso a los participantes en dos contextos diferentes: un contexto de control en el que la alternativa era un calor no doloroso; y otro en el que la alternativa era un calor intensamente doloroso. En el contexto de control, en el que el calor moderado era el resultado menos preferible, fue calificado (como no es de extrañar) como doloroso. En el otro contexto era el mejor resultado posible, y aquí el mismo calor moderadamente doloroso fue calificado como agradable, porque significaba que se había evitado el calor intensamente doloroso. Este cambio de percepción, un tanto sorprendente, en el que el dolor se vuelve agradable porque representa un alivio de algo peor, pone de manifiesto la importancia del significado que los individuos atribuyen a su dolor, que puede tener efectos decisivos en el tratamiento del dolor (Leknes et al., 2013). En el caso del tacto, saber quién o qué te acaricia la piel puede marcar la diferencia: prueba a pensar en las babosas la próxima vez que alguien te acaricie la piel si quieres una ilustración de este punto.
El dolor y el placer no solo comparten sistemas moduladores: otro atributo común es que no necesitamos estar en el extremo receptor para experimentarlo. ¿Cómo te sentiste cuando leíste que Aron cortaba su propio tejido, o que «Thomas» destruía sus propios huesos sin saberlo? ¿Se estremeció? Es muy probable que algunas de las áreas cerebrales que procesan los aspectos afectivos del dolor estuvieran activas aunque los nociceptores de la piel y los tejidos profundos no estuvieran disparando. El dolor puede experimentarse de forma vicaria, al igual que el picor, el tacto placentero y otras sensaciones. Tania Singer y sus colegas descubrieron en un estudio de IRMf que algunas de las mismas áreas cerebrales que se activaban cuando los participantes sentían dolor en su propia piel (el cíngulo anterior y la ínsula) también se activaban cuando recibían una señal de que un ser querido estaba sintiendo el dolor. Los más «empáticos» también mostraron las mayores respuestas cerebrales (Singer et al., 2004). Se ha encontrado un efecto similar para el tacto placentero: La ínsula posterior de los participantes que ven vídeos en los que se acaricia suavemente el brazo de otra persona muestra la misma activación que si ellos mismos recibieran el tacto (Morrison, Bjornsdotter, & Olausson, 2011).
0 comentarios