COVID-19, desencadenado por el betacoronavirus SARS-CoV-2, se ha convertido en una de las peores pandemias de nuestro tiempo, causando una alta incidencia de neumonía, síndrome de dificultad respiratoria aguda (SDRA) y muerte3,4. Una de las características más notables de la infección por SARS-CoV-2 es que pasa desapercibida durante un periodo de tiempo notablemente prolongado, siguiendo un curso de enfermedad leve o sin complicaciones durante semanas hasta que se desarrollan síntomas repentinos y graves en un subgrupo de pacientes, que requieren hospitalización, soporte de oxígeno y/o ingreso en una unidad de cuidados intensivos (UCI)3,4. Este escenario es coherente con un periodo de incubación del virus inusualmente largo, que oscila entre 2 y 14 días, y con una presencia inusualmente larga del virus en el tracto respiratorio, que a menudo es detectable durante más de un mes después de la infección inicial mediante pruebas de diagnóstico molecular convencionales5,6. En comparación, la infección por el virus de la gripe, el principal virus respiratorio responsable de las hospitalizaciones por neumonía hasta ahora, tiene un tiempo de incubación de 1 a 4 d, una ventana corta de positividad del virus de unos pocos días y un inicio abrupto de los síntomas que causan neumonía en 1-3 d7,8. Otros virus respiratorios frecuentes, como los virus sinciciales respiratorios, los rinovirus, los virus de la parainfluenza, los metapneumonovirus y los coronavirus del resfriado común, tienen también tiempos de incubación más cortos (que van de 1 a 5 d) y una manifestación más rápida y aguda de los síntomas9 , lo que hace que el SARS-CoV-2 sea bastante único en ese sentido. La base de esta diferencia se desconoce, pero es probable que sea un factor clave de la fisiopatología de COVID-19 que subyace a su curso distintivo de la enfermedad y a sus manifestaciones clínicas.
El sello distintivo de COVID-19 es el desarrollo de una respuesta hiperinflamatoria, también conocida como «tormenta de citoquinas», que deteriora la función de intercambio de gases y conduce al SDRA, al fallo multiorgánico y a la muerte10,11,12. Nosotros y otros hemos demostrado previamente que una respuesta antiviral bien ajustada, orquestada por el IFN-λ (IFN tipo III) y el IFN tipo I, es fundamental para equilibrar la inmunidad y conseguir una protección óptima y un daño mínimo13,14,15. La desviación de este equilibrio puede desencadenar una «tormenta de citoquinas» perjudicial con consecuencias devastadoras para la salud humana. Un estudio reciente sugirió que en los pacientes con COVID-19 no se producen IFN de tipo I ni IFN-λ, ya que no pudieron detectarse en los sueros de una pequeña cohorte de COVID-19 de características clínicas no especificadas16. Por el contrario, otro estudio informó de que el IFN de tipo I se induce en los pacientes con COVID-19 e indicó que su concentración podría estar reducida en los que están gravemente enfermos17. Esta discrepancia podría deberse al hecho de que cada uno de estos estudios se centra en una única y probablemente distinta instantánea de un proceso de enfermedad aparentemente heterogéneo. Por lo tanto, la realización de análisis cinéticos es pertinente para delinear el curso de la respuesta inmunitaria, especialmente teniendo en cuenta que las citocinas se producen de forma transitoria. Este criterio es especialmente cierto en el caso de los IFN, que se expresan al principio de la infección y se reducen rápidamente después.
Aquí hemos realizado un análisis temporal exhaustivo de los IFN tipo I y tipo III y de los principales patrones de citoquinas inflamatorias en 32 pacientes con COVID-19 y 16 pacientes con gripe hospitalizados por neumonía adquirida en la comunidad y seguidos longitudinalmente según las directrices actuales de la Organización Mundial de la Salud18. Ambos grupos de pacientes presentaban características clinicopatológicas similares y una gravedad de la enfermedad comparable en el momento del ingreso (Tabla suplementaria 1). También hemos analizado a 24 pacientes con casos más leves de gripe sin hallazgos radiológicos de neumonía y sin necesidad de hospitalización (denominados gripe leve; Tabla Suplementaria 1), así como a 10 individuos sanos. Utilizando ensayos Luminex y ELISA de alta sensibilidad, cuantificamos 18 citocinas y quimiocinas relevantes para la inmunidad antiviral y la hiperinflamación en el suero de los pacientes recogido en intervalos de tiempo definidos tras el ingreso en el hospital (Fig. 1a y Extended Data Fig. 1a). Este análisis alinea a los pacientes sobre la base de los mismos criterios clínicos de síntomas y gravedad de la enfermedad, principalmente la presencia de neumonía y la necesidad de soporte de oxígeno.

a, Esquema que muestra el diseño experimental con muestreo en intervalos de tiempo específicos tras el ingreso hospitalario de 32 pacientes con COVID-19 y 16 pacientes con gripe con neumonía seguidos longitudinalmente. Las líneas discontinuas indican el momento de la primera y la última aparición de la enfermedad crítica, respectivamente. b, Niveles séricos de IFN-λ1, IFN-α, IFN-γ, TNF, IL-6, IL-7, IL-8, IL-10 y CCL3 en varios intervalos de tiempo tras el ingreso hospitalario. Los datos se presentan en forma de gráficos de dispersión con puntos que muestran las mediciones individuales de los pacientes, columnas con los valores medianos y barras de error con el rango. Para COVID-19, n = 16, 17, 21, 15, 11 y 8 para cada uno de los seis intervalos de tiempo consecutivos. Para la gripe, n = 16, 14 y 11, respectivamente. Para los sanos, n = 10. El sombreado gris marca el límite de cuantificación del ensayo. Los valores P se determinaron mediante una prueba U de Mann-Whitney de dos colas para comparaciones no paramétricas. *P < 0,05, **P < 0,01 y ***P < 0,001 muestran significación sobre los controles sanos. #P < 0,05, ##P < 0,01 y ###P < 0,001 muestran significación entre los grupos COVID-19 y gripe.
Encontramos que los pacientes con COVID-19 tenían profundamente deteriorada la inducción tanto de IFN-λ como de IFNs tipo I. El IFN-λ y los IFNs de tipo I no eran detectables en la mayoría de los pacientes con COVID-19 (con niveles medios en el límite de cuantificación del ensayo), aunque algunos pacientes producían IFN-λ y un número menor de ellos también producía IFN-α (Fig. 1b). Esta observación contrasta con los pacientes con gripe que expresaron casi uniformemente ambos tipos de IFN, dentro del primer intervalo de tiempo (día 1-3) del ingreso y en concentraciones significativamente mayores. En todos los casos, la expresión de IFN fue transitoria, y los niveles de IFN de tipo I disminuyeron rápidamente después de los primeros 3 días de hospitalización, mientras que el IFN-λ persistió durante más tiempo. Cabe destacar que, a pesar de su limitada capacidad para producir IFN, los pacientes con COVID-19 expresaron de forma robusta citoquinas proinflamatorias como TNF, IL-6, IL-7, IL-8, IL-10, IFN-γ y CCL3 que se mantuvieron en concentraciones elevadas durante un tiempo prolongado (Fig. 1b). Otras citocinas, como la IL-1β, la IL-12, la IL-23 y la CCL4, también fueron significativamente reguladas al alza en intervalos de tiempo específicos en comparación con los individuos sanos, lo que refleja la heterogeneidad del curso de la enfermedad (Extended Data Fig. 2).
Un patrón similar surgió cuando se hicieron comparaciones según el inicio de los síntomas de la enfermedad (Extended Data Fig. 1b). Los pacientes con COVID-19 mostraron niveles de IFN-λ y de IFN tipo I notablemente retrasados y reducidos, que fueron detectables sólo en una fracción de los pacientes y a partir de los días 7-10 del inicio de los síntomas (Extended Data Fig. 3a,b). En comparación, todos los pacientes con gripe mostraron altos niveles de estas citoquinas durante los primeros 6 días (Extended Data Fig. 3a,b). Aunque los pacientes con COVID-19 produjeron poco IFN durante los primeros 6 días de la aparición de los síntomas, produjeron potentemente citoquinas proinflamatorias y quimiocinas como TNF, IL-6, IL-8, IL-10 y CCL3 en concentraciones similares a las de la gripe (Extended Data Fig. 3b,c). Además, mostraron una expresión prolongada de mediadores proinflamatorios, con concentraciones elevadas de TNF, IL-6, IL-7, IL-8, IL-10 y CCL4 que permanecieron detectables durante más de 3 semanas desde el inicio, mientras que en los pacientes con gripe varios de ellos ya estaban regulados a la baja.
Especialmente, los pacientes con COVID-19 ingresaron en el hospital con marcadores de inflamación sistémica similares, como las concentraciones de proteína C-reactiva (PCR), los recuentos de glóbulos blancos (WBC) y neutrófilos y la relación neutrófilos/linfocitos (N/L), a los de los pacientes con gripe (Tabla Suplementaria 1 y Extended Data Fig. 4a-f). Incluso tenían menos fiebre y una puntuación CURB-65 más baja, una medida comúnmente utilizada de la gravedad de la neumonía19 (Extended Data Fig. 4g,h). Sin embargo, durante el seguimiento, los pacientes con COVID-19 desarrollaron una incidencia mucho mayor de SDRA que requirió apoyo de la UCI. En nuestra cohorte, 16 de 32 pacientes (50%) desarrollaron enfermedad crítica, 3 de los cuales murieron, en comparación con sólo 3 de 16 pacientes con gripe (18,7%), ninguno de los cuales murió (Extended Data Fig. 5). Los pacientes con COVID-19 se convirtieron en enfermos críticos durante un periodo de tiempo mucho más amplio (con el primer inicio del paciente en el día 1 y el último en el día 9 después del ingreso hospitalario; Fig. 1a y Extended Data Fig. 5) que los pacientes con gripe, que manifestaron la enfermedad crítica dentro del primer día después del ingreso. Este hallazgo concuerda con la alta incidencia y el curso prolongado de la insuficiencia respiratoria grave descrita para la COVID-19 (refs. 4,12). Curiosamente, entre los pacientes con COVID-19, los que se convirtieron en enfermos críticos tenían mayores concentraciones de PCR, recuentos de glóbulos blancos y neutrófilos y ratio N/L al ingreso (Extended Data Fig. 4a-f), pero no CURB-65 ni fiebre (Extended Data Fig. 4g,h y Tabla Suplementaria 2). Los pacientes críticos con gripe también tenían una tendencia a un mayor recuento de glóbulos blancos y neutrófilos, relación N/L y CURB-65, mientras que los pacientes no hospitalizados con gripe no mostraban ninguno de estos aumentos (Extended Data Fig. 4a-h).
Así pues, examinamos si los patrones temporales de citoquinas difieren entre los distintos grupos de pacientes. En particular, observamos que aunque los pacientes con COVID-19 que no se pusieron críticamente enfermos produjeron poco IFN de tipo I o III, los que se pusieron críticamente enfermos tenían niveles de IFN-λ que eran significativamente más altos en el intervalo de tiempo del día 1-3 en comparación con los pacientes sanos y no críticamente enfermos (Fig. 2a). Algunos de los pacientes críticamente enfermos también produjeron IFN-α (Fig. 2a), aunque en cantidades significativamente menores en comparación con los pacientes no hospitalizados con gripe leve (Fig. 2a) o con el total de pacientes hospitalizados con gripe (tanto críticamente como no críticamente enfermos; P < 0,05). Por el contrario, todos los pacientes con COVID-19 produjeron citoquinas proinflamatorias como TNF, IL-6, IL-8, IL-10 e IFN-γ, y los pacientes en estado crítico mostraron también concentraciones significativamente más altas de IL-6 e IL-7 que los pacientes no críticos en intervalos de tiempo específicos y una tendencia a un mayor IFN-γ, consistente con el mayor estado hiperinflamatorio en el que se encontraban (Fig. 2a y Extended Data Fig. 6). Los datos de los pacientes individuales confirmaron además estas tendencias (Extended Data Fig. 7). CCL3 fue significativamente más alto que los controles sanos en pacientes no críticamente enfermos con COVID-19 pero no en aquellos que estaban críticamente enfermos (Fig. 2a). En comparación, los pacientes críticamente enfermos y no críticamente enfermos con gripe no difirieron en su capacidad de producir IFNs tipo I y tipo III ni citoquinas pro-inflamatorias como TNF, IL-6 o IL-7 (Fig. 2a y Extended Data Fig. 6). Del mismo modo, los pacientes no hospitalizados con gripe con enfermedad leve mostraron una fuerte producción de IFN de tipo I y de tipo III, lo que indica que en todo el espectro de gravedad de la enfermedad de la gripe la respuesta antiviral sigue siendo sólida. También mostraron una producción similar de citoquinas proinflamatorias como TNF, IL-6, IL-7, IL-8 e IFN-γ, pero niveles más altos de CCL3 en comparación con los pacientes hospitalizados con gripe no críticos o críticos. La visualización de estos patrones en un gráfico de radar revela un importante desequilibrio en la inducción de respuestas antivirales y proinflamatorias de los pacientes con COVID-19 que no se produce en la gripe (Fig. 2b).

a, Niveles séricos de IFN-λ1, IFN-α, IFN-γ, TNF, IL-6, IL-7, IL-8, IL-10 y CCL3 para pacientes críticos y no críticos con COVID-19 y gripe y pacientes no hospitalizados con gripe leve en los días 1-3 y 7-10 intervalos de tiempo después de la admisión o visita al hospital, respectivamente, así como individuos sanos. Los puntos muestran las mediciones individuales y las líneas los valores medianos de los pacientes hospitalizados y los individuos sanos. Los cuadrados muestran los pacientes no hospitalizados con gripe. El sombreado gris marca el límite de cuantificación del ensayo. b, Gráficos de radar de la mediana de los niveles de citoquinas y el rango de los pacientes hospitalizados con COVID-19 y gripe que desarrollan una enfermedad crítica frente a los no críticos, los pacientes no hospitalizados con gripe y los individuos sanos en el intervalo de tiempo del día 1 al 3 después del ingreso. Cada círculo en el gráfico de radar representa las concentraciones que aumentan logarítmicamente de 4-256 pg ml-1 como se muestra en los controles sanos. Para los días 1-3, n = 9, 7, 24, 13 y 3 para cada uno de los cinco grupos consecutivos, respectivamente. Para los días 7-10, n = 8, 13, 15, 12 y 2, respectivamente. Para los individuos sanos, n = 10. Los valores P se determinaron mediante una prueba U de Mann-Whitney de dos colas para comparaciones no paramétricas. *P < 0,05, **P < 0,01 y ***P < 0,001 muestran significación sobre los controles sanos. #P < 0,05, ##P < 0,01 y ###P < 0,001 muestran significación entre COVID-19 y los subgrupos de gripe.
A continuación, tratamos de determinar si los patrones desequilibrados de citoquinas en los pacientes con COVID-19 están relacionados con los efectos inmunológicos sistémicos y los parámetros vinculados a la gravedad de la enfermedad. Para ello, obtuvimos los transcriptomas temporales de los glóbulos blancos de cinco individuos sanos y nueve pacientes con COVID-19, cinco no críticos y cuatro críticos, a partir del día 1 de entrada en la sala o la UCI y en diferentes momentos posteriores. En total, se analizaron 24 conjuntos de datos completos de expresión génica de ARN-seq. Los análisis de clustering revelaron que las muestras se agrupan según la gravedad del fenotipo clínico, indicando esto como la principal fuente de variación y proporcionando una forma de predecir qué pacientes progresarán hasta desarrollar una enfermedad crítica o no crítica (Fig. 3a y Extended Data Fig. 8). Centrándonos en el día 1 como punto temporal más relevante, encontramos que 4.225 genes se expresaban de forma diferencial en los pacientes con COVID-19 en comparación con los individuos sanos (Tabla Suplementaria 3). Cuando los pacientes críticos y no críticos se compararon por separado con los controles sanos, se observaron 4.214 y 4.902 genes expresados diferencialmente (DEGs), respectivamente, de los cuales 1.979 eran comunes mientras que el resto se encontraban exclusivamente en uno u otro grupo de pacientes (Fig. 3b y Tablas Suplementarias 3 y 4). De estos DEGs, 2.674 genes también fueron significativamente diferentes entre los pacientes críticos y no críticos (Tabla Suplementaria 5). Los diagramas de volcán señalaron diferencias notables en los genes más regulados entre los grupos, y los pacientes en estado crítico mostraron patrones de genes de respuesta inmune y antiviral más fuertes (Fig. 3c-e). El análisis de las vías de los DEGs reveló que las vías más significativas sobre-representadas en los pacientes críticos estaban relacionadas con la regulación positiva del sistema inmune, la activación de la respuesta inmune innata, la respuesta de defensa al virus y la respuesta celular al IFN (Fig. 3f y Tabla Suplementaria 6). La inducción de la vía de producción de IL-1β y la respuesta a la IL-1 también fueron prominentes. Por el contrario, en los pacientes no críticos estas vías no estaban significativamente reguladas con la excepción de la vía de producción de IL-1β (Fig. 3f). En cambio, otras vías sobrerrepresentadas incluyeron la regulación del tamaño del componente celular y la citotoxicidad de las células asesinas naturales (NK) (Fig. 3f).
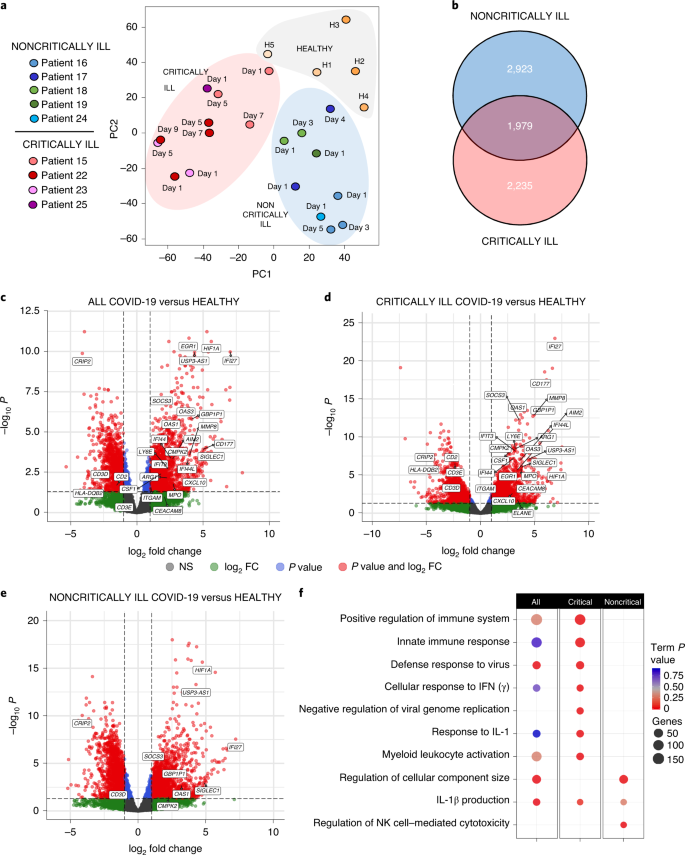
a, Análisis de componentes principales de los transcriptomas de los glóbulos blancos periféricos de pacientes críticos (n = 4) y no críticos (n = 5) o controles sanos (H1-H5) (n = 5). b, Diagrama de Venn que muestra los DEG únicos y comunes de los transcriptomas de los glóbulos blancos periféricos de los pacientes críticos (n = 4) y no críticos (n = 5) en comparación con los individuos sanos (n = 5). c-e, Diagramas de volcán que muestran los DEG más significativamente regulados en todos los pacientes con COVID-19 (c) y sus subgrupos de enfermos críticos (d) y no críticos (e) frente a los individuos sanos en el primer día de hospitalización. El análisis de DEG se realizó con DESeq2 v.1.22.2. FC, cambio de pliegues; NS, no significativo. f, Análisis de enriquecimiento de vías de la ontología génica (GO) de los DEG de todos los pacientes, críticamente enfermos y no críticamente enfermos con COVID-19 en el día 1 de ingreso en el hospital o en la UCI. Se empleó ClueGO y los valores P de los términos se ajustaron utilizando la corrección de Bonferroni para comparaciones múltiples. La visualización se realizó con el paquete R ggplot2. El tamaño de los puntos indica el número de genes expresados diferencialmente por vía, y el color rojo indica la significación estadística.
De acuerdo con esto, los mapas de calor con información temporal revelaron una fuerte inducción de un largo conjunto de genes antivirales en los pacientes críticamente enfermos en comparación con sólo una fracción de ellos que fueron regulados en el grupo no críticamente enfermo (Fig. 4a y Tabla Suplementaria 3). Este conjunto incluye genes clásicos de respuesta antiviral, que pueden ser inducidos por el IFN tipo I y III, como Stat1, Stat3, Irf1, Irf2, Socs3, Isg20, Oasl, Ifi5, Ifit1b, Ifit5, Ifitm10, Gbp1, Gbp2, Gbp4, Gbp5 y Gbp6, todos ellos significativamente regulados al alza en los pacientes críticos en comparación con los no críticos o los individuos sanos, e Irf3, Socs3, Mx1, Oas1, Ifi27, Ifi44 e Ifitm5 también regulados al alza en los pacientes no críticos, aunque en menor medida que en los pacientes críticos (Tabla Suplementaria 5). La comparación del conjunto total de genes antivirales expresados en el día 1, como se muestra en la Fig. 4a, confirmó una diferencia estadísticamente significativa entre los pacientes críticos y no críticos (P = 1,25 × 10-20), de acuerdo con los distintos patrones de producción de IFN-λ e IFN de tipo I en estos pacientes. Esta mayor respuesta de IFN de tipo I/III en los pacientes críticamente enfermos no es probable que se deba a una mayor expresión de los componentes del receptor de IFN, ya que no se observaron diferencias significativas entre los niveles de ARNm de Ifnlr1, Il10rb e Ifnar1 entre los grupos de pacientes y los individuos sanos, excepto un aumento del doble de Ifnar2 en los pacientes críticamente enfermos (Tabla suplementaria 3).
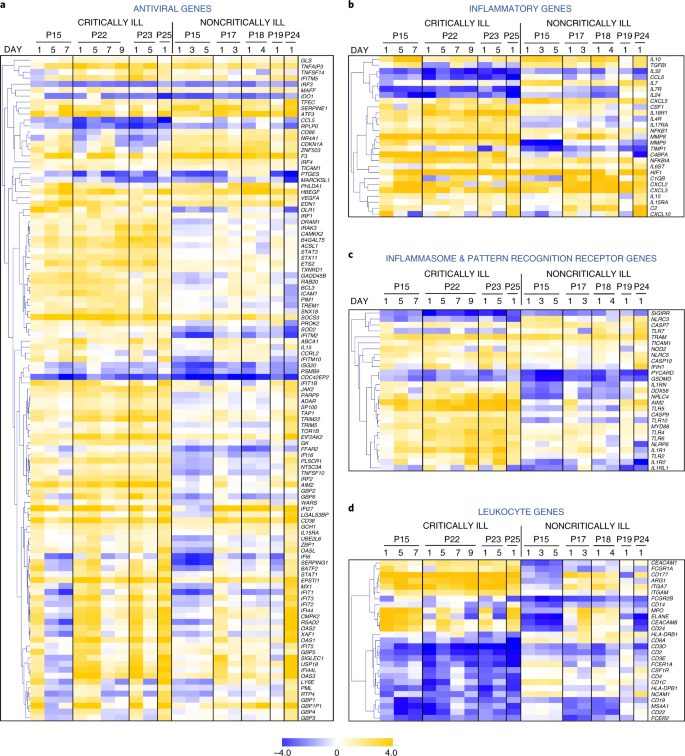
a-d, Mapas de calor que muestran los patrones temporales de los genes antivirales diferencialmente expresados (a), los genes inflamatorios (b), los genes del inflamasoma y PRR (c) y los genes leucocitarios (d) de los pacientes críticos y no críticos con COVID-19 en comparación con los individuos sanos. Los colores azul y amarillo representan los genes regulados a la baja y al alza, respectivamente. Los datos se expresan como valores logarítmicos de los pliegues con respecto a los controles sanos. P, paciente.
Más análisis de mapas de calor señalaron una respuesta inmune innata sistémica más fuerte en pacientes críticamente enfermos marcada por el aumento de la expresión de mediadores proinflamatorios clave, incluyendo componentes del complemento (C2, C4bpa), citoquinas (Csf1, Cxcl10) y metaloproteinasas de matriz (Mmp8, Mmp9) sobre los individuos sanos (Fig. 4b). Por el contrario, los pacientes no críticamente enfermos mostraron una mayor expresión de Il10, una importante proteína antiinflamatoria que amortigua las tormentas, e Il7, que participa en el mantenimiento de la homeostasis de las células T en la periferia. En particular, los genes del inflamasoma, como Nlrp6, Nrlc4, Nod2, Aim2, Casp9, Casp10, Il1rn e Il1r1, todos ellos relacionados con la producción o la respuesta a la IL-1β20, también fueron regulados al alza en los pacientes críticos con COVID-19, mientras que Pycard (Asc), un componente clave del ensamblaje del inflamasoma, fue regulado a la baja en los pacientes no críticos en comparación con los individuos sanos, lo que indica un papel destacado de la vía de la IL-1β en la enfermedad más grave (Fig. 4c). Los receptores de reconocimiento de patrones (PRR) implicados en el reconocimiento microbiano, como Ddx58 (Rigi), Aim2, Ifih1 (Mda5), Ifi16, Tlr2 y Tlr4, también fueron regulados al alza. En general, cuando se comparan como un conjunto, los genes del inflamasoma y PRR mostrados en la Fig. 4c fueron significativamente diferentes entre los dos grupos (P = 9,72 × 10-7). A nivel del tipo de célula, el análisis de la expresión génica reveló una firma dominante de células neutrófilas/mieloides activadas (Mpo, Elane, Cd177, Itgam, Arg1, Ceacam8 y Fcgr1a) en el grupo de enfermos críticos que fue más leve y no significativa en los pacientes no críticos (Fig. 4d). Por el contrario, los linfocitos T, B y NK y los genes relacionados con ellos (Cd3d, Cd3e, Cd4, Cd8a, Cd19, Cd22 y Ncam1) se redujeron notablemente en los pacientes críticos. Estos datos son consistentes con la linfopenia, los altos recuentos de neutrófilos y una alta relación N/L también presentes en estos pacientes (Datos Extendidos Fig. 4) y previamente reportados como asociados con una enfermedad más severa y peores resultados en pacientes con COVID-19 (refs. 3,4). Citoquinas como el TNF, la IL-6 y la IL-8 pueden explicar directamente estos efectos, ya que se sabe que desencadenan la movilización y la activación de neutrófilos, el desarrollo de linfopenia y la inducción de respuestas inmunitarias innatas y de inflamación sistémica21,22. Por lo tanto, los transcriptomas de los glóbulos blancos de los pacientes con COVID-19, al principio de la hospitalización, pueden proporcionar información vital sobre la gravedad de la enfermedad y guiar el tratamiento, como la administración de inhibidores de la IL-1, de una manera más personalizada.
Es interesante que los patrones de citoquinas desequilibrados en los pacientes con COVID-19 con neumonía se asociaran con un resultado de la enfermedad mucho peor en comparación con la gripe. En primer lugar, el grupo con COVID-19 mostró una mayor incidencia de enfermedad crítica y mortalidad (Extended Data Fig. 5). En segundo lugar, los pacientes con COVID-19 en general, así como cuando se agrupan como enfermos críticos y no críticos, requirieron un mayor tiempo de hospitalización que sus homólogos con gripe (Fig. 5a-c). Para los pacientes críticos y no críticos con COVID-19, la mediana de tiempo fue de 14 y 23 días, respectivamente, en comparación con la gripe de 7 y 19 días (Fig. 5b,c). La prolongación de la hospitalización podría atribuirse a las respuestas antivirales no afinadas, lo que lleva a un curso clínico más prolongado de la COVID-19 en relación con la gripe y a la necesidad de una recuperación más larga incluso para el grupo de enfermos no críticos.
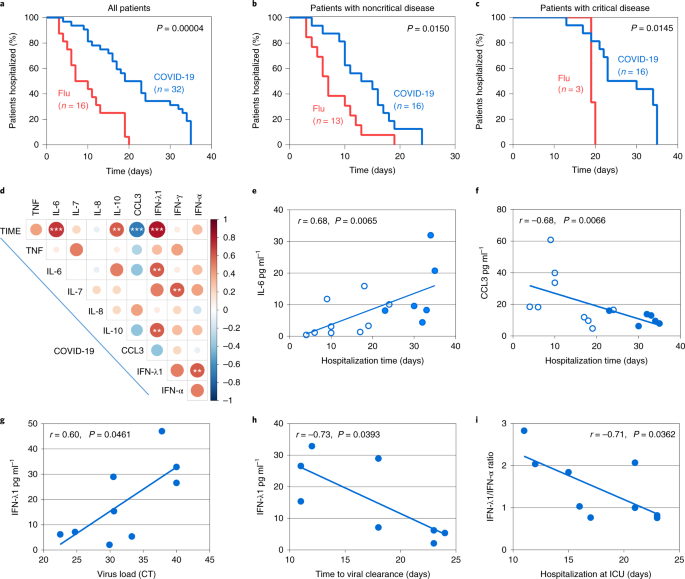
a-c, Comparación del tiempo de hospitalización entre los pacientes con COVID-19 y gripe. Se muestran todos los pacientes (a), los pacientes con enfermedad no crítica (b) y los pacientes con enfermedad crítica (c). d, Matriz de correlación de los niveles de concentración de citoquinas en suero en el intervalo de tiempo del día 1 al 3 después del ingreso hospitalario de los pacientes con COVID-19, indicando las correlaciones entre las citoquinas y el tiempo total de hospitalización (TIME) u otras citoquinas. e,f, Correlación de los niveles de IL-6 (e) y CCL3 (f) en suero con la duración de la hospitalización total de todos los pacientes con COVID-19. g, Correlación de los niveles de IFN-λ1 con la carga viral expresada como valores de tomografía computarizada en aspirados bronquiales recogidos en el mismo intervalo de tiempo que los sueros utilizados para la cuantificación de IFN-λ1. h, Correlación de los niveles de IFN-λ1 con el tiempo necesario para la eliminación del virus evaluado como la primera prueba negativa de SARS-CoV-2. i, Correlación de la relación IFN-λ1:IFN-α con la duración de la hospitalización en la UCI. Los puntos muestran las mediciones individuales de los pacientes con COVID-19. Los puntos abiertos y sombreados corresponden a pacientes con COVID-19 no críticos y críticos, respectivamente (e-i). Para a-c, los valores P para la comparación de las curvas de hospitalización entre los grupos de pacientes se determinaron mediante la prueba de rangos logarítmicos. Para d-i, los valores de P para la fuerza y la dirección de la asociación entre las dos variables, como se indica en cada panel, se determinaron utilizando el coeficiente de correlación de rango de Spearman para datos no paramétricos. **P < 0,01 y ***P < 0,001.
Para identificar las citocinas y las combinaciones de citocinas que pueden predecir el tiempo de hospitalización y, por lo tanto, tener valor pronóstico para la estratificación del riesgo independientemente de los parámetros conocidos de laboratorio y de gravedad clínica (como la saturación de O2, la frecuencia respiratoria o la relación N/L), generamos una matriz de correlación de los niveles de citoquinas al ingreso (intervalo del día 1-3) y la duración de la estancia hospitalaria (Fig. 4d). Encontramos que las concentraciones más altas de IL-6 e IL-10, y más bajas de CCL3, eran directamente proporcionales a la duración de la hospitalización (Fig. 5d-f). El valor de la IL-6 y la IL-10 como biomarcadores para la monitorización de la gravedad de la COVID-19 ha sido reportado4,23,24 pero para el CCL3 esto es nuevo. Notablemente, la concentración de IFN-λ también se correlacionó con una mayor IL-6 e IL-10 y un mayor tiempo de hospitalización, lo que es consistente con su inducción casi exclusiva en los pacientes críticamente enfermos pero no en los no críticos (Fig. 5d).
Una cuestión que surge es si los niveles de IFN inducidos en los pacientes críticamente enfermos son beneficiosos, ya que se ha demostrado en modelos animales que la producción retardada de IFN tipo I o tipo III causa inmunopatología13,14,25 o interfiere con la reparación epitelial26,27, respectivamente. Encontramos que las concentraciones más altas de IFN-λ durante el ingreso en la UCI se asociaron con una menor carga viral de SARS-CoV-2 en el tracto respiratorio y una eliminación viral más rápida (Fig. 5g,h). Además, una mayor proporción de IFN-λ con respecto al IFN tipo I en ese momento se relacionó con una estancia más corta en la UCI (Fig. 5i), y los dos pacientes con los niveles más altos de IFN-α también mostraron la estancia más larga (ambos 23 d sobre una mediana de 17 d). Estos datos sugieren que la inducción retardada de IFN-λ puede seguir siendo protectora en pacientes críticos con COVID-19, mientras que el IFN-α puede ser más perjudicial que beneficioso, al menos en un subconjunto de pacientes.
En conjunto, nuestros hallazgos demuestran que la infección por SARS-CoV-2 no sigue el paradigma convencional de la inmunidad antiviral. En lugar de activar primero la respuesta antiviral seguida del proceso proinflamatorio como segunda línea de protección, hace lo contrario; desencadena la respuesta proinflamatoria mucho antes de que se induzcan las defensas antivirales mediadas por el IFN, si es que lo hace. Este escenario es una gran paradoja y ayuda a explicar muchas de las características únicas o inusuales de COVID-19. El largo tiempo de incubación del virus y su persistencia en el tracto respiratorio, dando positivo en las pruebas de SARS-CoV-2 durante semanas, puede atribuirse a la producción retardada y/o reducida de IFN de tipo I y III. La ausencia o los síntomas muy leves de los pacientes durante un periodo de tiempo inusualmente prolongado, pueden atribuirse a la falta o a la expresión alterada y retrasada de los IFN de tipo I, principales mediadores de la enfermedad similar a la gripe y de síntomas como la secreción nasal, la tos, la fatiga, la disnea y la fiebre en los seres humanos28. Por último, la expresión temprana y persistente de citoquinas proinflamatorias que culmina en una hiperinflamación prolongada puede promover el desarrollo repentino de una insuficiencia respiratoria que requiere hospitalización y, con frecuencia, ingreso en la UCI. Cabe destacar que, en la gripe, la rápida inducción de la respuesta de IFN tipo I y III, en todo el espectro de gravedad de la enfermedad, se correlaciona con una recuperación más rápida y una incidencia notablemente menor de enfermedad crítica o mortalidad13,25. La reciente demostración, en un estudio de cohorte retrospectivo de 446 pacientes con COVID-19, de que la administración temprana de IFN-α (IFN-a2b) está relacionada con una reducción de la mortalidad hospitalaria, mientras que el tratamiento tardío con IFN-α conduce a un aumento de la mortalidad y a un retraso en la recuperación, deja pocas dudas de que el momento de la producción de IFN también es crucial en los pacientes con COVID-19 (ref. 29). Es concebible que la producción tardía de IFN de tipo I o III no confiera resistencia viral, sino que promueva la inmunopatología.
Si este curso clínico único de la COVID-19 está relacionado con la presencia de inhibidores de IFN derivados del SARS-CoV-2, como se ha propuesto previamente para el SARS-CoV30,31 y el MERS-CoV32, se desconoce pero es una posibilidad. Al igual que con otros virus, la inhibición puede superarse una vez que se alcanzan cargas virales más altas, por ejemplo tras la incubación del virus y la eventual propagación en individuos susceptibles. En nuestro estudio, no observamos diferencias significativas en los niveles de virus entre los pacientes no críticos y los críticos en el momento en que se midieron los IFN (Extended Data Fig. 9). Sin embargo, en un estudio se ha descrito una mayor carga viral en la enfermedad grave respecto a la leve, pero no se ha confirmado en otro33,34. Además, una mayor carga vírica puede superar la supresión dependiente de la dosis de SARS-CoV-2 de la producción de IFN en células epiteliales respiratorias cultivadas16.
Nuestro estudio no está exento de advertencias. En primer lugar, caracteriza los patrones de citoquinas en la circulación y, aunque estos se utilizan habitualmente para analizar las «tormentas de citoquinas» en respuesta a la infección, es difícil saber hasta qué punto se correlacionan con las respuestas inmunitarias en el tracto respiratorio. En segundo lugar, nuestro estudio es relativamente pequeño y nuestros resultados están pendientes de validación en otras cohortes. Aun así, nuestro estudio es excepcionalmente informativo, ya que aborda la producción de IFN y la activación de la «tormenta de citoquinas» en el COVID-19 de forma temporal, desde el ingreso en el hospital hasta la entrada en la UCI, y por lo tanto debería ser especialmente útil para el diseño de ensayos clínicos que prueben terapias con IFN. También describe biomarcadores como IL-6 y CCL3 y firmas de expresión génica que pueden ser particularmente útiles para evaluar el riesgo de desarrollo de enfermedad crítica y la duración de la hospitalización de los pacientes con COVID-19 que acaban de ingresar en el hospital. Por último, proporciona una comparación paralela de la COVID-19 con la gripe, estudiando poblaciones de pacientes con características genéticas, demográficas y clinicopatológicas similares, y por lo tanto descubre importantes diferencias en la respuesta inmune antiviral entre estas dos enfermedades que no se habían sospechado previamente.
0 comentarios