Estrógenos y disfunción eréctil en la investigación básica
Interesantemente, la administración de estrógenos disminuye la función eréctil en modelos animales . Los investigadores administraron estradiol por vía oral a ratas, lo que dio lugar a niveles elevados de estradiol y a niveles bajos de testosterona. Además, la respuesta de la presión intracavernosa (PIC) a la estimulación nerviosa también se vio alterada en todos los grupos tratados, y la tinción de tricrómico demostró la presencia de hiperplasia del tejido conectivo cavernoso en los grupos de estudio a largo plazo . La administración oral de estradiol a los conejos dio lugar a niveles elevados de estradiol y a niveles bajos de testosterona, similares a los efectos en las ratas. Además, la acetilcolina indujo una relajación mediada por el endotelio en animales normales, pero este efecto se atenuó significativamente en los grupos tratados, y la neurotransmisión no adrenérgica y no colinérgica mediada por el NO disminuyó en los grupos de tratamiento.
En nuestros estudios anteriores, la administración subcutánea (s.c.) de estradiol a ratas dio lugar a niveles elevados de estradiol y a niveles bajos de testosterona, disminuyendo así la función eréctil . Además, administramos testosterona a ratas con una elevada deficiencia de testosterona inducida por estrógenos; sin embargo, la función eréctil no mejoró. Curiosamente, la administración de estrógenos aumenta la contracción del músculo liso del cuerpo cavernoso, regulando la vía de señalización RhoA/Rho-cinasa, que está implicada en la disfunción eréctil. Vignozzi et al. demostraron que la disfunción eréctil inducida por una dieta alta en grasas está asociada a niveles altos de estradiol, más que a niveles bajos de testosterona.
También investigamos la influencia del desequilibrio estradiol-testosterona en la función eréctil en ratas (Figuras 1-6; Tabla 1). Las ratas macho Wistar ST (11 semanas de edad, Japan SLC Inc., Hamamatsu, Japón) fueron separadas en cinco grupos. En el grupo de baja testosterona (Low-T) (n = 11), se inyectó a las ratas goserelina (agonista de la LH-RH, 0,9 mg/kg, s.c.). En el grupo de testosterona baja y estrógeno alto (Low-T/High-E) (n = 11), se inyectó a las ratas goserelina y estradiol (3 μg/kg/día, s.c.) diariamente de las semanas 2 a 4. En el grupo de estrógeno alto (High-E) (n = 11), se inyectó a las ratas estradiol diariamente de las semanas 2 a 4. En el grupo de estrógeno y testosterona elevados (n = 11), se inyectó a las ratas estradiol y testosterona (3 mg/kg/día, s.c.) diariamente de las semanas 2 a 4. En el grupo de control (n = 11), no se inyectó a las ratas ninguna hormona. La tabla 1 muestra las concentraciones de hormonas sexuales en las ratas. La inyección de goserelina disminuyó significativamente la testosterona biodisponible en suero (control: 1,20 ± 0,13 ng/mL, baja-T: 0,55 ± 0,04 ng/mL, P < 0,01 frente al control; baja-T/alta-E: 0,73 ± 0,06 ng/mL, P < 0,05 frente al control). La inyección de testosterona aumentó significativamente la testosterona biodisponible en suero (control: 1,20 ± 0,13 ng/mL, High-E/High-T: 2,58 ± 0,31 ng/mL, P < 0,001 frente al control). La inyección de estradiol aumentó significativamente el estrógeno sérico (control: 102,5 ± 8,7 pg./mL, Low-T/High-E: 275,4 ± 34,4 pg./mL, P < 0.01 frente al control; Alta-E: 332,3 ± 17,4 pg./mL, P < 0,001 frente al control; Alta-E/Alta-T: 401,5 ± 51,6 pg./mL, P < 0,001 frente al control).
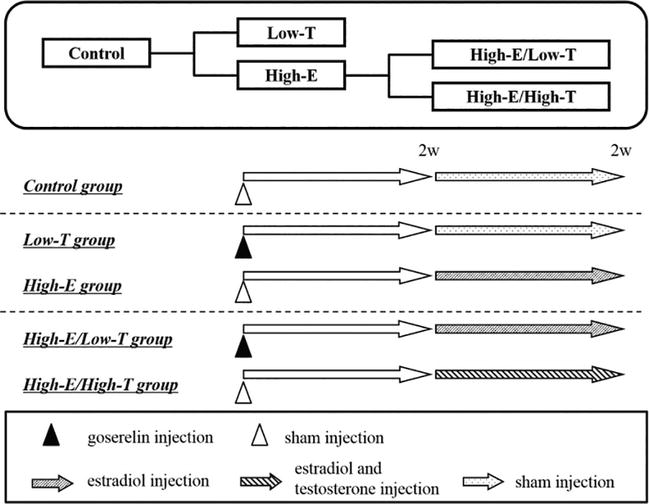
Figura 1.
xns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceDiseño experimental. En el grupo de control, las ratas fueron inyectadas con vehículo durante 2 semanas. En los grupos Low-T y High-E, se inyectó a las ratas acetato de goserelina (agonista de la LH-RH, 0,9 mg/kg por vía subcutánea) el día 0. En el grupo tratado con estrógenos (High-E), se inyectó a las ratas estradiol (3 mg/kg/día por vía subcutánea) durante 2 semanas. En el grupo tratado con estrógenos y testosterona (High-E/High-T), se inyectó a las ratas estradiol (3 mg/kg/día por vía subcutánea) y testosterona (3 mg/kg/día por vía subcutánea) durante 2 semanas. Al final del periodo, las ratas fueron sometidas a pruebas de función eréctil in vivo o in vitro.

Figura 2.
xns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceMedición de la presión intracavernosa (PIC). Cambios máximos de la PIC durante la estimulación eléctrica del nervio cavernoso en los grupos de control, Low-T, High-E, High-E/Low-T y High-E/High-T. Los datos representan las medias ± errores estándar de las medias (n = 6 por grupo). **P < 0,01 frente al grupo de control mediante análisis de la varianza y pruebas t múltiples de tipo Bonferroni.
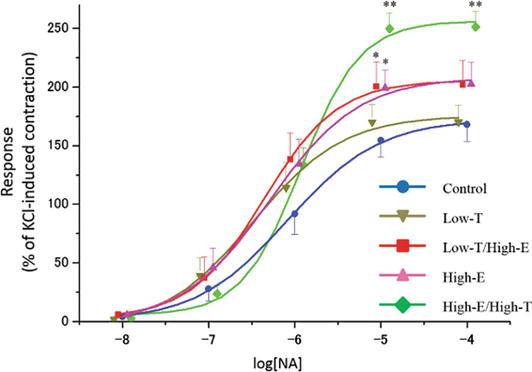
Figura 3.
xns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceLas curvas de contracción inducidas por la noradrenalina (NA) en tiras del cuerpo cavernoso de rata. El tono contráctil inducido por 80 mM de KCl se tomó como el 100%. Los datos reportados en todos los gráficos representan las medias ± errores estándar de las medias (n = 5 por grupo). *P < 0,05, **P < 0,01 frente al grupo de control mediante análisis de la varianza y pruebas t múltiples de tipo Bonferroni. Los valores de Emax se indican en el texto.
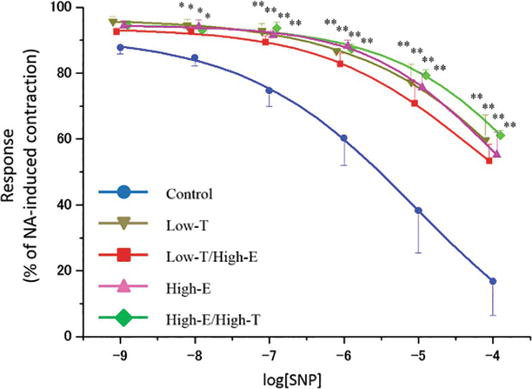
Figura 4.
xns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceLa curva de relajación inducida por nitroprusiato de sodio (SNP) en las tiras del cuerpo cavernoso de rata. Las tiras se precontrajeron utilizando 10-5 M NA. Los datos reportados en todos los gráficos representan las medias ± errores estándar de las medias (n = 5 por grupo). *P < 0,05, **P < 0,01 frente al grupo de control mediante análisis de la varianza y pruebas t múltiples de tipo Bonferroni. Los valores de Emax se indican en el texto.

Figura 5.
xns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceLas curvas de relajación inducidas por el inhibidor de la Rho-cinasa Y-27632 en las tiras del cuerpo cavernoso de rata. Las tiras se precontrajeron utilizando 10-5 M NA. Los datos reportados en todos los gráficos representan las medias ± errores estándar de las medias (n = 5 por grupo). *P < 0,05, **P < 0,01 frente al grupo de control mediante análisis de la varianza y pruebas t múltiples de tipo Bonferroni. Los valores de IC50 se indican en el texto.
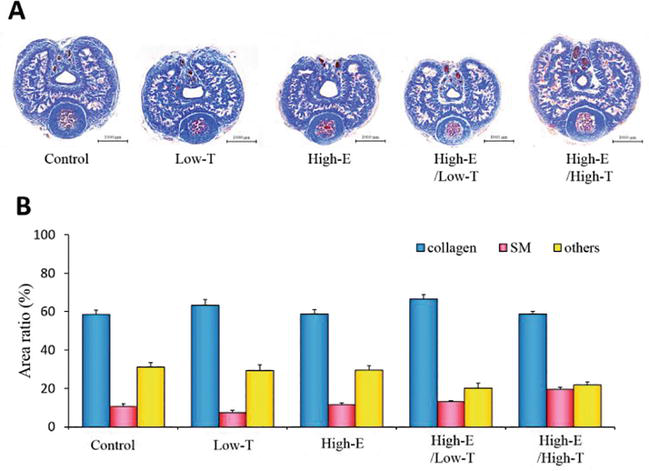
Figura 6.
xns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceSecciones de pene de rata de la tinción de tricrómico de Masson. (A) Especímenes representativos del cuerpo cavernoso de cada grupo de ratas. (B) Evaluación histológica de los tejidos. Las proporciones de área de las fibras de colágeno, del músculo liso (MS) y de otros se calcularon mediante un análisis de imagen computarizado. Los datos reportados en todos los gráficos representan las medias ± errores estándar de las medias (n = 3 por grupo).
| Bio-T (ng/mL) | Estrógeno (pg/mL) | |
|---|---|---|
| Control | 1.20 ± 0,13 | 102,5 ± 8,7 | Baja T | 0,55 ± 0,04** | 51,2 ± 4.2 |
| E Alta | 0,90 ± 0,12 | 332,3 ± 17,4** |
| E Alta/Baja-T | 0.73 ± 0,06* | 275,4 ± 34,4** | Alta-E/Alta-T | 2,58 ± 0,31** | 401,5 ± 51.6** |
Niveles séricos de estrógenos y testosterona biodisponible (bio-T) en ratas.
Los datos se expresan como medias ± errores estándar de las medias. *P < 0,05, **P < 0,01 frente al grupo de control mediante análisis de la varianza y pruebas t múltiples de tipo Bonferroni (n = 6 por grupo).
La figura 2 muestra la respuesta eréctil a la estimulación del campo eléctrico del nervio cavernoso en los diferentes grupos experimentales. El análisis de la relación ICP/MAP reveló que las relaciones en los grupos Low-T (0,52 ± 0,03), Low-T/High-E (0,46 ± 0,03), High-E (0,44 ± 0,03) y High-E/High-T (0,44 ± 0,02), que representaban a todas las ratas tratadas, eran significativamente menores que en el grupo de control (0,70 ± 0,04, P < 0,01). Estos datos sugieren que las respuestas eréctiles estaban disminuidas en las ratas con un desequilibrio de las hormonas sexuales.
La figura 3 muestra la respuesta contráctil de las tiras de cuerpos cavernosos de rata a concentraciones crecientes de noradrenalina (NA). Se comprobó que las concentraciones crecientes de NA contraían las tiras de cuerpos cavernosos de rata en todos los grupos. En particular, 10 μM de NA dio lugar a diferencias estadísticamente significativas en la respuesta contráctil del pene in vitro entre los grupos experimentales (control: 154,5 ± 14,1%, Low-T: 169,8 ± 14,8%, Low-T/High-E: 200,2 ± 21,1%, High-E: 198,9 ± 15,3%, High-E/High-T: 249,7 ± 13,5%). Aunque la respuesta contráctil no difirió entre el grupo de control y el grupo de Baja-T (P > 0,05), las respuestas contráctiles en los grupos de Baja-T/Alta-E, Alta-E y Alta-E/Alta-T fueron mayores que la respuesta en el grupo de control (P < 0.05).
Las figuras 4 y 5 muestran la respuesta relajante de las tiras de cuerpos cavernosos de rata precontraídas por NA a concentraciones crecientes de nitroprusiato de sodio (SNP) e Y-27632. En todos los grupos, las concentraciones crecientes del donante de NO SNP relajaron las tiras de cuerpos cavernosos de rata (control: Emax = 16,8 ± 10,3%, Low-T: Emax = 59,7 ± 7,6%, Low-T/High-E: Emax = 53,4 ± 5,0%, High-E: Emax = 55,2 ± 6,8%, High-E/High-T: Emax = 61,1 ± 1,5%). En los grupos tratados, las sensibilidades al SNP fueron significativamente menores que en el grupo de control (P < 0,01). Las concentraciones crecientes del inhibidor de la Rho-cinasa Y-27632 relajaron completamente las tiras de cuerpos cavernosos de rata en todos los grupos (control: concentración inhibitoria semimáxima = 1,22 × 10-6 M, Low-T: IC50 = 2,43 × 10-7 M, Low-T/High-E: IC50 = 1,31 × 10-7 M, High-E: IC50 = 2,26 × 10-7 M, High-E/High-T: IC50 = 1,25 × 10-7 M). Cuando se utilizaron 10-6 M y 10-5 M de Y-27632, las sensibilidades a Y-27632 en los grupos tratados fueron significativamente menores que en el grupo de control (P < 0,01); por lo tanto, los gráficos de los grupos tratados se desplazaron hacia la izquierda.
La Figura 6 muestra el análisis histológico de los cuerpos cavernosos de las ratas. Se analizó la proporción de área del músculo liso cavernoso (control: 10,5 ± 1,4%, Low-T: 7,4 ± 1,1%, Low-T/High-E: 13,2 ± 0,4%, High-E: 11,6 ± 0,1%, High-E/High-T: 19,4 ± 1,1%). Del mismo modo, se analizó la relación de área de la fibra de colágeno (control: 58,4 ± 2,5%, Low-T: 63,2 ± 3,0%, Low-T/High-E: 66,5 ± 2,3%, High-E: 58,8 ± 2,2%, High-E/High-T: 58,7 ± 1,4%). No se observaron diferencias estadísticamente significativas entre los grupos experimentales en los ratios de área global del músculo liso, la fibra de colágeno y otros parámetros según las pruebas χ2 de independencia (P > 0,05). En general, demostramos que los cambios en el entorno de las hormonas sexuales afectaban a la función eréctil en las ratas, y nuestra hipótesis de que el desequilibrio de las hormonas sexuales asociado a la disfunción eréctil fue apoyada por experimentos in vivo e in vitro utilizando herramientas farmacológicas.
0 comentarios