Definición
Lancet. 2012 Abr 7;379(9823):1341-51.
Am J Respir Crit Care Med. 2007 Sep 15;176(6):532-55.
La EPOC se caracteriza por una limitación persistente del flujo aéreo que suele ser progresiva y se asocia a una respuesta inflamatoria crónica aumentada en las vías respiratorias y el pulmón a partículas o gases nocivos.
Asma vs EPOC
Asma = estrechamiento totalmente reversible de las vías respiratorias
EPOC = estrechamiento de las vías respiratorias no totalmente reversible
La EPOC puede dividirse en 2 fenotipos clínicos: enfisema y bronquitis crónica.
- El enfisema se define patológicamente como el agrandamiento de los espacios aéreos distales.
- La bronquitis crónica se define clínicamente como la tos con producción de esputo que se produce la mayoría de los días en 3 meses consecutivos durante 2 años consecutivos.
- Lancet. 2012 Abr 7;379(9823):1341-51.
- Am J Respir Crit Care Med. 2007 Sep 15;176(6):532-55.
- Lancet. 2009 Aug 29;374(9691):733-43.
- Am J Respir Crit Care Med. 2013 Feb 15;187(4):347-65.
- Lancet. 2012 Abr 7;379(9823):1341-51.
- N Engl J Med. 2012 Jul 26;367(4):340-7.
Etiología
Muchos factores contribuyen al desarrollo de la EPOC, incluidos los factores genéticos como la deficiencia de alfa1-antitripsina, las exposiciones laborales a polvos y productos químicos, la contaminación, las infecciones respiratorias en la infancia y el humo del cigarrillo.
| Etiología | Mecanismo(s) |
| Humo de cigarrillos humo | La presencia de partículas de humo en los pulmones provoca una respuesta inflamatoria con un aumento de la infiltración de macrófagos y neutrófilos en los pulmones. Estas células inmunitarias liberan citocinas, quimiocinas y elastasas, lo que daña el parénquima pulmonar con el tiempo. |
| Las exposiciones laborales al polvo y a los productos químicos | La etiología no está clara, sin embargo, se hipotetiza que es una respuesta inflamatoria similar que daña los alvéolos. |
| Deficiencia de alfa-1 antitripsina | La alfa-1 antitripsina es un inhibidor de la serina proteasa (SERPIN) secretado por el hígado en la sangre que inhibe la enzima elastasa de los neutrófilos para que no dañe el tejido pulmonar. La deficiencia de esta alfa-1 antitripsina conduce a una elasteolisis sin oposición (destrucción de las fibras de elastina en las paredes alveolares) y al desarrollo de un enfisema temprano. Esta es la hipótesis de la proteasa-antiproteasa del desarrollo del enfisema. |
| Consumo crónico de drogas por vía intravenosa | Los consumidores de cocaína, metadona y heroína por vía intravenosa tienen un mayor riesgo de desarrollar EPOC; esto se atribuye al daño vascular inducido por el relleno insoluble (almidón de maíz, celulosa, talco, fibra, etc.) que se encuentra en las drogas intravenosas. |
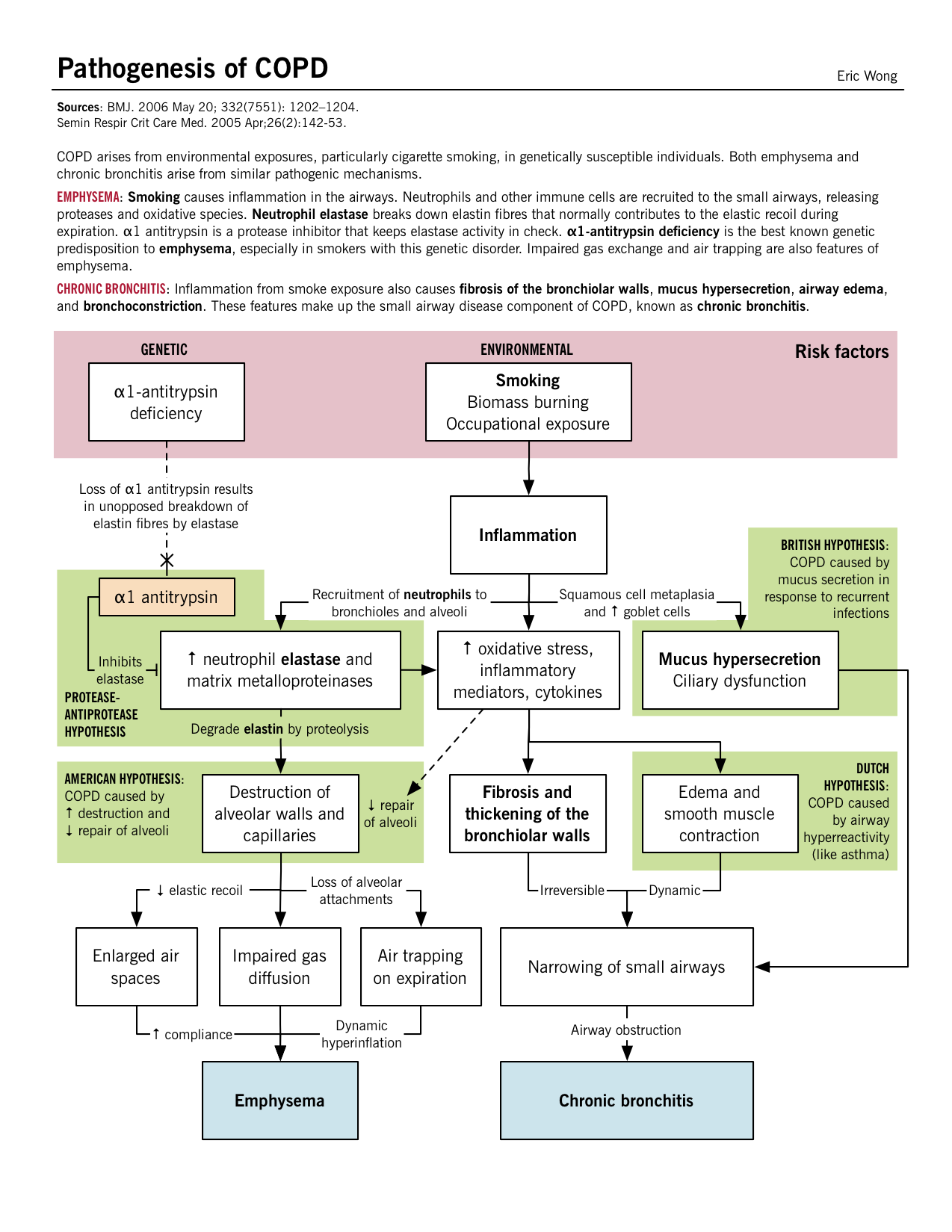
Patogenia, fisiopatología y características clínicas
BMJ. 2006 May 20; 332(7551): 1202-1204.
Aunque un desglose de la EPOC en enfisema y bronquitis crónica es útil, típicamente los pacientes tienen características y hallazgos de cada uno y no pueden ser simplemente clasificados.
| Enfisema | Bronquitis crónica |
Patogenia Am J Respir Cell Mol Biol. 2005 May;32(5):367-72. |
La respuesta inflamatoria, mediada por neutrófilos, macrófagos y células T CD8+, libera mediadores inflamatorios y enzimas que dañan el parénquima pulmonar. Las proteasas como la elastasa y las metaloproteinasas de matriz (MMP) liberadas por estas células inflamatorias rompen el tejido conectivo de las paredes alveolares y los septos. La pérdida de retroceso elástico conduce a una disminución de las tasas de flujo espiratorio, al atrapamiento del aire y al colapso de las vías respiratorias. | El agrandamiento de las glándulas mucosas, la hiperplasia de las células caliciformes y la disfunción mucociliar se producen en las vías respiratorias más grandes, lo que provoca una producción excesiva de moco y una acumulación que reduce la luz de las vías respiratorias.Aunque estos cambios patológicos en las vías respiratorias grandes, parece que el principal lugar de aumento de la resistencia de las vías respiratorias son las vías respiratorias pequeñas (≤ 2 mm). Puede producirse fibrosis e hipertrofia del músculo liso junto con un exceso de producción de moco e infiltración celular en las vías respiratorias periféricas. |
|
Patofisiología BMJ. 2006 May 20; 332(7551): 1202-1204. |
Destrucción del parénquima: El daño recurrente a los alvéolos acaba provocando la destrucción septal junto con el lecho capilar también. Defecto V/Q emparejado: Dado que tanto los bronquiolos terminales como los alvéolos junto con el lecho capilar han sido destruidos, existe un defecto emparejado entre la ventilación y la perfusión; las áreas de baja ventilación también tienen una mala perfusión. Hipoxia leve: A pesar del defecto V/Q «emparejado», se desarrolla una hiperventilación a lo largo del tiempo y el gasto cardíaco (CO) disminuye, lo que conduce a áreas de flujo sanguíneo pobre en áreas relativamente bien oxigenadas. Debido a este CO deficiente, el resto del cuerpo sufre hipoxia tisular. Cachexia: A nivel pulmonar, el bajo CO conduce a la caquexia pulmonar; que induce la pérdida de peso y el desgaste muscular. Esto da a estos pacientes el característico aspecto de «henchido rosa». |
Inflamación de las vías respiratorias pequeñas: Los mecanismos comentados anteriormente conducen a la inflamación de los bronquiolos más pequeños y las secreciones de moco estrechan aún más la luz de las vías respiratorias. A pesar de ello, el parénquima está relativamente menos dañado. Desajuste V/Q: La respuesta fisiológica conduce a una caída de la ventilación y a una compensación con el aumento del CO. Se produce un aumento de la perfusión en las zonas de mala ventilación que acaba provocando hipoxia y policitemia secundaria. Hipoxia grave e hipercarbia: El desajuste V/Q crónico conduce a una disminución de la oxigenación/desoxigenación de la sangre que provoca hipoxemia y un aumento de la retención de CO2 (se produce acidosis respiratoria). Hipertensión pulmonar y cor pulmonale: La hipercapnia crónica y la acidosis respiratoria provocan una vasoconstricción arterial en los pulmones. Con la acumulación de presión retrógrada, las presiones del ventrículo derecho siguen aumentando y acaban provocando un fallo del VD. De lo contrario, se conoce como cor pulmonale. |
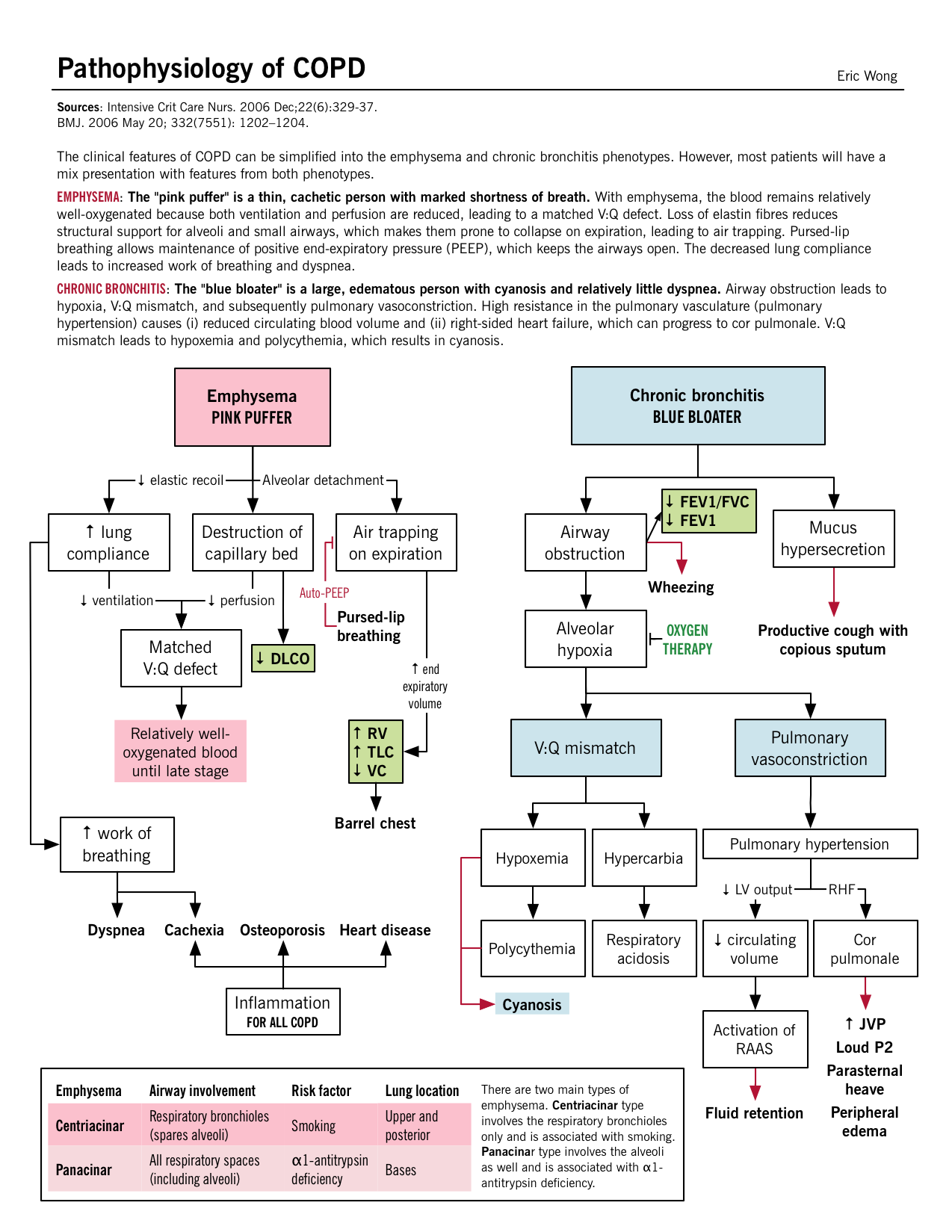
| Signos/síntomas clínicos |
«Soplador rosa» – tipo A Disnea/taquipnia constante y grave («soplido»): Probablemente relacionado con el aumento del volumen espiratorio final (disminución del retroceso), lo que hace que cada respiración sea menos eficiente. Los pacientes utilizan músculos accesorios (posición de trípode) y respiran más rápido (hiperventilación) para compensar la sensación de ventilación inadecuada. La disnea también está relacionada con la fatiga de los músculos respiratorios por el aumento de su uso, así como con el aplanamiento del diafragma que perjudica su función. Tos leve: la irritación de la vía aérea menor puede dar lugar a la producción de tos. No cianótica («rosa»): Defecto V:Q emparejado; sin hipoxemia. Delgado/caquéxico: Pérdida de músculo esquelético y grasa subcutánea debido a una ingesta oral inadecuada, así como a niveles elevados de citoquinas inflamatorias (TNF-α) que provocan dicho desgaste. Disminución de los ruidos respiratorios en la auscultación: La hiperinflación de los alvéolos y la destrucción de la arquitectura alveolar provocan una disminución de la resistencia de las vías respiratorias. |
«Hinchazón azul» – tipo B Producción de esputo copioso: Gran cantidad de esputo producido por las células caliciformes. Ver Patogénesis más arriba. Tos: Irritación de los receptores de la tos, por la mucosa, en las vías respiratorias menores y mayores. Cianótica («azul»): El defecto V/Q desajustado conduce a una oxigenación inadecuada de la sangre; más prominente en los labios y el lecho ungueal. Sobrecarga de volumen («hinchazón»): Lo más probable es que se deba a la insuficiencia del ventrículo derecho (VD), conocida como cor pulmonale. Aspiración en la auscultación: Debido a la obstrucción de las vías respiratorias. En comparación con el asma, hay menos broncoespasmo y más mucosidad/hipertrofia en la EPOC. El ronquido es un sonido de gorgoteo que puede oírse debido a la hipersecreción de moco en las vías respiratorias. |
Agitaciones
N Engl J Med. 2012 Jul 26;367(4):340-7.
Varios estudios han demostrado cierta relación entre la colonización bacteriana de las vías respiratorias superiores e inferiores de los pacientes y las exacerbaciones agudas de la EPOC. Además, las exacerbaciones parecen coincidir con el aumento de las infecciones virales respiratorias agudas (gripe, parovirus, etc.). Los patógenos introducen nuevos antígenos en las vías respiratorias y el parénquima, lo que induce la secreción de quimiocinas (TNF-α e IL-6, IL-8, etc.) y leucotrienos, tanto por parte de los macrófagos de las vías respiratorias como del epitelio, que reclutan neutrófilos. Estos neutrófilos, junto con otras células inmunitarias secretan proteasas y otros medios que inflaman aún más las vías respiratorias y destruyen el epitelio bronquial, lo que conduce a una exacerbación clínica.
Tratamiento
Dejar de fumar
Dejar de fumar retrasa significativamente la progresión del deterioro de la función pulmonar y reduce la mortalidad en un 18%. Es la intervención más eficaz e importante en la EPOC.
Broncodilatadores
Los agonistas β2 inhalados (por ejemplo, salbutamol de acción corta o salmeterol de acción prolongada) actúan sobre los receptores β2 de las células del músculo liso para provocar la broncodilatación. Los anticolinérgicos inhalados (por ejemplo, ipratropio de acción corta o tiotropio de acción prolongada) actúan para bloquear el efecto de la acetilcolina en los receptores muscarínicos de las células musculares lisas, permitiendo la broncodilatación. Los β2-agonistas y anticolinérgicos inhalados se utilizan tanto para el tratamiento sintomático como para las exacerbaciones agudas de la EPOC. Se prefieren los broncodilatadores de acción prolongada a los de acción corta, ya que se utilizan menos dosis y mejoran el tratamiento de los síntomas. Para un tratamiento más eficaz de la EPOC estable, también puede utilizarse una terapia combinada con un β2-agonista inhalado y un anticolinérgico.
Corticoesteroides
Los corticoesteroides suprimen la respuesta inflamatoria mediante la inhibición de los factores de transcripción, incluido el factor nuclear-κB, que regulan la transcripción de diversas citocinas, quimiocinas, moléculas de adhesión y otras proteínas que inducen y perpetúan la inflamación. Los corticoides inhalados no se utilizan para el tratamiento de las exacerbaciones de la EPOC; sin embargo, se han utilizado en el tratamiento a largo plazo de la EPOC en una minoría de pacientes con EPOC estable que presentan exacerbaciones frecuentes y reversibilidad de los broncodilatadores. Se recomienda el uso de corticosteroides sistémicos durante una exacerbación aguda que requiera hospitalización.
Oxígeno
Cochrane Database Syst Rev. 2005 Oct 19;(4):CD001744.
La terapia con oxígeno se proporciona frecuentemente junto con intervenciones farmacológicas para tratar la hipoxemia subyacente en los pacientes con EPOC. Al reducir la hipoxia en los alvéolos, se reduce la vasoconstricción pulmonar. La reducción de la hipertensión pulmonar disminuye la poscarga del corazón derecho y mejora su función sistólica. El oxígeno también reduce la hipoxemia en la sangre, lo que reduce el riesgo de desarrollar policitemia. Sin embargo, sólo se ha demostrado que la oxigenoterapia reduce la mortalidad en las personas con hipoxemia grave (PaO2 < 55mmHg); por lo demás, no hay beneficio en cuanto a la mortalidad.
Rehabilitación pulmonar
Torácica. 2007 May;131(5 Suppl):4S-42S.
El objetivo de la rehabilitación pulmonar es mejorar la calidad de vida y el funcionamiento diario de los pacientes con EPOC. A través de un equipo multidisciplinar, los pacientes suelen inscribirse en un programa de 6 a 12 semanas que incluye entrenamiento con ejercicios, apoyo psicosocial, mejora nutricional y educación. Numerosos estudios (véase la referencia Chest) han demostrado una mejora de la capacidad de ejercicio, una mejor calidad de vida y una disminución de las hospitalizaciones. Sin embargo, la mortalidad no ha cambiado.
Cirugía de reducción del volumen pulmonar (LVRS)
Ann Thorac Surg. 2006 Aug;82(2):431-43.
La LVRS es una opción quirúrgica que mejora la supervivencia en pacientes con EPOC con enfisema del lóbulo superior y baja capacidad de ejercicio tras la rehabilitación. El procedimiento consiste en resecar partes del pulmón enfermo. Esto tiene dos efectos fisiológicos principales: (1) reduce la hiperinflación, lo que permite que el diafragma se contraiga con su fuerza óptima, y (2) mejora el retroceso pulmonar porque se resecan las partes inelásticas del pulmón.
0 comentarios