Diferencia principal – protón vs positrón
Los átomos son los bloques de construcción de toda la materia. Un átomo está compuesto por un núcleo y una nube de electrones. El núcleo contiene protones y neutrones junto con algunas otras partículas como las partículas alfa y las partículas beta. El protón es una partícula subatómica con carga eléctrica positiva (+1). Un positrón también es una partícula subatómica con carga positiva. La principal diferencia entre el protón y el positrón es que la masa de un protón es considerablemente mayor que la de un positrón.
Aspectos clave tratados
1. Qué es un protón
– Definición, propiedades
2. Qué es un positrón
– Definición, aniquilación
3. Cuáles son las similitudes entre el protón y el positrón
– Esquema de las características comunes
4. Cuál es la diferencia entre el protón y el positrón
– Comparación de las diferencias clave
Términos clave: Aniquilación, Antielectrón, Masa Atómica, Número Atómico, Átomos, Decaimiento Beta, Electrón, Positrones, Protones
Qué es un protón
Un protón es una partícula subatómica con una carga eléctrica positiva de +1. Un protón se simboliza con «p» o «p+». Los protones, junto con los neutrones, forman el núcleo atómico, que es el núcleo de un átomo. La carga eléctrica de un protón es de +1,6022 x 10-19 C (Coulomb). La carga atómica de un protón es de +1. La masa de un protón es de 1,6726 x 10-24 g. Pero la masa atómica de un protón se da como 1,0073 amu (unidades de masa atómica). Esto se utiliza generalmente como 1 amu. Pero la masa de un protón es ligeramente inferior a la de un neutrón.
El número atómico, es decir, el número de protones en el núcleo de un átomo, de un elemento químico es una propiedad única para todos y cada uno de los elementos. Esto se debe a que un elemento químico se reconoce según su número atómico. El número atómico es el número total de protones presentes en un átomo. La tabla periódica de los elementos se construye a partir de los números atómicos de los elementos químicos. Por lo tanto, la tabla periódica está formada por elementos químicos ordenados de forma ascendente según los protones presentes en sus átomos.
Todos y cada uno de los átomos están compuestos por al menos un protón. El átomo neutro más pequeño es el átomo de hidrógeno. Tiene un protón. Los isótopos de un elemento químico son los átomos que tienen el mismo número atómico (número de protones) y diferente número de neutrones.
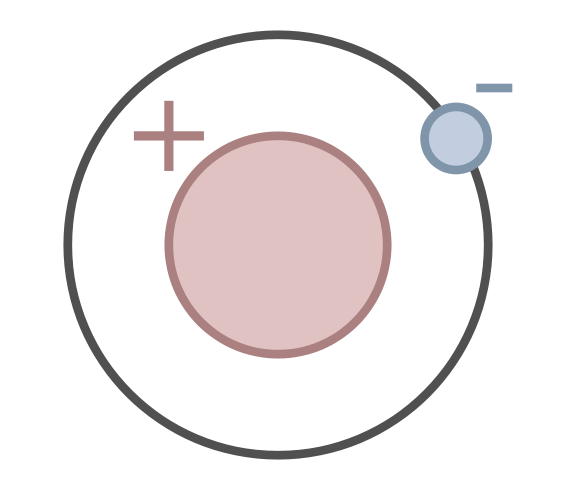
Figura 1: El protio es un isótopo del hidrógeno que tiene un protón y un electrón
Qué es un positrón
El positrón es una partícula subatómica que se considera como un antielectrón. Es la antipartícula del electrón. Por lo tanto, el positrón tiene una carga eléctrica de +1. La masa del positrón es exactamente equivalente a la masa de un electrón; 9,1094 x 10-28 g. La masa atómica del positrón es de 0,00054858 amu. La carga eléctrica es opuesta a la del electrón: +1,6022 x 10-19 C.
Los positrones se producen de forma natural a través de la desintegración beta (β+). Esta forma de desintegración se produce en los isótopos radiactivos. Esta formación de positrones puede ser natural o artificial según la naturaleza del radioisótopo (el radioisótopo puede ser natural o artificial).
Aniquilación de positrones

Figura 2: La aniquilación produce dos o más fotones de rayos gamma
La aniquilación es un proceso en el que un positrón colisiona con un electrón lo que provoca la producción de dos o más fotones de rayos gamma, si la colisión se produce a baja energía.
Similitudes entre el protón y el positrón
- Ambos son partículas subatómicas.
- Ambos tienen carga atómica +1.
- Ambos tienen una carga eléctrica de +1,6022 x 10-19
Diferencia entre protón y positrón
Definición
Protón: Un protón es una partícula subatómica con una carga eléctrica positiva de +1.
Positrón: El positrón es la antipartícula o la contraparte de antimateria del electrón.
Masa
Protón: La masa de un protón es de 1,6726 x 10-24 g.
Positrón: La masa de un positrón es de 9,1094 x 10-28 g.
Masa atómica
Protón: La masa atómica de un protón se da como 1,0073 amu
Positrón: La masa atómica del positrón es de 0,00054858 amu.
Naturaleza
Protón: Los protones son las principales partículas subatómicas responsables del número atómico de un elemento químico.
Positrón: Los positrones son las antipartículas de los electrones.
Aniquilación
Protón: Los protones no sufren aniquilación.
Positrón: Los positrones sufren aniquilación.
Conclusión
Aunque tanto los protones como los positrones son partículas subatómicas con carga positiva, existen diferencias entre ellos. La principal diferencia entre el protón y el positrón es que la masa de un protón (1,6726 x 10-24 g) es considerablemente mayor que la de un positrón (9,1094 x 10-28 g).
Referencia:
1. «Partículas subatómicas». Chemistry LibreTexts, Libretexts, 21 de julio de 2016, Disponible aquí.
2. «Positrón». Wikipedia, Fundación Wikimedia, 24 de enero de 2018, Disponible aquí.
3. «Positrón». Encyclopædia Britannica, Encyclopædia Britannica, inc., 3 de junio de 2013, Disponible aquí.
Imagen de cortesía:
1. «Protium» Por Blacklemon67 en Wikipedia en español – Obra propia (Texto original: I (Blacklemon67 (talk)) (Dominio Público) vía Commons Wikimedia
2. «Mutual Annihilation of a Positron Electron pair» By Manticorp – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()
0 comentarios