Se ha observado el uso del hidruro de aluminio y litio (LiAlH4) y del borohidruro de sodio (NaBH4) como reactivos para la reducción de aldehídos y cetonas a 1º y 2º-alcoholes respectivamente. De ellos, el hidruro de aluminio y litio, a menudo abreviado como LAH, es el más útil para reducir los derivados de los ácidos carboxílicos. Gracias a su alta reactividad, el LAH reduce fácilmente todas las clases de derivados del ácido carboxílico, generalmente al estado de oxidación -1. Los ácidos, ésteres, anhídridos y cloruros de acilo se reducen a 1º-alcoholes, y este método es superior a la reducción catalítica en la mayoría de los casos. Dado que los cloruros de acilo y los anhídridos son caros y su preparación requiere mucho tiempo, los ácidos y los ésteres son los reactivos más utilizados para esta transformación. Al igual que en las reducciones de aldehídos y cetonas, se cree que el primer paso en cada caso es la adición irreversible del hidruro al átomo de carbono electrófilo. El enlace coordinativo del oxígeno del carbonilo a un metal ácido de Lewis (Li o Al) sin duda aumenta el carácter electrófilo de ese carbono. Esta adición de hidruros se muestra en los siguientes diagramas, con la fracción donadora de hidruros escrita como AlH4(-). Los cuatro hidrógenos están potencialmente disponibles para la reducción, pero cuando los ácidos carboxílicos se reducen, uno de los hidruros reacciona con el O-H ácido para generar gas hidrógeno. Aunque el litio no se muestra, estará presente en los productos como componente catiónico de las sales iónicas.
Las amidas se reducen a aminas por tratamiento con LAH, y éste ha demostrado ser uno de los métodos más generales para preparar todas las clases de aminas (1º, 2º & 3º). Debido a que el resultado de la reducción de LAH es tan diferente para los ésteres y las amidas, debemos examinar los mecanismos de reacción plausibles para estas reacciones para descubrir una razón para este comportamiento divergente.
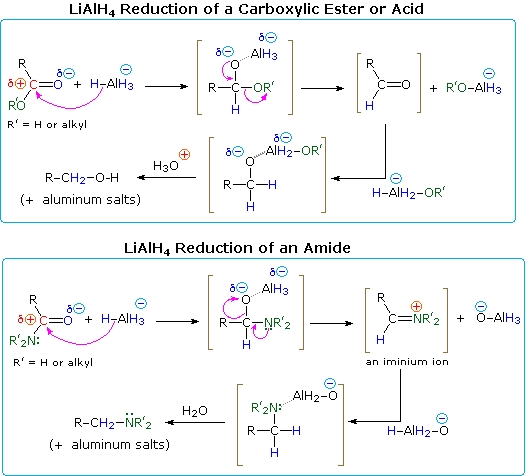
Una explicación del diferente curso que toman las reducciones de los ésteres y las amidas radica en la naturaleza de los diferentes sustituyentes de los heteroátomos en el grupo carbonilo (coloreado en verde en el diagrama). El nitrógeno es más básico que el oxígeno, y los aniones amida son grupos salientes más pobres que los aniones alcóxido. Además, el oxígeno forma enlaces especialmente fuertes con el aluminio. La adición de hidruro produce un intermedio tetraédrico, mostrado entre paréntesis, que tiene un enlace polar oxígeno-aluminio. Ni el hidrógeno ni el grupo alquilo (R) son posibles grupos salientes, por lo que si esta especie tetraédrica va a sufrir una eliminación para reformar un doble enlace de un heteroátomo, debe perderse uno de los dos sustituyentes restantes. En el caso del éster, esta es una elección fácil (descrita por las flechas curvas). Al eliminar un alcóxido de aluminio (R’O-Al), se forma un aldehído, que se reduce rápidamente a la sal de un 1º alcohol por LAH. En el caso de la amida, la formación del aldehído requiere la pérdida de una amida de aluminio (R’2N-Al), un proceso poco probable. Alternativamente, el nitrógeno más básico puede actuar para expulsar una especie de óxido metálico (por ejemplo, Al-O(-)), y el doble enlace iminio resultante se reduciría entonces a una amina. Este es el curso que siguen la mayoría de las reducciones de amidas; pero en el caso de las 1º-amidas, la acidez de los hidrógenos del nitrógeno, junto con la basicidad del hidruro, permite una fácil eliminación del oxígeno (como una fracción de óxido). El intermedio nitrilo resultante se reduce a una 1º-amina. De hecho, los nitrilos son un producto importante cuando se utiliza menos de una equivalencia completa de LiAlH4. Un mecanismo se mostrará arriba haciendo clic en el diagrama.
El hidruro de aluminio y litio reduce los nitrilos a 1º-aminas, como se muestra en la siguiente ecuación. Una adición inicial de hidruro al átomo de carbono del nitrilo electrófilo genera la sal de un intermedio de imina. A esto le sigue una segunda transferencia de hidruro, y la sal de amina metálica resultante se hidroliza a una 1º-amina. Este método proporciona una alternativa útil a la reducción catalítica de nitrilos, descrita anteriormente, cuando están presentes las funciones de alqueno o alquino.
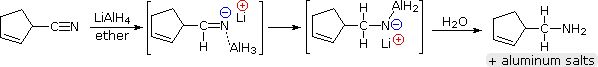
En contraste con la utilidad del hidruro de aluminio y litio en la reducción de varios derivados del ácido carboxílico, el borohidruro de sodio rara vez se elige para este propósito. En primer lugar, el NaBH4 se utiliza a menudo en disolventes hidroxílicos (agua y alcoholes), y éstos reaccionarían con los cloruros de acilo y los anhídridos. Además, es poco soluble en disolventes relativamente no polares, especialmente a bajas temperaturas. En segundo lugar, el NaBH4 es mucho menos reactivo que el LAH, no reduciendo en absoluto las amidas y los ácidos (forman sales de carboxilato), y reduciendo muy lentamente los ésteres.
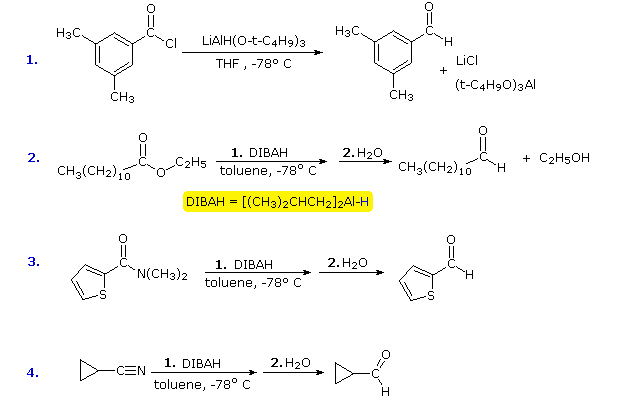
Dado que existen relativamente pocos métodos para la reducción de derivados de ácidos carboxílicos a aldehídos, sería útil modificar la reactividad y solubilidad del LAH para permitir que se logren reducciones parciales de este tipo. El enfoque más fructífero para este fin ha sido adjuntar grupos alcoxi o alquilo en el aluminio. Esto no sólo modifica la reactividad del reactivo como donante de hidruros, sino que también aumenta su solubilidad en disolventes no polares. Aquí se mencionarán dos de estos reactivos; el átomo de hidruro reactivo está coloreado en azul.
![]() Tri-tert-butoxialuminohidruro de litio (LtBAH), LiAl3H : Soluble en THF, diglima & éter.
Tri-tert-butoxialuminohidruro de litio (LtBAH), LiAl3H : Soluble en THF, diglima & éter.![]() Hidruro de diisobutilaluminio (DIBAH), 2AlH : Soluble en tolueno, THF & éter.
Hidruro de diisobutilaluminio (DIBAH), 2AlH : Soluble en tolueno, THF & éter.
Cada uno de estos reactivos lleva un equivalente de hidruro. El primero (LtBAH) es un hidruro metálico complejo, pero el segundo es simplemente un derivado alquilo del hidruro de aluminio. En la práctica, ambos reactivos se utilizan en cantidades equimolares, y normalmente a temperaturas muy inferiores a 0 ºC. Los siguientes ejemplos ilustran cómo pueden prepararse aldehídos a partir de derivados de ácidos carboxílicos mediante la aplicación cuidadosa de estos reactivos. Una temperatura de -78 ºC se mantiene fácilmente utilizando hielo seco como refrigerante. Los intermedios reducidos que conducen a los aldehídos se mostrarán al hacer clic en el botón «Show Intermediates». Con un exceso de reactivo a temperaturas superiores a 0 ºC la mayoría de los derivados de los ácidos carboxílicos se reducen a alcoholes o aminas.
Contribuidores
-
William Reusch, Profesor Emérito (Michigan State U.), Virtual Textbook of Organic Chemistry
La mayoría de los derivados de los ácidos carboxílicos se reducen a alcoholes o aminas.
0 comentarios