Descripción
Brimonidina tartrato solución oftálmica 0,2% es un agonista adrenérgico alfa-2 relativamente selectivo para uso oftálmico. En solución, la solución oftálmica de tartrato de brimonidina al 0,2% tiene un color amarillo verdoso claro. Tiene una osmolalidad de 280-330 mOsml/kg y un pH de 5,6-6,6 La fórmula estructural es
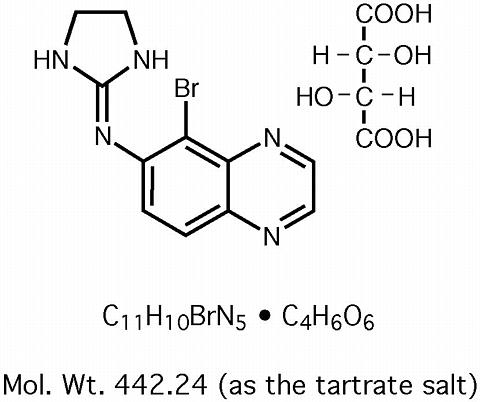
Nombre químico: 5-bromo-6-(2-imidazolidinilideneamino) quinoxalina L-tartrato.
Número CAS 59803-98-4
Cada mL contiene:
Activo: tartrato de brimonidina: 0,2% (2 mg/mL).
INACTIVOS: Ácido cítrico, alcohol polivinílico, cloruro de sodio, citrato de sodio, agua purificada. Puede añadirse ácido clorhídrico y/o hidróxido de sodio para ajustar el pH.
PRESERVATIVO AÑADIDO: Cloruro de benzalconio (0,05 mg).
Farmacología clínica
Mecanismo de acción: La solución oftálmica de tartrato de brimonidina al 0,2% es un agonista de los receptores alfa adrenérgicos. Tiene un efecto hipotensor ocular máximo que se produce a las dos horas después de la dosis. Los estudios fluorofotométricos realizados en animales y humanos sugieren que el tartrato de brimonidina tiene un mecanismo de acción doble al reducir la producción de humor acuoso y aumentar el flujo de salida uveoescleral.
Farmacocinética: Tras la administración ocular de una solución al 0,2%, las concentraciones plasmáticas alcanzaron su máximo en un plazo de 1 a 4 horas y disminuyeron con una semivida sistémica de aproximadamente 3 horas. En los seres humanos, el metabolismo sistémico de la brimonidina es extenso. Se metaboliza principalmente en el hígado. La excreción urinaria es la principal vía de eliminación del fármaco y sus metabolitos. Aproximadamente el 87% de una dosis radiactiva administrada por vía oral se eliminó en 120 horas, encontrándose el 74% en la orina.
Evaluaciones clínicas: La PIO elevada representa un factor de riesgo importante en la pérdida de campo glaucomatosa. Cuanto más elevado sea el nivel de la PIO, mayor será la probabilidad de que se produzcan daños en el nervio óptico y pérdida del campo visual. El tartrato de brimonidina tiene la acción de disminuir la presión intraocular con un efecto mínimo sobre los parámetros cardiovasculares y pulmonares.
En estudios clínicos comparativos con timolol 0,5%, de hasta un año de duración, el efecto de disminución de la PIO de la solución oftálmica de tartrato de brimonidina 0,2% fue de aproximadamente 4-6 mmHg en comparación con aproximadamente 6 mmHg para timolol. En estos estudios, ambos grupos de pacientes fueron dosificados BID; sin embargo, debido a la duración de la acción de la solución oftálmica de tartrato de brimonidina al 0,2%, se recomienda que la solución oftálmica de tartrato de brimonidina al 0,2% sea dosificada TID. El 8% de los sujetos fueron suspendidos de los estudios debido a un control inadecuado de la presión intraocular, que en el 30% de estos pacientes se produjo durante el primer mes de tratamiento. Aproximadamente el 20% se interrumpió debido a experiencias adversas.
Indicación y uso
Brimonidina tartrato solución oftálmica al 0,2% está indicada para disminuir la presión intraocular en pacientes con glaucoma de ángulo abierto o hipertensión ocular. La eficacia reductora de la PIO de la solución oftálmica de tartrato de brimonidina al 0,2% disminuye con el tiempo en algunos pacientes. Esta pérdida de efecto aparece con un tiempo de aparición variable en cada paciente y debe ser vigilada estrechamente.
Contraindicaciones
Tartrato de brimonidina solución oftálmica al 0,2% está contraindicado en pacientes con hipersensibilidad al tartrato de brimonidina o a cualquier componente de este medicamento. También está contraindicado en pacientes que reciben tratamiento con inhibidores de la monoaminooxidasa (MAO).
Precauciones:
Generalidades: Aunque la solución oftálmica de tartrato de brimonidina al 0,2% tuvo un efecto mínimo sobre la presión arterial de los pacientes en los estudios clínicos, se debe tener precaución en el tratamiento de pacientes con enfermedades cardiovasculares graves.
No se ha estudiado la solución oftálmica de tartrato de brimonidina al 0,2% en pacientes con insuficiencia hepática o renal; se debe tener precaución en el tratamiento de dichos pacientes.
Tartrato de brimonidina solución oftálmica al 0,2% debe utilizarse con precaución en pacientes con depresión, insuficiencia cerebral o coronaria, fenómeno de Raynaud, hipotensión ortostática o tromboangeítis obliterante.
Durante los estudios se produjo una pérdida de efecto en algunos pacientes. La eficacia de la reducción de la PIO observada con la solución oftálmica de tartrato de brimonidina al 0,2% durante el primer mes de tratamiento puede no reflejar siempre el nivel de reducción de la PIO a largo plazo. Los pacientes a los que se les prescribe una medicación para reducir la PIO deben ser controlados rutinariamente en cuanto a la PIO.
Información para los pacientes: El conservante de la solución oftálmica de tartrato de brimonidina al 0,2%, el cloruro de benzalconio, puede ser absorbido por las lentes de contacto blandas. Los pacientes que lleven lentes de contacto blandas deben ser instruidos para que esperen al menos 15 minutos después de la instilación de tartrato de brimonidina solución oftálmica al 0,2% para colocarse las lentes de contacto blandas.
Al igual que con otros medicamentos de esta clase, tartrato de brimonidina solución oftálmica al 0,2% puede causar fatiga y/o somnolencia en algunos pacientes. Se debe advertir a los pacientes que realicen actividades peligrosas de la posibilidad de una disminución del estado de alerta mental.
Interacciones con otros medicamentos: Aunque no se han realizado estudios específicos de interacción con medicamentos con brimonidina tartrato solución oftálmica 0,2%, debe considerarse la posibilidad de un efecto aditivo o potenciador con depresores del SNC (alcohol, barbitúricos, opiáceos, sedantes o anestésicos). Los alfa-agonistas, como clase, pueden reducir el pulso y la presión arterial. Se recomienda precaución en el uso de fármacos concomitantes como betabloqueantes (oftálmicos y sistémicos), antihipertensivos y/o glucósidos cardíacos.
Se ha informado que los antidepresivos tricíclicos atenúan el efecto hipotensor de la clonidina sistémica. Se desconoce si el uso concurrente de estos agentes con la solución oftálmica de tartrato de brimonidina al 0,2% en humanos puede dar lugar a una interferencia resultante en el efecto de disminución de la PIO. No se dispone de datos sobre el nivel de catecolaminas circulantes tras la administración de tartrato de brimonidina solución oftálmica al 0,2%. No obstante, se recomienda tener precaución en pacientes que toman antidepresivos tricíclicos que pueden afectar al metabolismo y a la captación de aminas circulantes.
Carcinogénesis, mutagénesis, alteración de la fertilidad: No se observaron efectos carcinogénicos relacionados con el compuesto ni en ratones ni en ratas tras un estudio de 21 y 24 meses, respectivamente. En estos estudios, la administración dietética de tartrato de brimonidina a dosis de hasta 2,5 mg/kg/día en ratones y 1,0 mg/kg/día en ratas alcanzó ~77 y 118 veces, respectivamente, la concentración plasmática del fármaco estimada en humanos tratados con una gota de solución oftálmica de tartrato de brimonidina al 0,2% en ambos ojos 3 veces al día.
Tartrato de brimonidina no fue mutagénico ni citogénico en una serie de estudios in vitro e in vivo, incluyendo el test de Ames, el ensayo de aberración cromosómica en células de ovario de hámster chino (CHO), un ensayo mediado por el huésped y estudios citogénicos en ratones, y el ensayo letal dominante.
Los estudios reproductivos realizados en ratas con dosis orales de 0,66 mg base/kg no revelaron ninguna evidencia de daño al feto debido a la solución oftálmica de tartrato de brimonidina al 0,2%.
Embarazo: Efectos teratogénicos: Embarazo Categoría B.
Los estudios reproductivos realizados en ratas con dosis orales de 0,66 mg base/kg no revelaron evidencia de daño al feto debido a la solución oftálmica de tartrato de brimonidina al 0,2%. La dosificación a este nivel produjo un nivel de concentración plasmática del fármaco 100 veces superior al observado en humanos tras múltiples dosis oftálmicas.
No existen estudios adecuados y bien controlados en mujeres embarazadas. En estudios con animales, la brominidina atravesó la placenta y entró en la circulación fetal de forma limitada. La solución oftálmica de tartrato de brimonidina al 0,2% debe utilizarse durante el embarazo sólo si el beneficio potencial para la madre justifica el riesgo potencial para el feto.
Madres lactantes: Se desconoce si este medicamento se excreta en la leche humana; en estudios con animales el tartrato de brimonidina se excretó en la leche materna. Se debe decidir si se interrumpe la lactancia o se suspende el medicamento, teniendo en cuenta la importancia del mismo para la madre.
Uso pediátrico: En un estudio clínico bien controlado realizado en pacientes pediátricos con glaucoma (de 2 a 7 años de edad) los acontecimientos adversos más comúnmente observados con la solución oftálmica de tartrato de brimonidina al 0,2% dosificada tres veces al día fueron somnolencia (50% – 83% en pacientes de 2 a 6 años de edad) y disminución del estado de alerta. En pacientes pediátricos de 7 años o más (>20kg), la somnolencia parece ocurrir con menos frecuencia (25%). El acontecimiento adverso más comúnmente observado fue la somnolencia. Aproximadamente el 16% de los pacientes que recibieron la solución oftálmica de tartrato de brimonidina interrumpieron el estudio debido a la somnolencia.
La seguridad y eficacia de la solución oftálmica de tartrato de brimonidina 0,2% no se ha estudiado en pacientes pediátricos menores de 2 años. No se recomienda el uso de tartrato de brimonidina solución oftálmica al 0,2% en pacientes pediátricos menores de 2 años. (Consulte también la sección Reacciones adversas).
Uso geriátrico: No se han observado diferencias globales en cuanto a seguridad o eficacia entre los pacientes ancianos y otros pacientes adultos.
Reacciones adversas: Los acontecimientos adversos que se produjeron en aproximadamente el 10-30% de los sujetos, en orden descendente de incidencia, incluyeron sequedad oral, hiperemia ocular, ardor y escozor, dolor de cabeza, visión borrosa, sensación de cuerpo extraño, fatiga/somnolencia, folículos conjuntivales, reacciones alérgicas oculares y prurito ocular.
Los acontecimientos que se produjeron en aproximadamente el 3-9% de los sujetos, en orden descendente incluyeron tinción/erosión corneal, fotofobia, eritema de los párpados, dolor ocular, sequedad ocular, lagrimeo, síntomas de las vías respiratorias superiores, edema de los párpados, edema conjuntival, mareo, blefaritis, irritación ocular, síntomas gastrointestinales, astenia, escaldado conjuntival, visión anormal y dolor muscular.
Las siguientes reacciones adversas se notificaron en menos del 3% de los pacientes: formación de costras en el párpado, hemorragia conjuntival, sabor anormal, insomnio, secreción conjuntival, depresión, hipertensión, ansiedad, palpitaciones/arritmias, sequedad nasal y síncope.
Los siguientes acontecimientos se han identificado durante el uso posterior a la comercialización de la solución oftálmica de tartrato de brimonidina 0,2% en la práctica clínica. Debido a que se han notificado de forma voluntaria a partir de una población de tamaño desconocido, no se pueden realizar estimaciones ni frecuencia. Los acontecimientos, que han sido elegidos para su inclusión debido a su gravedad, a la frecuencia de las notificaciones, a la posible conexión causal con la solución oftálmica de tartrato de brimonidina al 0,2%, o a una combinación de estos factores, incluyen: bradicardia; hipotensión; iritis; miosis; reacciones cutáneas (incluyendo eritema, prurito en los párpados, erupción cutánea y vasodilatación); y taquicardia. Se han notificado casos de apnea, bradicardia, hipotensión, hipotermia, hipotonía y somnolencia en lactantes que recibieron tartrato de brimonidina en solución oftálmica al 0,2%.
Sobredosis:
No se dispone de información sobre sobredosis en humanos. El tratamiento de una sobredosis oral incluye terapia de apoyo y sintomática; se debe mantener una vía aérea permeable.
Dosificación y administración
La dosis recomendada es una gota de tartrato de brimonidina solución oftálmica al 0.2% en el (los) ojo(s) afectado(s) tres veces al día, con un intervalo de aproximadamente 8 horas.
Tartrato de brimonidina solución oftálmica 0,2% puede utilizarse de forma concomitante con otros productos farmacéuticos oftálmicos tópicos para reducir la presión intraocular. Si se utiliza más de un producto oftálmico tópico, los productos deben administrarse con un intervalo de al menos 5 minutos.
Cómo se suministra
Tartrato de brimonidina solución oftálmica al 0,2% se presenta estéril en un frasco de plástico con punta de gota controlada en los siguientes tamaños:
Frascos de 5 mL – Prod. No. 41107
Frascos de 10 mL – Prod. No. 41109
Frascos de 15 mL – Prod. No. 41111
Almacenamiento: Almacenar entre 15° – 25°C (59° – 77°F).
Mantener fuera del alcance de los niños.
No utilizar si el «sello de protección» impreso en amarillo no está intacto.
Bausch & Lomb
Pharmaceuticals, Inc.
Tampa, FL 33637
©Bausch & Lomb Incorporated
XO50280 (Folded) XM10082 (Flat)
REV. 2/04-02
Prod. No. 411
FOTOS DEL PRODUCTO:
NOTA: Estas fotos sólo pueden utilizarse para la identificación por la forma, el color y la impresión. No representan el tamaño real o relativo.
Las muestras del producto que se muestran aquí han sido suministradas por el fabricante. Aunque se ha hecho todo lo posible para garantizar una reproducción exacta, recuerde que cualquier identificación visual debe considerarse preliminar. En casos de intoxicación o sospecha de sobredosis, la identidad del medicamento debe verificarse mediante un análisis químico.
0 comentarios