as fuentes más comunes del nucleófilo hidruro son el hidruro de aluminio y litio (LiAlH4) y el borohidruro de sodio (NaBH4). Nota. El anión hidruro no está presente durante esta reacción; más bien, estos reactivos sirven como fuente de hidruro debido a la presencia de un enlace polar metal-hidrógeno. Debido a que el aluminio es menos electronegativo que el boro, el enlace Al-H en LiAlH4 es más polar, por lo tanto, haciendo LiAlH4 un agente reductor más fuerte.
La adición de un anión hidruro (H:-) a un aldehído o a una cetona da un anión alcóxido, que al protonarse da el alcohol correspondiente. Los aldehídos producen 1º-alcoholes y las cetonas producen 2º-alcoholes.
En las reducciones de hidruros metálicos las sales de alcóxido resultantes son insolubles y deben ser hidrolizadas (con cuidado) antes de poder aislar el producto alcohólico. En la reducción de borohidruro de sodio, el sistema de disolventes de metanol logra esta hidrólisis automáticamente. En la reducción de hidruro de aluminio y litio se suele añadir agua en un segundo paso. El litio, el sodio, el boro y el aluminio terminan como sales inorgánicas solubles al final de cualquiera de las dos reacciones. Nota Tanto el LiAlH4 como el NaBH4 son capaces de reducir aldehídos y cetonas al alcohol correspondiente.
Mecanismo
Este mecanismo es para una reducción de LiAlH4. El mecanismo para una reducción de NaBH4 es el mismo excepto que el metanol es la fuente de protones utilizada en el segundo paso.
1) Ataque nucleopílico por el anión hidruro
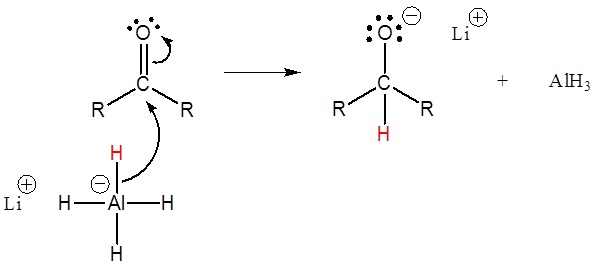
2) El alcóxido es protonado
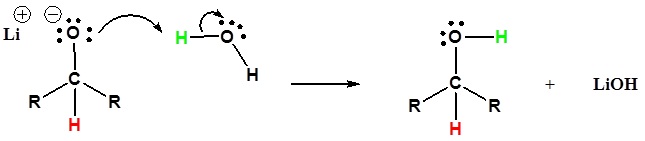
Pasar de los reactivos a los productos simplificado
Dos fuentes prácticas de reactividad tipo hidrurocomo la reactividad son los hidruros metálicos complejos hidruro de aluminio de litio (LiAlH4) y borohidruro de sodio (NaBH4). Ambos son sólidos blancos (o casi blancos), que se preparan a partir de los hidruros de litio o de sodio por reacción con haluros de aluminio o de boro y ésteres. El hidruro de litio y aluminio es, con mucho, el más reactivo de los dos compuestos, ya que reacciona violentamente con el agua, los alcoholes y otros grupos ácidos con la evolución de gas hidrógeno. La siguiente tabla resume algunas características importantes de estos útiles reactivos.
Sería genial convertir esta tabla en texto.
Problemas
1) Dibuja los productos de las siguientes reacciones:
2) Dibuja la estructura de la molécula que debe reaccionar para obtener el producto.
3) El óxido de deuterio (D2O) es una forma de agua en la que los hidrógenos han sido sustituidos por deuterios. Para la siguiente reducción de LiAlH4 el agua típicamente utilizada ha sido sustituida por óxido de deuterio. Dibuja el producto de la reacción y coloca el deuterio en el lugar adecuado. Sugerencia. Fíjate en el mecanismo de la reacción.
Respuestas
1)
2)
3)
Contribuidores
- Prof. Steven Farmer (Sonoma State University)
- William Reusch, profesor emérito (Michigan State U.), Libro de texto virtual de química orgánica
0 comentarios