Una típica célula electrolítica se puede hacer como se muestra en la figura \(\PageIndex{1}). Dos conductores eléctricos (electrodos) se sumergen en el líquido a electrolizar. Estos electrodos suelen ser de un material inerte, como el acero inoxidable, el platino o el grafito. El líquido a electrolizar debe ser capaz de conducir la electricidad, por lo que suele ser una solución acuosa de un electrolito o un compuesto iónico fundido. Los electrodos están conectados mediante cables a una batería u otra fuente de corriente continua. Esta fuente de corriente puede considerarse como una «bomba de electrones» que toma los electrones de un electrodo y los empuja hacia el otro electrodo. El electrodo del que se extraen los electrones se carga positivamente, mientras que el electrodo al que se suministran tiene un exceso de electrones y una carga negativa.
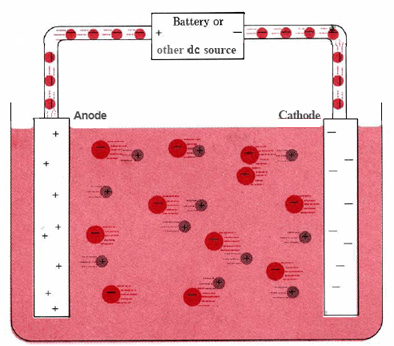
El electrodo cargado negativamente atraerá iones positivos (cationes) hacia él desde la solución. Puede donar algunos de sus electrones sobrantes a dichos cationes o a otras especies del líquido que se está electrolizando. Por lo tanto, este electrodo es en efecto un agente reductor. En cualquier célula electroquímica (electrolítica o galvánica) el electrodo en el que se produce la reducción se denomina cátodo.
El electrodo positivo, por otro lado, atraerá hacia sí los iones negativos (aniones). Este electrodo puede aceptar electrones de esos iones negativos o de otras especies de la solución y, por tanto, se comporta como un agente oxidante. En cualquier célula electroquímica, el ánodo es el electrodo en el que se produce la oxidación. Una forma fácil de recordar qué electrodo es cada uno es que el ánodo y la oxidación comienzan con vocales mientras que el cátodo y la reducción comienzan con consonantes.
El siguiente vídeo muestra este proceso que tiene lugar en una solución neutra de agua con algunos electrolitos presentes.
Como ejemplo de cómo la electrólisis puede provocar una reacción química, supongamos que hacemos pasar una corriente eléctrica continua a través de 1 M de HCl. Los iones H3O+ de esta solución serán atraídos hacia el cátodo, y los iones Cl- migrarán hacia el ánodo. En el cátodo, el H3O+ se reducirá a H2 gaseoso según la semiequación
(Como se ha visto en otras secciones, escribiremos H+ en lugar de H3O+ en las semiequaciones para ahorrar tiempo). En el ánodo se aceptarán los electrones de los iones Cl-, oxidándolos a Cl2:
Durante la electrólisis burbujean H2(g) y Cl2(g) desde el cátodo y el ánodo, respectivamente. La ecuación global de la electrólisis es la suma de las Ecs. \(\ref{1}\}) y \(\ref{2}\} :
o
La reacción neta es la inversa de la combinación espontánea de H2(g) con Cl2(g) para formar HCl(aq). Tal resultado es cierto en la electrólisis en general: la corriente eléctrica suministrada desde el exterior del sistema hace que se produzca una reacción química no espontánea.
Aunque la electrólisis siempre invierte una reacción redox espontánea, el resultado de una electrólisis dada puede no ser siempre la reacción que queremos. En una solución acuosa, por ejemplo, siempre hay una gran cantidad de moléculas de agua en las proximidades del ánodo y del cátodo. Estas moléculas de agua pueden donar electrones al ánodo o aceptar electrones del cátodo, al igual que los aniones o cationes. En consecuencia, la electrólisis puede oxidar y/o reducir el agua en lugar de hacer reaccionar el electrolito disuelto. Un ejemplo de este problema es la electrólisis del fluoruro de litio, LiF. Podríamos esperar una reducción del Li+ en el cátodo y una oxidación del F- en el ánodo, de acuerdo con las semiequaciones
Sin embargo, el Li+ es un aceptor de electrones muy pobre, por lo que es muy difícil forzar que se produzca la ecuación \ {ref{5}\}. En consecuencia, el exceso de electrones del cátodo es aceptado por las moléculas de agua en su lugar:
Una situación similar se produce en el ánodo. Los iones F- son agentes reductores extremadamente débiles -mucho más débiles que las moléculas de H2O- por lo que la ecuación media es
La ecuación global puede obtenerse multiplicando la ecuación \(ref{7}\} por 2, sumándola a la ecuación \{ref{8}\} y combinando H+ con OH- para formar H2O:
El siguiente vídeo muestra cómo se produce la electrólisis del agua, utilizando ácido sulfúrico como puente para permitir la transferencia de carga. Una vez finalizada la electrólisis, se verifica la identidad de los gases formados mediante pruebas de quema de tablillas.
Así, esta electrólisis invierte la combinación espontánea de H2 y O2 para formar H2O. Al hablar de las reacciones redox mencionamos varios agentes oxidantes, como los que son lo suficientemente fuertes para oxidar el H2O. Al mismo tiempo, describimos los agentes reductores que son lo suficientemente fuertes como para reducir el H2O, como los metales alcalinos y las tierras alcalinas más pesadas. Por regla general, estas sustancias no pueden producirse por electrólisis de soluciones acuosas, ya que el H2O se oxida o se reduce en su lugar. Las sustancias que experimentan una reacción redox espontánea con el H2O suelen producirse por electrólisis de sales fundidas o en algún otro disolvente. Sin embargo, hay algunas excepciones a esta regla, ya que algunas reacciones de electrólisis son más lentas que otras. Utilizando la tabla 11.5, por ejemplo, predeciríamos que el H2O es un mejor agente reductor que el Cl-.
Por lo tanto, esperaríamos que el O2, y no el Cl2, se produjera por electrólisis de 1 M de HCl, en contradicción con la ecuación \(\ref{1}\N-). Resulta que el O2 se produce más lentamente que el Cl2, y este último burbujea fuera de la solución antes de que el H2O pueda ser oxidado. Por esta razón, la Tabla 1 que se encuentra en la sección de Acoplamientos Redox no siempre puede utilizarse para predecir lo que ocurrirá en una electrólisis.
Contribuidores
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Universidad de Minnesota Rochester), Tim Wendorff y Adam Hahn.
0 comentarios