Sustancias puras y mezclas
Una sustancia química pura es cualquier materia que tiene una composición química fija y propiedades características. El oxígeno, por ejemplo, es una sustancia química pura que es un gas incoloro e inodoro a 25°C. Muy pocas muestras de materia están formadas por sustancias puras; en cambio, la mayoría son mezclas, que son combinaciones de dos o más sustancias puras en proporciones variables en las que las sustancias individuales conservan su identidad. El aire, el agua del grifo, la leche, el queso azul, el pan y la suciedad son mezclas. Si todas las partes de un material se encuentran en el mismo estado, no tienen límites visibles y son uniformes en toda su extensión, entonces el material es homogéneo. Ejemplos de mezclas homogéneas son el aire que respiramos y el agua del grifo que bebemos. Las mezclas homogéneas también se denominan soluciones. Así, el aire es una solución de nitrógeno, oxígeno, vapor de agua, dióxido de carbono y otros gases; el agua del grifo es una solución de pequeñas cantidades de varias sustancias en agua. Sin embargo, las composiciones específicas de ambas soluciones no son fijas, sino que dependen tanto de la fuente como de la ubicación; por ejemplo, la composición del agua del grifo en Boise, Idaho, no es la misma que la del agua del grifo en Buffalo, Nueva York. Aunque la mayoría de las soluciones que encontramos son líquidas, también pueden ser sólidas. La sustancia gris que todavía utilizan algunos dentistas para rellenar las caries es una solución sólida compleja que contiene un 50% de mercurio y un 50% de un polvo que contiene principalmente plata, estaño y cobre, con pequeñas cantidades de zinc y mercurio. Las soluciones sólidas de dos o más metales se denominan comúnmente aleaciones.
Si la composición de un material no es completamente uniforme, entonces es heterogéneo (por ejemplo, la masa de galletas de chocolate, el queso azul y la tierra). Las mezclas que parecen ser homogéneas a menudo resultan ser heterogéneas tras un examen microscópico. La leche, por ejemplo, parece ser homogénea, pero cuando se examina al microscopio, está claramente formada por pequeños glóbulos de grasa y proteína dispersos en el agua. Los componentes de las mezclas heterogéneas suelen poder separarse por medios sencillos. Las mezclas sólido-líquido, como la arena en el agua o las hojas de té en el té, se separan fácilmente por filtración, que consiste en hacer pasar la mezcla a través de una barrera, como un colador, con agujeros o poros más pequeños que las partículas sólidas. En principio, las mezclas de dos o más sólidos, como el azúcar y la sal, pueden separarse mediante inspección microscópica y clasificación. Sin embargo, suelen ser necesarias operaciones más complejas, como cuando se separan las pepitas de oro de la grava del río mediante el bateo. Primero se filtra el material sólido del agua del río; luego se separan los sólidos mediante inspección. Si el oro está incrustado en la roca, es posible que haya que aislarlo con métodos químicos.
-and-Milk-(left).jpg?revision=1)
Las mezclas heterogéneas (soluciones) pueden separarse en las sustancias que las componen mediante procesos físicos que se basan en las diferencias de alguna propiedad física, como las diferencias en sus puntos de ebullición. Dos de estos métodos de separación son la destilación y la cristalización. La destilación utiliza las diferencias de volatilidad, una medida de la facilidad con la que una sustancia se convierte en gas a una temperatura determinada. Un simple aparato de destilación para separar una mezcla de sustancias, de las cuales al menos una es un líquido. El componente más volátil hierve primero y se condensa hasta convertirse en líquido en el condensador refrigerado por agua, desde el que fluye hacia el matraz receptor. Si se destila una solución de sal y agua, por ejemplo, el componente más volátil, el agua pura, se acumula en el matraz receptor, mientras que la sal permanece en el matraz de destilación.

Las mezclas de dos o más líquidos con diferentes puntos de ebullición pueden separarse con un aparato de destilación más complejo. Un ejemplo es el refinado del petróleo crudo en una serie de productos útiles: combustible de aviación, gasolina, queroseno, gasóleo y aceite lubricante (en el orden aproximado de volatilidad decreciente). Otro ejemplo es la destilación de bebidas alcohólicas como el brandy o el whisky. (Este procedimiento relativamente sencillo causó más de un quebradero de cabeza a las autoridades federales en la década de 1920, durante la época de la Prohibición, ¡cuando los alambiques ilegales proliferaban en regiones remotas de los Estados Unidos!)
La cristalización separa las mezclas basándose en las diferencias de solubilidad, una medida de la cantidad de sustancia sólida que permanece disuelta en una cantidad determinada de un líquido específico. La mayoría de las sustancias son más solubles a temperaturas más altas, por lo que una mezcla de dos o más sustancias puede disolverse a una temperatura elevada y luego dejarse enfriar lentamente. Otra posibilidad es dejar que el líquido, llamado disolvente, se evapore. En cualquiera de los dos casos, la menos soluble de las sustancias disueltas, la que tiene menos probabilidades de permanecer en la solución, suele formar cristales primero, y estos cristales pueden ser eliminados de la solución restante por filtración.

La mayoría de las mezclas pueden separarse en sustancias puras, que pueden ser elementos o compuestos. Un elemento, como el sodio gris y metálico, es una sustancia que no puede descomponerse en otras más simples mediante cambios químicos; un compuesto, como el cloruro de sodio blanco y cristalino, contiene dos o más elementos y tiene propiedades químicas y físicas que suelen ser diferentes de las de los elementos que lo componen. Salvo algunas excepciones, un compuesto concreto tiene la misma composición elemental (los mismos elementos en las mismas proporciones) independientemente de su origen o historia. La composición química de una sustancia se altera en un proceso llamado cambio químico. La conversión de dos o más elementos, como el sodio y el cloro, en un compuesto químico, el cloruro de sodio, es un ejemplo de cambio químico, a menudo llamado reacción química. Actualmente se conocen unos 118 elementos, pero se han preparado millones de compuestos químicos a partir de estos 118 elementos. Los elementos conocidos se enumeran en la tabla periódica.
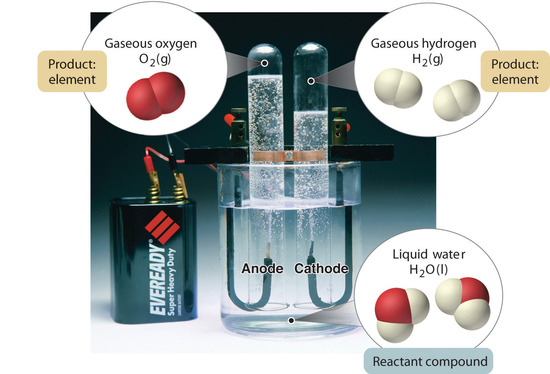
En general, un proceso químico inverso descompone los compuestos en sus elementos. Por ejemplo, el agua (un compuesto) puede descomponerse en hidrógeno y oxígeno (ambos elementos) mediante un proceso llamado electrólisis. En la electrólisis, la electricidad proporciona la energía necesaria para separar un compuesto en sus elementos constitutivos (Figura \(\PageIndex{5}\)). Una técnica similar se utiliza a gran escala para obtener aluminio puro, un elemento, a partir de sus minerales, que son mezclas de compuestos. Dado que se requiere una gran cantidad de energía para la electrólisis, el coste de la electricidad es, con mucho, el mayor gasto en el que se incurre para fabricar aluminio puro. Por lo tanto, reciclar el aluminio es rentable y ecológico.
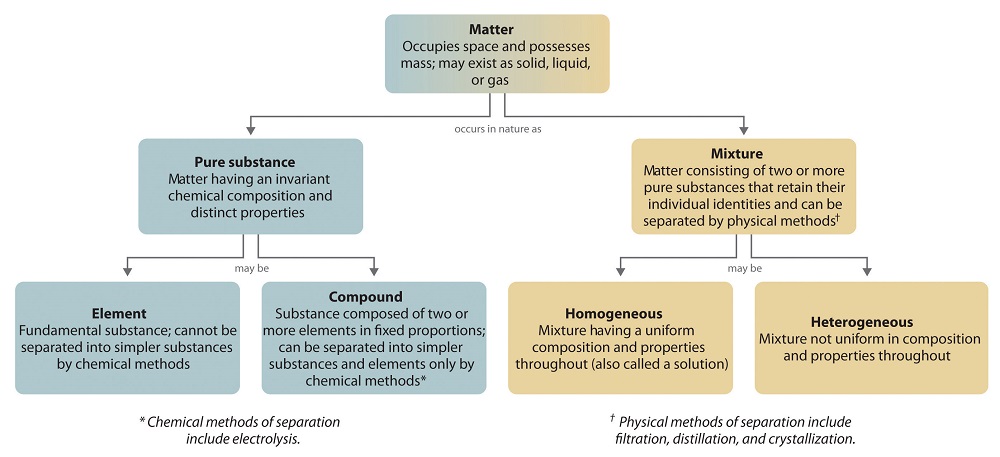
La organización general de la materia y los métodos utilizados para separar las mezclas se resumen en la Figura \(\PageIndex{6}).
Ejemplo \(\PageIndex{1})
Identifica cada sustancia como un compuesto, un elemento, una mezcla heterogénea o una mezcla homogénea (solución).
- Té filtrado
- Zumo de naranja recién exprimido
- Un disco compacto
- Oxido de aluminio, un polvo blanco que contiene un 2:3 de átomos de aluminio y oxígeno
- selenio
- Decide si una sustancia es químicamente pura. Si es pura, la sustancia es un elemento o un compuesto. Si una sustancia puede separarse en sus elementos, es un compuesto.
- Si una sustancia no es químicamente pura, es una mezcla heterogénea o una mezcla homogénea. Si su composición es uniforme en toda su extensión, es una mezcla homogénea.
- Un Té es una solución de compuestos en agua, por lo que no es químicamente puro. Se suele separar de las hojas de té por filtración. B Debido a que la composición de la solución es uniforme en toda su extensión, es una mezcla homogénea.
- A El zumo de naranja contiene partículas de sólido (pulpa) además de líquido; no es químicamente puro. B Debido a que su composición no es uniforme en toda su extensión, el zumo de naranja es una mezcla heterogénea.
- Un disco compacto es un material sólido que contiene más de un elemento, con regiones de diferentes composiciones visibles a lo largo de su borde. Por lo tanto, un disco compacto no es químicamente puro. B Las regiones de diferente composición indican que un disco compacto es una mezcla heterogénea.
- A El óxido de aluminio es un compuesto único y químicamente puro.
- A El selenio es uno de los elementos conocidos.
Dado: una sustancia química
Preguntado: su clasificación
Estrategia:
Solución
Ejercicio \N(\PageIndex{1})
Identificar cada sustancia como un compuesto, un elemento, una mezcla heterogénea, o una mezcla homogénea (solución).
- vino blanco
- mercurio
- rancho-estilo de ensalada
- azúcar de mesa (sacarosa)
Respuesta A
solución
Respuesta B
elemento
Respuesta C
mezcla heterogénea
Respuesta D
compuesto
.
0 comentarios