John J. Chen, MD, PhD ; Ryan M. Tarantola, MD ; Christine N. Kay, MD ; Vinit B. Mahajan, MD, PhD
Mise à jour par Jason P. Kam, MD,
publié initialement : 30 août 2011
mise à jour : 14 septembre 2016
Déclaration principale : Des lumières tourbillonnantes et clignotantes
Histoire de la maladie actuelle
Une femme de 57 ans s’est présentée à la clinique d’ophtalmologie du CHUI en se plaignant de photopsies centrales bilatérales depuis deux ans. Elle souffrait du syndrome de Sjögren et d’arthrite inflammatoire et était actuellement traitée par prednisone et méthotrexate. Elle était auparavant traitée par hydroxychloroquine (Plaquenil) 200mg bid (6,5mg/kg) pendant 10 ans, qui a été arrêté un an avant la présentation.
Histoire oculaire antérieure : Aucun
Histoire médicale : Syndrome de Sjögren et arthrite inflammatoire, tachycardie supraventriculaire, anxiété, dépression, ulcère gastroduodénal
Médicaments : prednisone, méthotrexate, amitriptyline, ranitidine, estradiol, tizanidine, diltiazem, Restasis
Allergies : codéine, dropéridol
Antécédents familiaux : maladie cardiaque, arthrite, cancer
Antécédents sociaux : alcool occasionnel mais pas de consommation de tabac ou de drogues intraveineuses.
Examen des systèmes :
Vision trouble, halos, sécheresse oculaire, sécheresse buccale, reflux gastro-œsophagien, douleurs articulaires
EXAMEN OCULAIRE
Acuité visuelle
- Oeil droit (OD) : 20/30
- Oeil gauche (OS) : 20/25
Pupilles : Réactives à la lumière dans chaque œil de 5 mm dans l’obscurité à 2 mm dans la lumière. Pas de défaut pupillaire afférent relatif (DPA).
Mouvements extra-oculaires : Complets, aux deux yeux (OU)
Champs visuels de confrontation : Complets OU
Pression intra-oculaire
- D : 15 mmHg
- OS : 15 mmHg
Externe
Examen à la lampe à fente
- Peau/cils : normal
- Conjonctiva/Sclérotique : normal
- Cornée : claire, pas de verticillata
- Chambre antérieure : profonde et calme
- Iris : normal
- Lentille : 1+ NS
- Vitréen : normal
Examen du fond d’œil dilaté
Les nerfs optiques sont apparus sains avec un rapport cupule/disque de 0.3 par rapport au disque. Il y avait une légère dépigmentation paracentrale de l’EPR dans la macula qui épargnait la fovéa centrale OU. Les vaisseaux et l’examen périphérique étaient normaux OU (Figure 1). Il n’y avait pas de décollement postérieur du vitré, de déchirure rétinienne ou de décollement de la rétine.
Tests auxiliaires
Figure 1 : Les photos du fond d’œil montrent une légère dépigmentation paracentrale de l’EPR qui épargne la fovéa centrale dans les yeux droit (A) et gauche (B). L’angiographie à la fluorescéine montre une hyperfluorescence parafovéale OU (C et D).
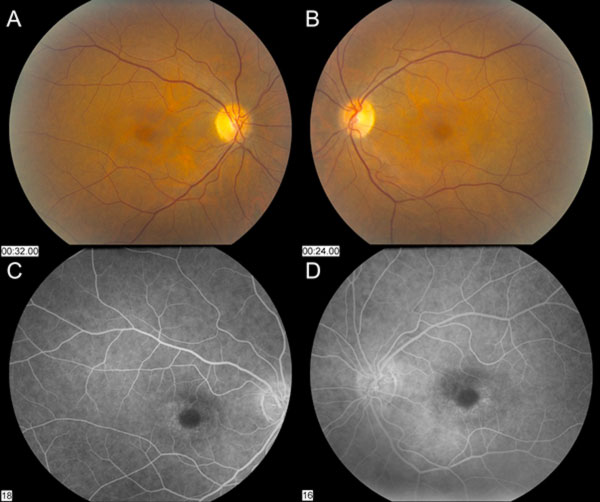
Diagnostic : Toxicité rétinienne induite par l’hydroxychloroquine
La chloroquine (CQ) et l’hydroxychloroquine (Plaquenil) (HCQ) sont utilisées depuis de nombreuses années, initialement pour le traitement du paludisme, mais maintenant plus couramment pour le traitement de maladies inflammatoires telles que la polyarthrite rhumatoïde et le lupus . On envisage maintenant de nouvelles applications dans le domaine du diabète, des maladies cardiaques et des traitements adjuvants du cancer .
La chloroquine et l’hydroxychloroquine appartiennent toutes deux à la famille des quinolones et partagent des indications cliniques et des effets secondaires similaires, notamment la toxicité rétinienne. La toxicité rétinienne induite par la chloroquine a été décrite pour la première fois en 1959 et les effets toxiques rétiniens de l’hydroxychloroquine ont ensuite été décrits en 1967 . L’hydroxychloroquine présente une toxicité rétinienne nettement moindre et a largement remplacé la chloroquine dans le traitement des maladies inflammatoires. Malheureusement, les dommages rétiniens causés par ces médicaments sont largement irréversibles, il est donc essentiel de détecter la toxicité rétinienne à un stade précoce dans l’espoir de limiter l’étendue de la perte visuelle.
Signes/Symptômes
Les manifestations oculaires de l’hydroxychloroquine comprennent la verticillade cornéenne et la toxicité rétinienne. Les verticillats sont des dépôts cornéens de sels au sein de l’épithélium cornéen. Cette affection ne provoque pas de symptômes et est réversible avec l’arrêt du médicament. La découverte de verticilles cornéens n’a aucune corrélation avec la toxicité rétinienne et ne constitue pas une indication de l’arrêt du médicament. Le signe distinctif de la toxicité de l’hydroxychloroquine est la rétinopathie pigmentaire bilatérale. Les patients présentant des résultats rétiniens précoces sont souvent asymptomatiques malgré la présence de scotomes paracentraux subtils. Plus tard dans la maladie, les patients peuvent développer une maculopathie bilatérale en œil de bœuf, caractérisée par un anneau de dépigmentation de l’épithélium pigmentaire de la rétine (EPR) dans la macula, épargnant la fovéa, qui est souvent accompagnée de scotomes paracentraux et centraux. La toxicité de l’hydroxychloroquine au stade terminal entraîne une atrophie étendue de l’EPR et de la rétine avec une perte de la vision centrale, de la vision périphérique et de la vision nocturne. Des études récentes ont montré que les patients d’origine asiatique développent des dommages initiaux dans une distribution extramaculaire plus périphérique près des arcades, le plus souvent dans la région inférotemporale avec des défauts de champ superonasal correspondants. Les patients afro-américains et hispaniques présentent un schéma principalement paravovéal similaire à celui des sujets européens .
Les modifications du fond d’œil à la biomicroscopie, y compris la maculopathie en œil de bœuf, sont révélatrices d’une toxicité rétinienne assez avancée induite par l’hydroxychloroquine, qui est largement irréversible malgré l’arrêt du médicament. Une détérioration continue de la fonction visuelle peut survenir après l’arrêt de l’hydroxychloroquine, probablement en raison de la lenteur de la clairance rétinienne et systémique. Le dépistage est important pour détecter une toxicité rétinienne précoce avant des changements funduscopiques notables afin de limiter l’ampleur de la perte visuelle. La vision centrale peut être préservée si les dommages sont reconnus avant qu’il y ait des changements dans l’épithélium pigmentaire de la rétine (EPR).
Mécanisme
Le mécanisme du CQ et du HCQ est mal compris. Les molécules se lient à la mélanine de l’EPR, provoquant des changements métaboliques et des effets toxiques. Les dépôts affectent la rétine externe, la couche des photorécepteurs et l’EPR, mais préservent la rétine interne.
Prévalence
Bien que la toxicité rétinienne de l’hydroxychloroquine soit considérée comme rare, des études récentes suggèrent qu’elle pourrait avoir une prévalence plus élevée que celle reconnue auparavant. Une vaste étude portant sur des patients ayant utilisé l’HCQ pendant plus de 5 ans a été évaluée avec des champs visuels 10-2 ou une tomographie par cohérence optique à domaine spectral (SD OCT). La prévalence globale de la toxicité dans ce groupe était de 7,5 % avec une grande variation dans la dose quotidienne et la durée d’utilisation. Au-delà de ce point, le risque augmente fortement pour atteindre 20 % après 20 ans . Le risque est plus faible avec une dose plus faible cependant il n’y a pas de véritable dose sûre pour une durée d’utilisation plus longue.
Une autre étude portant sur 4000 patients a trouvé une prévalence de 6,8/1000 patients . Les facteurs de risque qui augmentent le risque de rétinopathie due à l’hydroxychloroquine comprennent la dose quotidienne, la dose cumulative, les maladies rénales ou hépatiques, l’âge et les maladies rétiniennes antérieures . Une dose quotidienne de >6,5mg/kg (poids corporel idéal) expose les patients à un risque plus élevé, mais une dose quotidienne inférieure à ce niveau n’a pas empêché le patient de développer une toxicité après plusieurs années de traitement. Une dose cumulée de >1000g d’hydroxychloroquine ou 460g de chloroquine était probablement le facteur de risque le plus important, qui était généralement atteint après 5 à 7 ans d’un dosage typique . Cependant, des rapports de cas de patients présentant une toxicité de l’hydroxychloroquine dès 1,9 mois après le début du traitement ont été rapportés .
| Dose quotidienne |
H HCQ |
>5.0 mg/kg de poids réel |
CQ |
>2.3 mg/kg de poids réel |
Durée d’utilisation |
>5 ans ; aucun autre facteur de risque |
|
Maladie rénale |
Diminution du débit de filtration glomérulaire (DFG) |
Médicaments concomitants |
Utilisation du tamoxifène |
|
Maladie maculaire |
Sensibilité accrue à la toxicité |
Age |
Aucune association significative entre l’âge et le risque de toxicité |
|
Maladie du foie |
Aucune association claire entre la maladie du foie et la toxicité |
|
Génétique |
Pas d’association claire entre les facteurs génétiques et la toxicité |
Le risque le plus critique de toxicité est une dose quotidienne excessive en fonction du poids . La dose >5,0mg/kg augmente le risque de toxicité. La durée d’utilisation est également un facteur de risque critique. Les recommandations précédentes de 2011 notaient que la dose cumulée (dose quotidienne x durée en années) était un indicateur de risque, cependant l’évaluation la plus précise se fait sur la base de la durée d’utilisation par rapport à la dose quotidienne par poids réel comme le montre la figure ci-dessous. Un autre changement par rapport aux recommandations de 2011 était que le poids réel était meilleur que le poids idéal pour calculer la dose et qu’un risque plus faible était obtenu avec des doses de 5 mg/kg de poids réel .
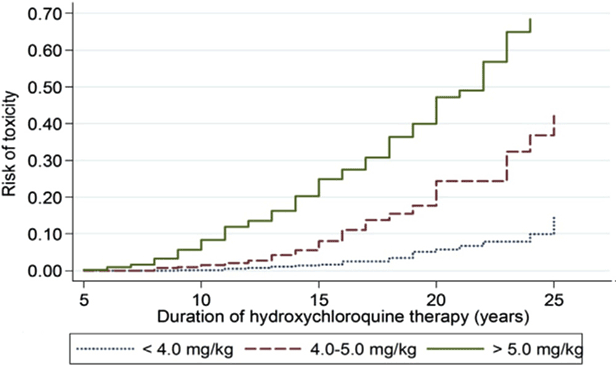
Figure 6 : Il s’agit d’une courbe de Kaplan Meier montrant le risque cumulatif de rétinopathie au fil du temps, avec différents niveaux d’utilisation de l’hydroxychloroquine (HCQ). Lorsque l’utilisation se situe entre 4,0 et 5,0 mg/kg, le risque est très faible pendant les 5 à 10 premières années, mais il augmente nettement par la suite. Reproduit de Melles et Marmor, 2014
L’HCQ est éliminée par les reins et donc les maladies rénales augmentent le risque de toxicité. Par conséquent, il peut être nécessaire d’adapter à la fois la posologie et la fréquence du dépistage. L’utilisation du tamoxifène (utilisé dans le traitement du cancer du sein) multiplie environ par 5 le risque de toxicité) . Le mécanisme de ce lien n’est pas compris. Les patients présentant une maladie rétinienne sous-jacente peuvent présenter un risque plus élevé de toxicité, mais aucune donnée spécifique ne l’a confirmé. Cependant, la maculopathie rend la mise en œuvre et l’interprétation du dépistage plus difficile.
Lignes directrices pour le dépistage
L’Académie américaine d’ophtalmologie (AAO) a récemment fourni des recommandations révisées pour le dépistage qui intègrent les nouvelles avancées technologiques permettant une détection plus précoce de la maladie en 2016.
|
Timeline |
Tests auxiliaires |
|
|---|---|---|
|
Dépistage de base |
Au cours de la première année d’utilisation |
Champs visuels et SD-OCT en cas de maculopathie |
|
Dépistage annuel |
Début après 5 ans d’utilisation mais plus tôt en cas de présence de facteurs de risque majeurs |
Les deux HVF 10-2 et SD-OCT ; tests facultatifs (selon les besoins) : mfERG et/ou FAF |
Examen de base : Tous les patients doivent subir un examen ophtalmologique de base au cours de la première année d’initiation du traitement par HCQ ou CQ avec une évaluation approfondie des facteurs de risque et un examen du fond d’œil de la macula pour exclure une maladie sous-jacente. Un champ visuel de base et un SD OCT sont recommandés si des anomalies sont présentes (par exemple, des lésions maculaires, un glaucome, etc.) qui pourraient affecter les tests de dépistage.
Dépistage annuel : Le risque de toxicité est rare au cours des premières années de traitement par HCQ et CQ. En l’absence de facteurs de risque majeurs, le dépistage peut être reporté de 5 ans. La toxicité se développe lentement et un examen annuel après la 5e année est suffisant. Un dépistage plus précoce est recommandé pour les patients présentant l’un des facteurs de risque mentionnés précédemment. Les examens de dépistage annuels comprennent une biomicroscopie, un champ visuel automatisé 10-2 et une tomographie par cohérence optique à domaine spectral (SD-OCT) avec, en option, une autofluorescence du fond d’œil (FAF) et/ou un électrorétinogramme multifocal (mfERG) si nécessaire.
Le champ visuel Humphrey 10-2 est sensible pour détecter les défauts subtils du champ visuel paracentral et est recommandé lors de toutes les visites de dépistage. Le test SITA avec des tracés de déviation des motifs est recommandé. Des mires plus larges 24-2 ou 30-2 sont nécessaires pour les patients asiatiques en raison de la possibilité de manifestations extra-maculaires de la toxicité. Les mires larges ne testent que 4 points au centre. Il n’a pas été mentionné de tester à la fois les mires 10-2 et les mires larges dans les directives de l’AAO pour les patients asiatiques.
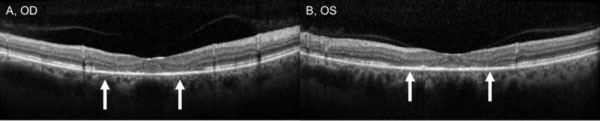
SD-OCT : Contrairement à la tomographie par cohérence optique à domaine temporel, la SD-OCT a la résolution nécessaire pour détecter un amincissement localisé de la rétine dans la région parafovéale. Sur la SD-OCT, la perte ou l’amincissement de la couche des photorécepteurs parafovéale et périfovéale et la perturbation focale des laminations du segment externe sont compatibles avec la toxicité . Ces changements sur le SD-OCT peuvent être observés avant que des anomalies funduscopiques ne soient présentes. Des scans à angle plus large ou des scans à travers les arcades vasculaires sont importants pour les yeux asiatiques .
Tests supplémentaires utiles
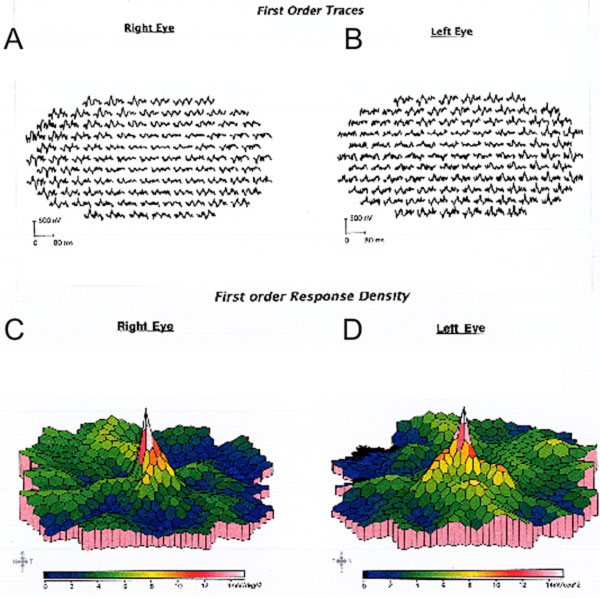
Electrorétinogramme multifocal (mf-ERG) : Ce test permet de détecter une dépression parafovéale ou extramaculaire localisée dans la rétinopathie précoce . Il présente une sensibilité similaire à celle des champs visuels et peut fournir une confirmation objective d’une perte de champ paracentral suspectée.
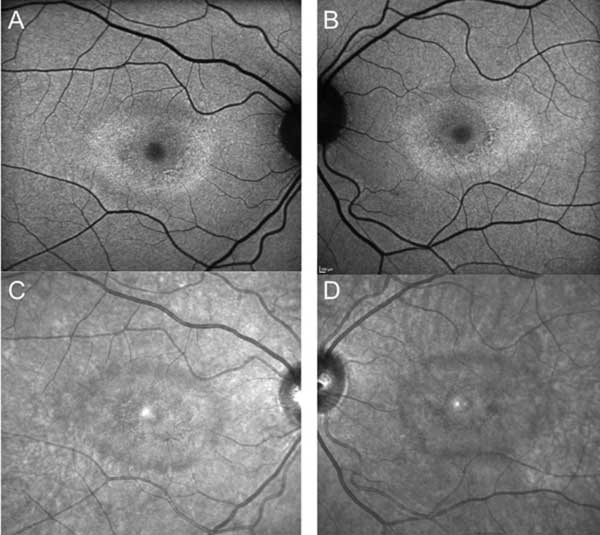
Autofluorescence du fond d’œil (FAF) : La toxicité précoce de l’hydroxychloroquine peut également être détectée sur l’autofluorescence comme un anneau de signal accru dans les régions parafovéales et extramaculaires, ce qui indique un dysfonctionnement des photorécepteurs et de l’EPR. Une maladie plus avancée entraînera une perte d’autofluorescence au sein de ces régions en raison de la perte des photorécepteurs et de l’EPR, souvent avec une hyperfluorescence environnante .
Tests non recommandés : Les lignes directrices récentes déconseillent la biomicroscopie seule, la photographie du fond d’œil, la tomographie par cohérence optique à domaine temporel, l’angiographie à la fluorescéine, l’électrorétinogramme plein champ, la grille d’Amsler, le test de vision des couleurs et l’électro-oculogramme . On pense que tous ces tests ont une sensibilité insuffisante pour détecter la toxicité de l’HCQ/CQ à un stade suffisamment précoce pour prévenir une perte de vision significative.
En résumé, la toxicité rétinienne induite par l’hydroxychloroquine est probablement plus répandue qu’on ne le pensait auparavant. Autrefois considérée comme sûre à une dose quotidienne de < 6,5mg/kg/jour , des études plus récentes montrent que de nombreuses années de traitement à l’hydroxychloroquine à une « dose sûre » peuvent encore entraîner une toxicité . Des directives plus récentes indiquent que la dose quotidienne >5mg/kg de poids réel/jour peut entraîner une toxicité. La toxicité rétinienne est irréversible et peut progresser après l’arrêt de l’hydroxychloroquine, c’est pourquoi un dépistage précoce est important pour limiter la perte potentielle de vision. Un dépistage de base et un dépistage annuel après cinq ans sont recommandés. Les modalités de test auxiliaires, telles que le SD-OCT, le mfERG et l’autofluorescence, constituent des outils de dépistage sensibles qui complètent l’HVF 10-2 dans la détection de la toxicité précoce de l’hydroxychloroquine.
Historique clinique complète et évolution
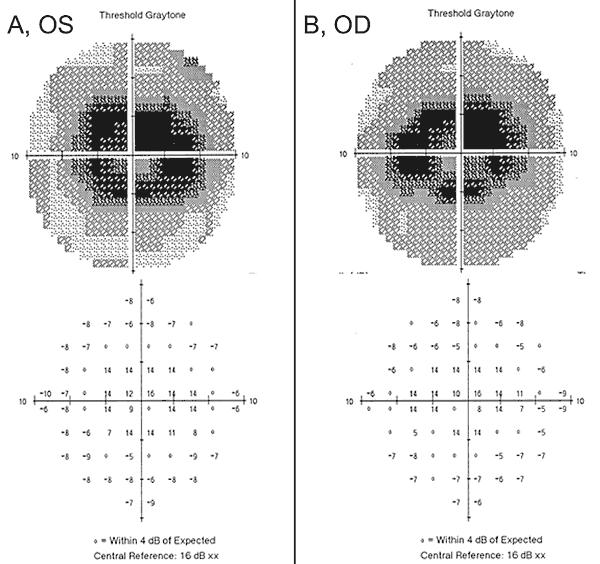
Notre patient met en évidence certaines des nouvelles découvertes en matière de toxicité rétinienne à l’hydroxychloroquine, notamment l’importance d’un dépistage précoce avec les outils appropriés décrits ci-dessus, le manque de sensibilité de certains des tests obsolètes et le risque d’aggravation malgré l’arrêt du médicament incriminé. Lorsque notre patiente s’est présentée pour la première fois avec des halos et une lumière tourbillonnante chez un prestataire extérieur, elle avait une acuité visuelle normale et aucun défaut sur la grille d’Amsler, le test de vision des couleurs ou l’examen du fond d’œil dilaté. De plus, son HVF 24-2 de l’année précédente montrait des changements paracentraux non spécifiques et était considéré comme complet. Un an plus tard, un HVF 10-2 a été obtenu et a montré des scotomes paracentraux denses bilatéralement (Figure 2), malgré une acuité visuelle, une grille d’Amsler et des tests de vision en couleur normaux. Dès la détection des anomalies du champ visuel, l’hydroxychloroquine a été arrêtée. Elle prenait de l’hydroxychloroquine > 5,0 mg/kg/jour depuis 10 ans avec une dose cumulée de 1460g la mettant à un risque accru de toxicité rétinienne de l’hydroxychloroquine.
Malgré l’arrêt de l’hydroxychloroquine, le suivi d’un an a révélé une légère aggravation de l’acuité visuelle à 20/30 OD et 20/25 OS, avec de nouvelles anomalies sur la grille d’Amsler et des déficits sur le test de vision des couleurs. Une dépigmentation subtile de l’EPR parafovéal a pu être observée à la biomicroscopie, qui a été mise en évidence par une hyperfluorescence à l’angiographie à la fluorescéine (Figure 1). La répétition du test HVF 10-2 a démontré la présence de scotomes paracentraux denses. La SD-OCT a montré une perte de la jonction segment interne/segment externe parafovéal, un amincissement de la couche nucléaire externe parafovéale et une perte de la dépression fovéale normale, ce qui est caractéristique de la toxicité rétinienne de l’hydroxychloroquine (Figure 3). L’imagerie d’autofluorescence a montré un anneau d’hyper-autofluorescence dans la région parafovéale correspondant à des dommages aux photorécepteurs et à un dysfonctionnement de l’EPR (Figure 4). Le MfERG a montré une diminution du signal au centre des deux yeux (Figure 5). Notre patient démontre l’importance d’utiliser les nouveaux outils de dépistage recommandés pour la détection de la toxicité précoce de l’hydroxychloroquine. L’HVF 10-2, la SD-OCT, l’autofluorescence ou le mfERG auraient pu détecter la toxicité rétinienne de l’hydroxychloroquine le jour où elle a présenté ses symptômes, voire plus tôt, ce qui aurait pu limiter l’importance de la perte visuelle.
Diagnostic différentiel
- Dégénérescence maculaire liée à l’âge
- Dystrophie choroïdienne aréolaire centrale
- Maladie de Stargardt
- Dystrophie du cône-.rod dystrophie
- Dystrophie annulaire concentrique bénigne
DÉPISTAGE RECOMMANDÉ
Dépistage annuel précoce pour les patients qui présentent des facteurs de risque de développer une toxicité de l’hydroxychloroquine. |
SIGNES
Facteurs de risque :
|
SYMPTÔMES
|
Traitement
|
- Tehrani R, Ostrowski RA, Hariman R, Jay WM : toxicité oculaire de l’hydroxychloroquine. Semin Ophthalmol 2008, 23(3):201-209.
- Marmor MF, Kellner U, Lai TY, Lyons JS, Melles RB, Mieler WF : Recommandations sur le dépistage de la rétinopathie due à la chloroquine et à l’hydroxychloroquine (révision 2016). Ophtalmology 2016, 123:1386-1394.
- Hobbs HE, Sorsby A, Freedman A : Retinopathy following chloroquine therapy. Lancet 1959, 2(7101):478-480.
- Shearer RV, Dubois EL : Changements oculaires induits par une thérapie à long terme à l’hydroxychloroquine (plaquenil). Am J Ophthalmol 1967, 64(2):245-252.
- Gass JDM : Atlas stéréoscopique des maladies maculaires : diagnostic et traitement, 4e éd. St. Louis : Mosby ; 1997.
- Melles RB, Marmor MF. Rétinopathie péricentrale et différences raciales dans la toxicité de l’hydroxychloroquine. Ophtalmology 2015;122:110-6.
- Melles RB, Marmor MF. Le risque de rétinopathie toxique chez les patients sous traitement à long terme par l’hydroxychloroquine. JAMA Ophthalmol 2014;132:1453-60.
- Wolfe F, Marmor MF : Taux et prédicteurs de la toxicité rétinienne de l’hydroxychloroquine chez les patients atteints de polyarthrite rhumatoïde et de lupus érythémateux systémique. Arthritis Care Res (Hoboken) 2010, 62(6):775-784.
- Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF : Recommandations révisées sur le dépistage de la rétinopathie due à la chloroquine et à l’hydroxychloroquine. Ophthalmology 2011, 118(2):415-422.
- Lyons JS, Severns ML : Détection de la toxicité rétinienne précoce de l’hydroxychloroquine améliorée par l’analyse du rapport d’anneau de l’électrorétinographie multifocale. Am J Ophthalmol 2007, 143(5):801-809.
- Yam JC, Kwok AK : Toxicité oculaire de l’hydroxychloroquine. Hong Kong Med J 2006, 12(4):294-304.
- Michaelides M, Stover NB, Francis PJ, Weleber RG : Toxicité rétinienne associée à l’hydroxychloroquine et à la chloroquine : facteurs de risque, dépistage et progression malgré l’arrêt du traitement. Arch Ophthalmol 2011, 129(1):30-39.
- Chen E, Brown DM, Benz MS, Fish RH, Wong TP, Kim RY, Major JC : Spectral domain optical coherence tomography as an effective screening test for hydroxychloroquine retinopathy (the « flying saucer » sign). Clin Ophthalmol 2010, 4:1151-1158.
- Kellner U, Renner AB, Tillack H : Autofluorescence du fond d’œil et mfERG pour la détection précoce des altérations rétiniennes chez les patients utilisant la chloroquine/hydroxychloroquine. Invest Ophthalmol Vis Sci 2006, 47(8):3531-3538.
- Lai TY, Chan WM, Li H, Lai RY, Lam DS : Multifocal electroretinographic changes in patients receiving hydroxychloroquine therapy. Am J Ophthalmol 2005, 140(5):794-807.
- Bernstein HN : Sécurité oculaire de l’hydroxychloroquine. Ann Ophthalmol 1991, 23(8):292-296.
Format de citation suggéré:
Kam JP. Révision de EyeRounds.org. 14 septembre 2016 ; Disponible sur : http://EyeRounds.org/cases/139-plaquenil-toxicity.htm.
0 commentaire