Descrição
Solução Oftalmológica de Tartarato de Brimonidina 0,2% é um agonista alfa-2 adrenérgico relativamente selectivo para uso oftalmológico. Em solução, a solução de tartarato de brimonidina oftálmica 0,2% tem uma cor clara, amarelo-esverdeada. Tem uma osmolalidade de 280-330 mOsml/kg e um pH de 5,6-6,6 A fórmula estrutural é
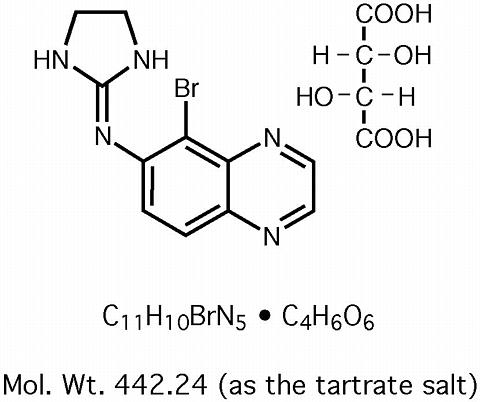
>br>>
Nome químico: 5-bromo-6-(2-imidazolidinilideneamino) quinoxalina L-tartarato.
CAS Número 59803-98-4
Cada mL Contém:
p>ACTIVO: Tartarato de Brimonidina: 0,2% (2 mg/mL).
INACTIVOS: Ácido Cítrico, Álcool Polivinílico, Cloreto de Sódio, Citrato de Sódio, Água Purificada. Ácido Clorídrico e/ou Hidróxido de Sódio podem ser adicionados para ajustar o pH.
PRESERVATIVO ADICIONADO: Cloreto de Benzalcónio (0,05 mg).
Farmacologia Clínica
Mecanismo de Acção: Solução oftálmica de tartarato de brimonidina 0,2% é um agonista receptor adrenérgico alfa. Tem um efeito hipotensivo ocular de pico que ocorre às duas horas pós-doseamento. Estudos fluorofotométricos em animais e humanos sugerem que o tartarato de brimonidina tem um duplo mecanismo de acção, reduzindo a produção de humor aquoso e aumentando a saída uveoscleral.
Farmacocinética: Após a administração ocular de uma solução a 0,2%, as concentrações de plasma atingiram o seu pico em 1 a 4 horas e diminuíram com uma semi-vida sistémica de aproximadamente 3 horas. Nos humanos, o metabolismo sistémico da brimonidina é extenso. É metabolizado principalmente pelo fígado. A excreção urinária é a principal via de eliminação da droga e dos seus metabólitos. Aproximadamente 87% de uma dose radioactiva administrada oralmente foi eliminada em 120 horas, com 74% encontrados na urina.
Avaliações Clínicas: A PIO elevada apresenta um factor de risco importante na perda de campos glaucomatosos. Quanto maior for o nível de PIO, maior a probabilidade de dano do nervo óptico e perda do campo visual. O tartarato de brimonidina tem a acção de baixar a pressão intra-ocular com efeito mínimo nos parâmetros cardiovasculares e pulmonares.
Em estudos clínicos comparativos com timololol 0,5%, com duração até um ano, o efeito de baixar a PIO da solução oftálmica de tartarato de brimonidina 0,2% foi de aproximadamente 4-6 mmHg em comparação com aproximadamente 6 mmHg para o timolol. Nestes estudos, ambos os grupos de doentes foram doseados BID; contudo, devido à duração da acção da solução oftálmica de tartarato de brimonidina 0,2%, recomenda-se que a solução oftálmica de tartarato de brimonidina 0,2% seja doseada TID. Oito por cento dos sujeitos foram descontinuados dos estudos devido a uma pressão intra-ocular insuficientemente controlada, que em 30% destes doentes ocorreu durante o primeiro mês de terapia. Cerca de 20% foram descontinuados devido a experiências adversas.
Indicações e Utilização
Solução oftálmica de tartarato de brimonidina 0,2% é indicada para baixar a pressão intra-ocular em pacientes com glaucoma de ângulo aberto ou hipertensão ocular. A eficácia de redução da PIO da solução oftálmica de tartarato de brimonidina 0,2% diminui com o tempo em alguns doentes. Esta perda de efeito aparece com um tempo de início variável em cada paciente e deve ser acompanhada de perto.
Contraindicações
Solução oftálmica de tartarato de brimonidina 0,2% está contra-indicada em pacientes com hipersensibilidade ao tartarato de brimonidina ou a qualquer componente deste medicamento. Também está contra-indicado em pacientes que recebem terapia inibidora da monoamina oxidase (MAO).
Precauções:
Geral: Embora a solução oftálmica de tartarato de brimonidina 0,2% tenha tido um efeito mínimo na tensão arterial de pacientes em estudos clínicos, deve-se ter cuidado no tratamento de pacientes com doenças cardiovasculares graves.
Solução oftálmica de tartarato de brimonidina 0,2% não foi estudada em pacientes com insuficiência hepática ou renal; deve-se ter cuidado no tratamento de tais pacientes.
Solução oftálmica de tartarato de brimonidina 0,2% deve ser utilizada com precaução em doentes com depressão, insuficiência cerebral ou coronária, fenómeno de Raynaud, hipotensão ortostática ou tromboangite obliterante.
Durante os estudos houve uma perda de efeito em alguns doentes. A eficácia de redução da PIO observada com solução oftálmica de tartarato de brimonidina 0,2% durante o primeiro mês de terapia pode nem sempre reflectir o nível de redução da PIO a longo prazo. Os pacientes que prescrevem medicação que reduz a PIO devem ser rotineiramente monitorizados para PIO.
Informação para os pacientes: O conservante em solução oftálmica de tartarato de brimonidina 0,2%, cloreto de benzalcónio, pode ser absorvido por lentes de contacto macias. Os pacientes que usam lentes de contacto gelatinosas devem ser instruídos a aguardar pelo menos 15 minutos depois de instilar solução oftálmica de tartarato de brimonidina 0,2% para inserir lentes de contacto gelatinosas.
Como com outros medicamentos desta classe, a solução oftálmica de tartarato de brimonidina 0,2% pode causar fadiga e/ou sonolência em alguns pacientes. Os pacientes que se dedicam a actividades perigosas devem ser advertidos do potencial para uma diminuição do estado de alerta mental.
Interacções com Drogas: Embora não tenham sido realizados estudos específicos de interacção medicamentosa com solução oftálmica de tartarato de brimonidina 0,2%, deve ser considerada a possibilidade de um efeito aditivo ou potenciador com depressores do SNC (álcool, barbitúricos, opiáceos, sedativos, ou anestésicos). Os alfa-agonistas, como classe, podem reduzir o pulso e a pressão sanguínea. Aconselha-se cautela na utilização de medicamentos concomitantes, tais como beta-bloqueadores (oftálmicos e sistémicos), anti-hipertensivos e/ou glicosídeos cardíacos.
Antidepressivos tricíclicos foram relatados para atenuar o efeito hipotensivo da clonidina sistémica. Não se sabe se a utilização simultânea destes agentes com solução oftálmica de tartarato de brimonidina 0,2% em humanos pode levar à interferência resultante com o efeito de redução da PIO. Não existem dados sobre o nível de catecolaminas circulantes após a solução oftálmica de tartarato de brimonidina 0,2%. No entanto, aconselha-se cautela nos doentes que tomam antidepressivos tricíclicos que podem afectar o metabolismo e a absorção de aminas circulantes.
Carcinogénese, mutagénese, diminuição da fertilidade: Não foram observados efeitos carcinogénicos relacionados com compostos em ratos ou ratos após um estudo de 21 meses e 24 meses, respectivamente. Nestes estudos, a administração dietética de tartarato de brimonidina em doses até 2,5 mg/kg/dia em ratos e 1,0 mg/kg/dia em ratos atingiu ~77 e 118 vezes, respectivamente, a concentração de fármacos plasmáticos estimada em humanos tratados com uma gota de solução oftálmica de tartarato de brimonidina 0,2% em ambos os olhos 3 vezes por dia.
Tartarato de brimonidina não foi mutagénico ou citogénico numa série de estudos in vitro e in vivo, incluindo o teste Ames, ensaio de aberração cromossómica em células do ovário de Hamster chinês (CHO), um ensaio de hospedeiro-mediado e estudos citogénicos em ratos, e ensaio letal dominante.
Estudos reprodutivos realizados em ratos com doses orais de 0,66 mg base/kg não revelaram indícios de danos para o feto devido à solução oftálmica de tartarato de brimonidina 0,2%.
Gravidez: Efeitos teratogénicos: Gravidez Categoria B.
Estudos reprodutivos realizados em ratos com doses orais de 0,66 mg base/kg não revelaram indícios de danos para o feto devido à solução oftálmica de tartarato de brimonidina 0,2%. A dosagem a este nível produziu 100 vezes o nível de concentração de fármacos plasmáticos observado em humanos após múltiplas doses oftálmicas.
Não há estudos adequados e bem controlados em mulheres grávidas. Em estudos com animais, a brominidina atravessou a placenta e entrou na circulação fetal de forma limitada. A solução oftálmica de tartarato de brimonidina 0,2% só deve ser utilizada durante a gravidez se o benefício potencial para a mãe justificar o risco potencial para o feto.
Nursing Mothers: Não se sabe se esta droga é excretada no leite humano; em estudos animais, o tartarato de brimonidina foi excretado no leite materno. Deve ser tomada a decisão de interromper a amamentação ou não, tendo em conta a importância do medicamento para a mãe.
Uso pediátrico: Num estudo clínico bem controlado realizado em pacientes com glaucoma pediátrico (idades entre 2 a 7 anos) os eventos adversos mais frequentemente observados com solução oftálmica de tartarato de brimonidina 0,2% dosados três vezes ao dia foram sonolência (50% – 83% em pacientes com idades entre 2 a 6 anos) e diminuição do estado de alerta. Em pacientes pediátricos com 7 anos de idade ou mais (>20kg), a sonolência parece ocorrer com menos frequência (25%). O acontecimento adverso mais frequentemente observado foi a sonolência. Aproximadamente 16% dos pacientes em solução oftálmica de tartarato de brimonidina interromperam o estudo devido à sonolência.
A segurança e eficácia da solução oftálmica de tartarato de brimonidina 0,2% não foram estudados em pacientes pediátricos com idade inferior a 2 anos. A solução oftálmica de tartarato de brimonidina 0,2% não é recomendada para utilização em doentes pediátricos com menos de 2 anos de idade. (Consultar também a secção Reacções adversas).
Utilização geriátrica: Não foram observadas diferenças globais de segurança ou eficácia entre pacientes idosos e outros pacientes adultos.
Reacções Adversas: Os eventos adversos que ocorreram em aproximadamente 10-30% dos sujeitos, por ordem decrescente de incidência, incluíram secura oral, hiperemia ocular, ardor e picada, dor de cabeça, desfocagem, sensação de corpo estranho, fadiga/ sonolência, folículos conjuntivos, reacções alérgicas oculares, e prurido ocular.
Eventos que ocorrem em aproximadamente 3-9% dos indivíduos, em ordem decrescente incluíram coloração/erosão das córneas, fotofobia, eritemia das pálpebras, dores oculares/dores, secura ocular, lacrimejamento, sintomas respiratórios superiores, edema das pálpebras, edema conjuntival, tonturas, blefarite, irritação ocular, sintomas gastrointestinais, astenia, branqueamento conjuntival, visão anormal e dor muscular.
As seguintes reacções adversas foram relatadas em menos de 3% dos pacientes: crosta da tampa, hemorragia conjuntival, sabor anormal, insónia, descarga conjuntival, depressão, hipertensão, ansiedade, palpitações/arritmias, secura nasal e síncope.
Os seguintes eventos foram identificados durante o uso pós-comercialização de solução oftálmica de tartarato de brimonidina 0,2% na prática clínica. Uma vez que são relatados voluntariamente a partir de uma população de tamanho desconhecido, não podem ser feitas estimativas e frequência. Os eventos, que foram escolhidos para inclusão devido à sua gravidade, frequência de notificação, possível ligação causal à solução oftálmica de tartarato de brimonidina 0,2%, ou uma combinação destes factores, incluem: bradicardia; hipotensão; irite; miose; reacções cutâneas (incluindo eritema, prurido palpebral, erupção cutânea, e vasodilatação); e taquicardia. Apneia, bradicardia, hipotensão, hipotermia, hipotonia, e sonolência foram relatadas em bebés que receberam solução oftálmica de tartarato de brimonidina 0,2%.
Oberdosagem:
Não há informação disponível sobre sobredosagem em humanos. O tratamento de uma overdose oral inclui terapia de suporte e sintomática; deve ser mantida uma via aérea patente.
Dose e Administração
A dose recomendada é uma gota de solução oftálmica de tartarato de brimonidina 0.2% no(s) olho(s) afectado(s) três vezes por dia, com cerca de 8 horas de intervalo.
Solução oftálmica de tartarato de brimonidina 0,2% pode ser utilizada concomitantemente com outros medicamentos oftálmicos tópicos para baixar a pressão intra-ocular. Se mais de um produto oftálmico tópico estiver a ser utilizado, os produtos devem ser administrados com pelo menos 5 minutos de intervalo.
Como é fornecido
Brimonidina Tartarato Solução Oftálmica 0,2% é fornecida estéril numa garrafa de plástico com uma ponta de gota controlada nos seguintes tamanhos:
garrafas de 5 mL – Prod. N.º 41107
10 garrafas de mL – Prod. No. 41109
15 garrafas de mL – Prod. No. 41111
Armazém: Armazenar entre 15° – 25°C (59° – 77°F).
KEEP OUT OF THE REACH OF CHILDREN.
NÃO UTILIZAR SE IMPRIMIDO “Selo de Protecção” COM AMARELO NÃO É INTACTO.
Bausch & Lomb
Pharmaceuticals, Inc.
Tampa, FL 33637
©Bausch & Lomb Incorporated
XO50280 (Dobrado) XM10082 (Plano)
REV. 2/04-02
Prod. No. 411
PRODUCT PHOTO(S):
NOTE: Estas fotos só podem ser utilizadas para identificação por forma, cor e impressão. Não representam o tamanho real ou relativo.
As amostras de produtos aqui mostradas foram fornecidas pelo fabricante. Embora tenham sido feitos todos os esforços para assegurar uma reprodução exacta, lembre-se que qualquer identificação visual deve ser considerada preliminar. Em casos de envenenamento ou suspeita de sobredosagem, a identidade do medicamento deve ser verificada através de análise química.
>div>>>br>>p>> images/pills/o05104a2.jpg>br>>br>
images/pills/o05104a2.jpg>br>>br>
0 comentários