Estrogênio e DE na pesquisa básica
Interessantemente, a administração de estrogênio diminui a função eréctil em modelos animais . Os investigadores administraram estradiol oralmente a ratos, resultando em altos níveis de estradiol e baixos níveis de testosterona. Além disso, a resposta da pressão intracavernosa (PIC) à estimulação nervosa também foi prejudicada em todos os grupos tratados, e a coloração com tricrómio demonstrou a presença de hiperplasia do tecido conjuntivo cavernoso em grupos de estudo a longo prazo . A administração oral de estradiol a coelhos resultou em altos níveis de estradiol e baixos níveis de testosterona, semelhantes aos efeitos em ratos. Além disso, a acetilcolina induziu relaxamento mediado pelo endotélio em animais normais, mas este efeito foi significativamente atenuado em grupos tratados, e a neurotransmissão nãoadrenérgica, não colinérgica mediada por NO foi reduzida nos grupos de tratamento .
Nos nossos estudos anteriores, a administração subcutânea (s.c.) de estradiol a ratos resultou em altos níveis de estradiol e baixos níveis de testosterona, diminuindo assim a função eréctil . Além disso, administrámos testosterona a ratos com deficiência elevada de testosterona induzida por estrogénio; contudo, a função eréctil não melhorou. Curiosamente, a administração de estrogénio aumenta a contracção do músculo liso no corpus cavernosum, upregulando a via de sinalização RhoA/Rho-kinase, que está envolvida na DE . Vignozzi et al. demonstraram que a DE induzida por uma dieta rica em gorduras está associada a níveis elevados de estradiol, em vez de níveis baixos de testosterona .
p>Nós também investigámos a influência do desequilíbrio estradiol-testosterona na função eréctil em ratos (Figuras 1-6; Quadro 1). Os ratos Wistar ST masculinos (11 semanas de idade, Japan SLC Inc., Hamamatsu, Japão) foram separados em cinco grupos. No grupo de baixa testosterona (Low-T) (n = 11), ratos foram injectados com goserelina (LH-RH agonista, 0,9 mg/kg, s.c.). No grupo de baixa testosterona e alto estrogénio (Low-T/High-E) (n = 11), ratos foram injectados diariamente com goserelina e estradiol (3 μg/kg/dia, s.c.) das semanas 2 a 4. No grupo de alto estrogénio (High-E) (n = 11), ratos foram injectados diariamente com estradiol das semanas 2 a 4. No grupo alto estrogénio e testosterona (High-E/High-T) (n = 11), os ratos foram injectados com estradiol e testosterona (3 mg/kg/dia, s.c.) diariamente das semanas 2 a 4. No grupo de controlo (n = 11), os ratos não foram injectados com qualquer hormona. O quadro 1 mostra as concentrações de hormonas sexuais em ratos. A injecção de Goserelin diminuiu significativamente a testosterona sérica biodisponível (controlo: 1,20 ± 0,13 ng/mL, Low-T: 0,55 ± 0,04 ng/mL, P < 0,01 versus o controlo; Low-T/High-E: 0,73 ± 0,06 ng/mL, P < 0,05 versus o controlo). A injecção de testosterona testosterona aumentou significativamente a biodisponibilidade do soro (controlo: 1,20 ± 0,13 ng/mL, E-Alto/Alto-T: 2,58 ± 0,31 ng/mL, P < 0,001 versus o controlo). A injecção de estradiol aumentou significativamente o estrogénio sérico (controlo: 102,5 ± 8,7 pg./mL, Low-T/High-E: 275,4 ± 34,4 pg./mL, P < 0.01 versus o controlo; Alto-E: 332,3 ± 17,4 pg./mL, P < 0,001 versus o controlo; Alto-E/High-T: 401,5 ± 51,6 pg./mL, P < 0,001 versus o controlo).
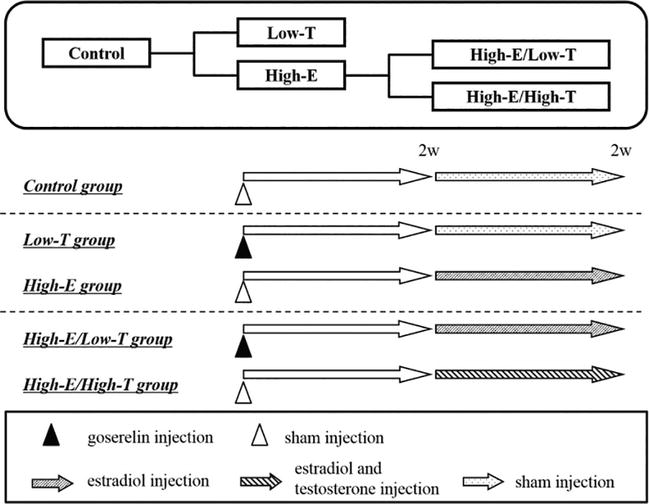
Figure 1.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceDesenho experimental. No grupo de controlo, os ratos foram injectados com veículo durante 2 semanas. Nos grupos Low-T e High-E, os ratos foram injectados com acetato de goserelina (agonista LH-RH, 0,9 mg/kg subcutâneo) no dia 0. No grupo tratado com estrogénio (High-E), os ratos foram injectados com estradiol (3 mg/kg/dia subcutâneo) durante 2 semanas. No grupo tratado com estrogénio e testosterona (High-E/High-T), os ratos foram injectados com estradiol (3 mg/kg/dia subcutâneo) e testosterona (3 mg/kg/dia subcutâneo) durante 2 semanas. No final do período, os ratos foram submetidos a testes de função eréctil in vivo ou in vitro.

Figure 2.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceMedição da pressão intracavernosa (ICP). Alterações máximas de PIC durante a estimulação eléctrica do nervo cavernoso nos grupos de controlo, Low-T, High-E, High-E/Low-T, e High-E/Highh-T. Os dados representam os meios ± erros padrão dos meios (n = 6 por grupo). **P < 0,01 versus o grupo de controlo por análise de variância e testes t múltiplos do tipo Bonferroni.
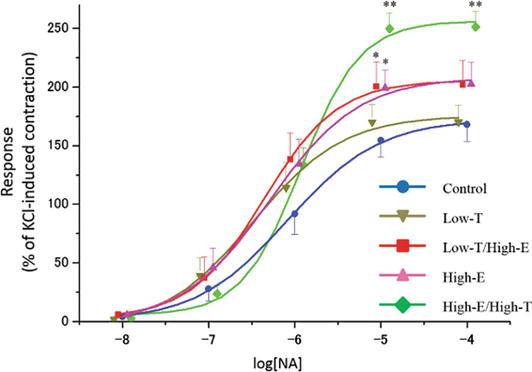
Figure 3.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAs curvas de contracção induzidas pela noradrenalina (NA) em tiras de corpus cavernosum de rato. O tom contractil induzido por 80 mM KCl foi tomado como 100%. Os dados reportados em todos os gráficos representam as médias ± erros padrão das médias (n = 5 por grupo). *P < 0,05, **P < 0,01 versus o grupo de controlo por análise de variância e testes t múltiplos do tipo Bonferroni. Os valores Emax são relatados no texto.
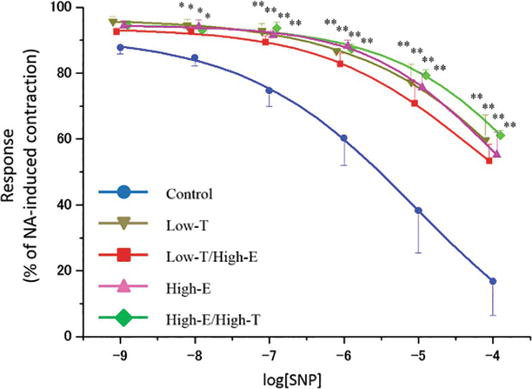
Figure 4.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceA curva de relaxamento induzido pelo nitroprussiato de sódio (SNP) em tiras de corpus cavernosum de rato. As tiras foram pré-contratadas usando 10-5 M NA. Os dados reportados em todos os gráficos representam as médias ± erros padrão das médias (n = 5 por grupo). *P < 0,05, **P < 0,01 versus o grupo de controlo por análise de variância e testes t múltiplos do tipo Bonferroni. Os valores Emax são relatados no texto.

Figure 5.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAs curvas de relaxamento induzidas pelo inibidor de Rho-kinase Y-27632 em tiras de corpus cavernosum de rato. As tiras foram pré-contratadas usando 10-5 M NA. Os dados reportados em todos os gráficos representam as médias ± erros padrão das médias (n = 5 por grupo). *P < 0,05, **P < 0,01 versus o grupo de controlo por análise de variância e testes t múltiplos do tipo Bonferroni. Os valores IC50 são relatados no texto.
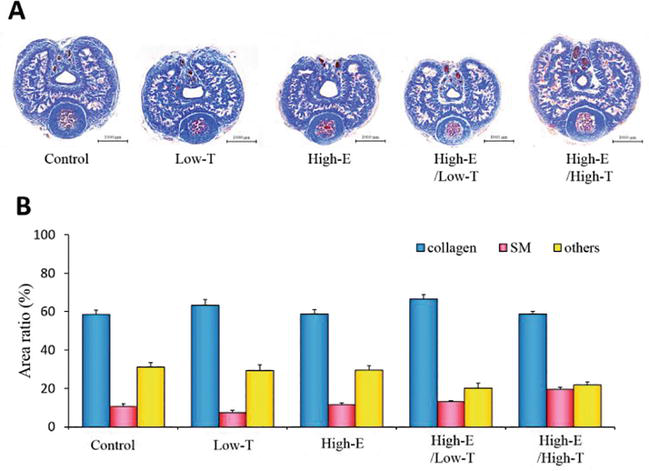
Figure 6.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAs secções do pénis de rato da coloração tricrómica de Masson. (A) Espécimes representativos do corpus cavernosum de cada grupo de ratos. (B) Avaliação histológica dos tecidos. Os rácios de área das fibras de colagénio, músculo liso (SM), e outros foram calculados utilizando análise de imagem computorizada. Os dados reportados em todos os gráficos representam as médias ± erros padrão das médias (n = 3 por grupo).
| Bio-T (ng/mL) | ||
|---|---|---|
| Controlo | 1.20 ± 0,13 | 102,5 ± 8,7 |
| Low-T | 0,55 ± 0,04*** | 51,2 ± 4.2 |
| High-E | 0,90 ± 0,12 | 332,3 ± 17,4*** |
| High-E/Low-T | 0.73 ± 0,06* | 275,4 ± 34,4*** |
| High-E/High-T | 2,58 ± 0,31*** | 401,5 ± 51.6** |
Tabela 1.
Níveis de estrogénio e testosterona biodisponível (bio-T) em ratos.
Figure 2 mostra a resposta eréctil à estimulação do campo eléctrico do nervo cavernoso nos diferentes grupos experimentais. A análise da relação ICP/MAP revelou que as relações nos grupos Low-T (0,52 ± 0,03), Low-T/High-E (0,46 ± 0,03), High-E (0,44 ± 0,03), e High-E/High-T (0,44 ± 0,02), que representavam todos os ratos tratados, eram significativamente inferiores às do grupo de controlo (0,70 ± 0,04, P < 0,01). Estes dados sugerem que as respostas erécteis foram diminuídas em ratos com um desequilíbrio hormonal sexual.
Figure 3 mostra a resposta contrátil das tiras de corpos cavernosos de ratos a concentrações crescentes de noradrenalina (NA). Verificou-se que concentrações crescentes de NA contraíram tiras de corpora cavernosa de ratazanas em todos os grupos. Em particular, 10 μM NA resultaram em diferenças estatisticamente significativas na resposta contractil in vitro entre os grupos experimentais (controlo: 154,5 ± 14,1%, Low-T: 169,8 ± 14,8%, Low-T/High-E: 200,2 ± 21,1%, High-E: 198,9 ± 15,3%, High-E/High-T: 249,7 ± 13,5%). Embora a resposta contrátil não tenha diferido entre o grupo de controlo e o grupo Low-T (P > 0,05), as respostas contráteis nos grupos Low-T/High-E, High-E, e High-E/Highh-T foram superiores à resposta no grupo de controlo (P < 0.05).
Figuras 4 e 5 mostram a resposta relaxante das tiras de corpos de ratazana cavernosa pré-contratados a concentrações crescentes de nitroprussiato de sódio (SNP) e Y-27632. Em todos os grupos, concentrações crescentes de NO doador SNP relaxaram as tiras de corpos de ratazana cavernosa (controlo: Emax = 16,8 ± 10,3%, Low-T: Emax = 59,7 ± 7,6%, Low-T/High-E: Emax = 53,4 ± 5,0%, High-E: Emax = 55,2 ± 6,8%, High-E/Highh-T: Emax = 61,1 ± 1,5%). Nos grupos tratados, as sensibilidades ao SNP foram significativamente inferiores às do grupo de controlo (P < 0,01). Concentrações crescentes de inibidor de Rho kinase Y-27632 tiras de corpos de rato cavernosa completamente relaxadas em todos os grupos (controlo: concentração inibitória semi-máxima = 1,22 × 10-6 M, Low-T: IC50 = 2,43 × 10-7 M, Low-T/High-E: IC50 = 1,31 × 10-7 M, High-E: IC50 = 2,26 × 10-7 M, High-E/Highh-T: IC50 = 1,25 × 10-7 M). Ao usar 10-6 M e 10-5 M Y-27632, as sensibilidades a Y-27632 nos grupos tratados foram significativamente inferiores às do grupo de controlo (P < 0,01); assim, os gráficos dos grupos tratados foram deslocados para a esquerda.
Figure 6 mostra a análise histológica dos corpora cavernosa dos ratos. Foi analisada a relação de área do músculo liso cavernoso (controlo: 10,5 ± 1,4%, Low-T: 7,4 ± 1,1%, Low-T/High-E: 13,2 ± 0,4%, High-E: 11,6 ± 0,1%, High-E/High-HT: 19,4 ± 1,1%). Da mesma forma, foi analisada a relação de área da fibra de colagénio (controlo: 58,4 ± 2,5%, Low-T: 63,2 ± 3,0%, Low-T/High-E: 66,5 ± 2,3%, High-E: 58,8 ± 2,2%, High-E/High-T: 58,7 ± 1,4%). Não foram observadas diferenças estatisticamente significativas entre os grupos experimentais nos rácios de área total de músculo liso, fibra de colagénio, e outros parâmetros de acordo com χ2 testes de independência (P 0,05). Globalmente, demonstrámos que as alterações no meio hormonal sexual afectaram a função eréctil em ratos, e a nossa hipótese de que o desequilíbrio hormonal sexual associado à DE foi apoiado por experiências in vivo e in vitro utilizando ferramentas farmacológicas.
0 comentários