A utilização de hidreto de alumínio lítio (LiAlH4) e borohidreto de sódio (NaBH4) como reagentes para a redução de aldeídos e cetonas a 1º e 2º-álcoois, respectivamente, foi observada. Destes, o hidreto de alumínio lítio, muitas vezes abreviado LAH, é o mais útil para a redução de derivados de ácido carboxílico. Graças à sua alta reactividade, o LAH reduz facilmente todas as classes de derivados de ácido carboxílico, geralmente ao estado de -1 oxidação. Ácidos, ésteres, anidridos e cloretos de acilo são todos reduzidos a 1º-álcoois, e este método é superior à redução catalítica na maioria dos casos. Dado que os cloretos de acilo e os anidridos são caros e morosos de preparar, os ácidos e ésteres são os reagentes mais comummente utilizados para esta transformação. Como nas reduções de aldeídos e cetonas, acredita-se que o primeiro passo em cada caso seja a adição irreversível de hidreto ao átomo de carbono carbonilo electrofílico. A ligação coordenada do oxigénio carbonilo a um metal ácido de Lewis (Li ou Al) melhora indubitavelmente o carácter electrofílico do carbono. Esta adição de hidreto de carbono é mostrada nos diagramas seguintes, sendo a fracção de hidróxido de carbono escrita como AlH4(-). Os quatro hidrogênios estão potencialmente disponíveis para a redução, mas quando os ácidos carboxílicos são reduzidos, um dos hidretos reage com o ácido O-H para gerar gás hidrogênio. Embora o lítio não seja mostrado, estará presente nos produtos como componente catiónico de sais iónicos.
Amidas são reduzidas a aminas por tratamento com LAH, e este tem provado ser um dos métodos mais gerais para preparar todas as classes de aminas (1º, 2º & 3º). Como o resultado da redução do LAH é tão diferente para ésteres e aminas, temos de examinar mecanismos de reacção plausíveis para que estas reacções descubram uma razão para este comportamento divergente.
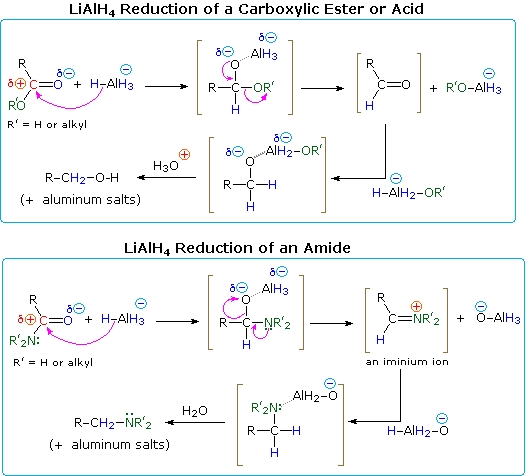
Uma explicação das diferentes trajectórias das reduções de ésteres e amidas reside na natureza dos diferentes substitutos de átomo hetero no grupo carbonilo (verde colorido no diagrama). O nitrogénio é mais básico do que o oxigénio, e os aniões amida são mais pobres deixando grupos do que os aniões alcóxido. Além disso, o oxigénio forma ligações especialmente fortes ao alumínio. A adição de hidreto produz um intermediário tetraédrico, mostrado entre parênteses, que tem uma ligação polar oxigénio-alumínio. Nem o hidrogénio nem o grupo alquilo (R) é um grupo de saída possível, portanto, se esta espécie tetraédrica for submetida a uma eliminação para reformar uma ligação dupla de hetero átomo, um dos dois substitutos restantes deve ser perdido. Para o éster, esta é uma escolha fácil (descrita pelas setas curvas). Ao eliminar um alcóxido de alumínio (R’O-Al), forma-se um aldeído, e este é rapidamente reduzido ao sal de um 1º-álcool pelo LAH. No caso do amido, a formação de aldeído requer a perda de um amido de alumínio (R’2N-Al), um processo improvável. Em alternativa, o nitrogénio mais básico pode actuar para ejectar uma espécie de óxido metálico (por exemplo Al-O(-)), e a ligação dupla de imínio resultante seria então reduzida a uma amina. Este é o curso seguido pela maioria das reduções de aminas; mas no caso de 1º-amidas, a acidez dos hidrógénios de azoto associada à basicidade do hidreto permite uma eliminação fácil do oxigénio (como uma fracção de óxido). O nitrilo intermédio resultante é então reduzido a uma 1ª-amina. O nitrilo é de facto um produto importante quando se utiliza menos do que uma equivalência total de LiAlH4. Um mecanismo será mostrado acima clicando no diagrama.
Lithium hidreto de alumínio reduz os nitrilos a 1º-aminas, como se mostra na equação seguinte. Uma adição inicial de hidreto ao átomo de carbono de nitrilo electrofílico gera o sal de um intermediário imine. Segue-se uma segunda transferência de hidretos, e o sal de amina metálica resultante é hidrolisado a uma 1ª-amina. Este método fornece uma alternativa útil à redução catalítica de nitrilos, descrita acima, quando as funções alqueno ou alquino estão presentes.
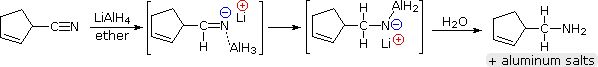
Em contraste com a utilidade do hidreto de alumínio lítio na redução de vários derivados de ácido carboxílico, o borohidreto de sódio raramente é escolhido para este fim. Em primeiro lugar, o NaBH4 é frequentemente utilizado em solventes hidroxílicos (água e álcoois), e estes reagiriam com cloretos de acilo e anidridos. Além disso, é moderadamente solúvel em solventes relativamente não-polares, particularmente a baixas temperaturas. Em segundo lugar, o NaBH4 é muito menos reactivo do que o LAH, não conseguindo reduzir amidas e ácidos (formam sais de carboxilato), e reduzindo os ésteres muito lentamente.
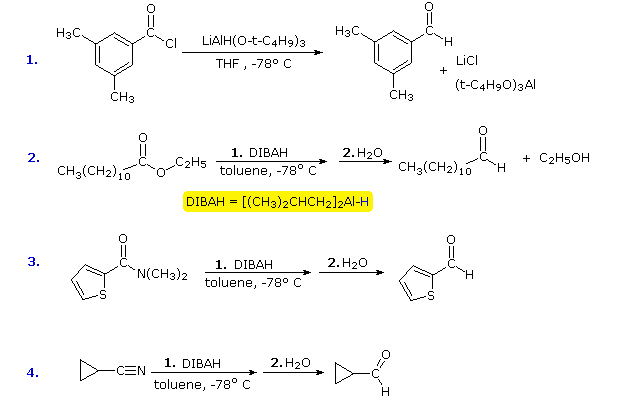
Desde que existam relativamente poucos métodos para a redução de derivados de ácido carboxílico a aldeídos, seria útil modificar a reactividade e solubilidade do LAH para permitir reduções parciais deste tipo. A abordagem mais frutuosa para este fim tem sido a fixação de grupos alkoxy ou alkyl no alumínio. Isto não só modifica a reactividade do reagente como doador de hidreto, mas também aumenta a sua solubilidade em solventes não polares. Dois destes reagentes serão aqui mencionados; o átomo de hidreto reactivo é de cor azul.
![]() Lithium tri-tert-butoxialuminohydride (LtBAH), LiAl3H : Solúvel em THF, diglyme & ether.
Lithium tri-tert-butoxialuminohydride (LtBAH), LiAl3H : Solúvel em THF, diglyme & ether.![]() hidreto de diisobutilalumínio (DIBAH), 2AlH : Solúvel em tolueno, THF & éter.
hidreto de diisobutilalumínio (DIBAH), 2AlH : Solúvel em tolueno, THF & éter.
Cada um destes reagentes contém um equivalente de hidreto. O primeiro (LtBAH) é um hidreto de metal complexo, mas o segundo é simplesmente um derivado alquílico do hidreto de alumínio. Na prática, ambos os reagentes são utilizados em quantidades equimolares, e geralmente a temperaturas bem abaixo de 0 ºC. Os exemplos seguintes ilustram como os aldeídos podem ser preparados a partir de derivados de ácido carboxílico através da aplicação cuidadosa destes reagentes. Uma temperatura de -78 ºC é facilmente mantida através da utilização de gelo seco como refrigerante. Os intermediários reduzidos que levam aos aldeídos serão exibidos ao clicar no botão “Mostrar Intermediários”. Com o excesso de reagente a temperaturas acima de 0 ºC, a maioria dos derivados de ácido carboxílico são reduzidos a álcoois ou aminas.
Contribuintes
William Reusch, Professor Emérito (Michigan State U.), Virtual Textbook of Organic Chemistry
0 comentários