Definition
Lancet. 2012 Abr 7;379(9823):1341-51.
Am J Respir Criteria Care Med. 2007 Set 15;176(6):532-55.
COPD é uma limitação persistente do fluxo de ar que é geralmente progressiva e associada a uma resposta inflamatória crónica reforçada nas vias respiratórias e pulmão a partículas ou gases tóxicos.
Asma vs COPD
Asma = estreitamento totalmente reversível das vias respiratórias
COPD = estreitamento não totalmente reversível das vias aéreas
COPD pode ser dividido em 2 fenótipos clínicos: enfisema e bronquite crónica.
- O enfisema é definido patologicamente como aumento dos espaços aéreos distais.
- A bronquite crónica é definida clinicamente como a tosse produtiva da expectoração que ocorre na maioria dos dias em 3 meses consecutivos durante 2 anos consecutivos.
Etiologia
- Lanceta. 2012 Abr 7;379(9823):1341-51.
- Am J Respir Criteria Care Med. 2007 Set 15;176(6):532-55.
- Lanceta. 2009 Aug 29;374(9691):733-43.
Muitos factores contribuem para o desenvolvimento da DPOC, incluindo factores genéticos como deficiência de alfa-1-antitripsina, exposições ocupacionais a poeiras e produtos químicos, poluição, infecções respiratórias na infância e fumo de cigarro.
| Etiologia | Mecanismo(s) |
| Cigarro smoke | A presença de partículas de fumo nos pulmões leva a uma resposta inflamatória com aumento da infiltração de macrófagos e neutrófilos nos pulmões. Estas células imunitárias libertam citocinas, quimiocinas e elastases, que danificam o parênquima pulmonar ao longo do tempo. |
| Exposições ocupacionais a pó e produtos químicos | Etiologia não é clara, no entanto, a hipótese de ser uma resposta inflamatória semelhante que danifica os alvéolos. |
| Alpha-1 antitrypsin deficiency | Alpha-1 antitrypsin é um inibidor da protease serina (SERPIN) segregado pelo fígado no sangue que inibe a enzima elastase neutrofílica de danificar o tecido pulmonar. A carência deste antitripsina alfa-1 leva à elasteólise sem oposição (destruição das fibras de elastina nas paredes alveolares) e ao desenvolvimento de enfisema precoce. Esta é a hipótese de protease-antiprotease do desenvolvimento de enfisema. |
| Uso de drogas IV crônicas | IV os consumidores de cocaína, metadona e heroína estão em maior risco de desenvolver DPOC; isto é atribuído ao dano vascular induzido pelo enchimento insolúvel (amido de milho, celulose, talco, fibra, etc.) encontrado nas drogas IV. |
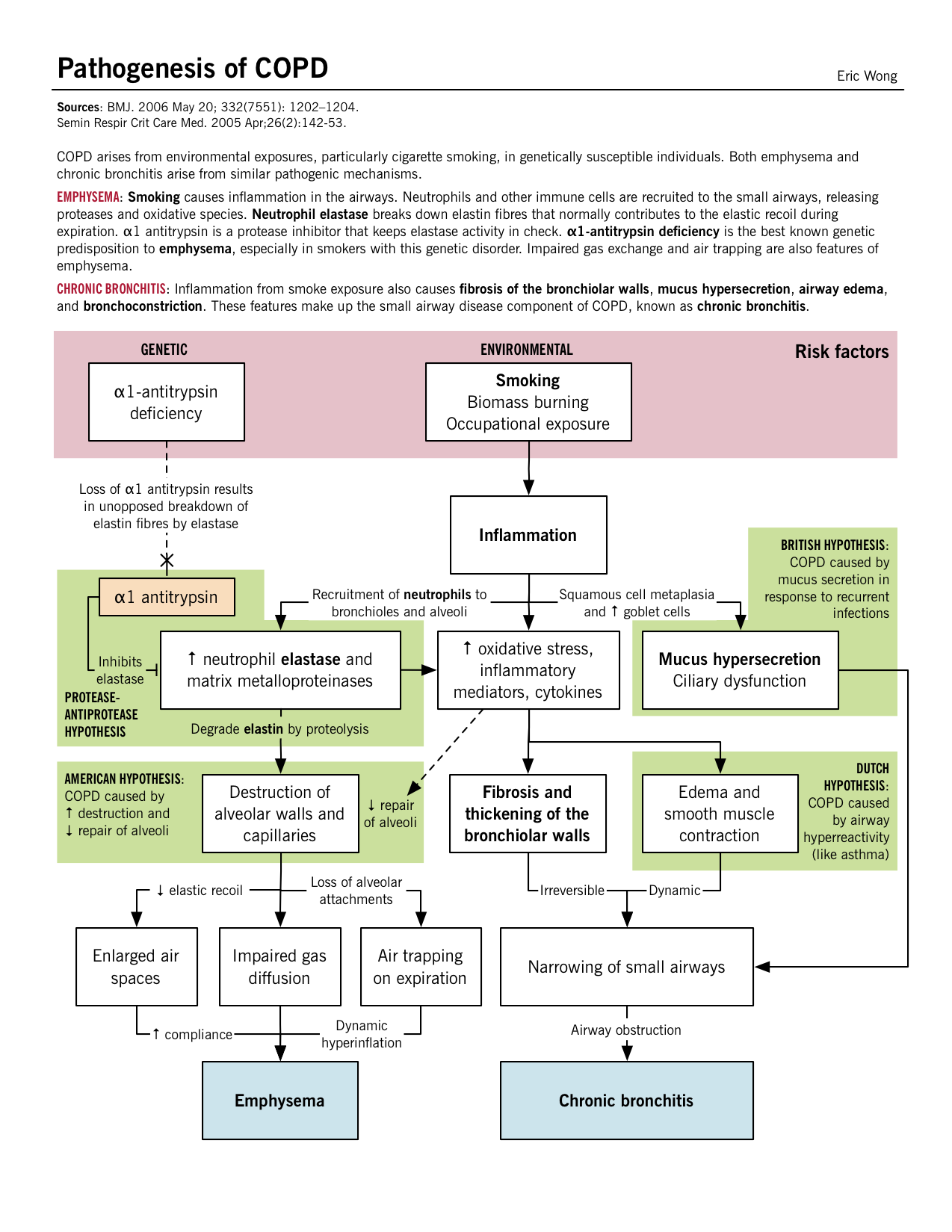
Patogénese, fisiopatologia e características clínicas
BMJ. 2006 20 de Maio; 332(7551): 1202-1204.
P>Embora a decomposição da DPOC em enfisema e bronquite crónica seja útil, normalmente os pacientes têm características e resultados de cada um e não podem ser simplesmente classificados.
| Enfisema | Bronquite Crônica | |
|
Patogênese Am J Respir Cell Mol Biol. 2005 Maio;32(5):367-72. |
A resposta inflamatória, mediada por neutrófilos, macrófagos e células T CD8+, liberta mediadores inflamatórios e enzimas que danificam o parênquima pulmonar. Proteases como elastase e metaloproteinases de matriz (MMPs) libertadas por estas células inflamatórias decompõem o tecido conjuntivo das paredes alveolares e os septos. Uma perda de recuo elástico leva a uma diminuição do fluxo expiratório, armadilhas de ar e colapso das vias respiratórias. | Aumento da glândula mucosa, hiperplasia das células da taça e disfunção mucociliar ocorrem em vias respiratórias maiores, causando produção excessiva de muco e acumulação reduzindo o lúmen das vias respiratórias. Embora estas alterações patológicas nas grandes vias respiratórias, parece que o principal local de aumento da resistência das vias respiratórias são as pequenas vias respiratórias (≤ 2mm). Fibrose e hipertrofia muscular lisa podem ocorrer juntamente com produção excessiva de muco e infiltração celular nas vias respiratórias periféricas. |
|
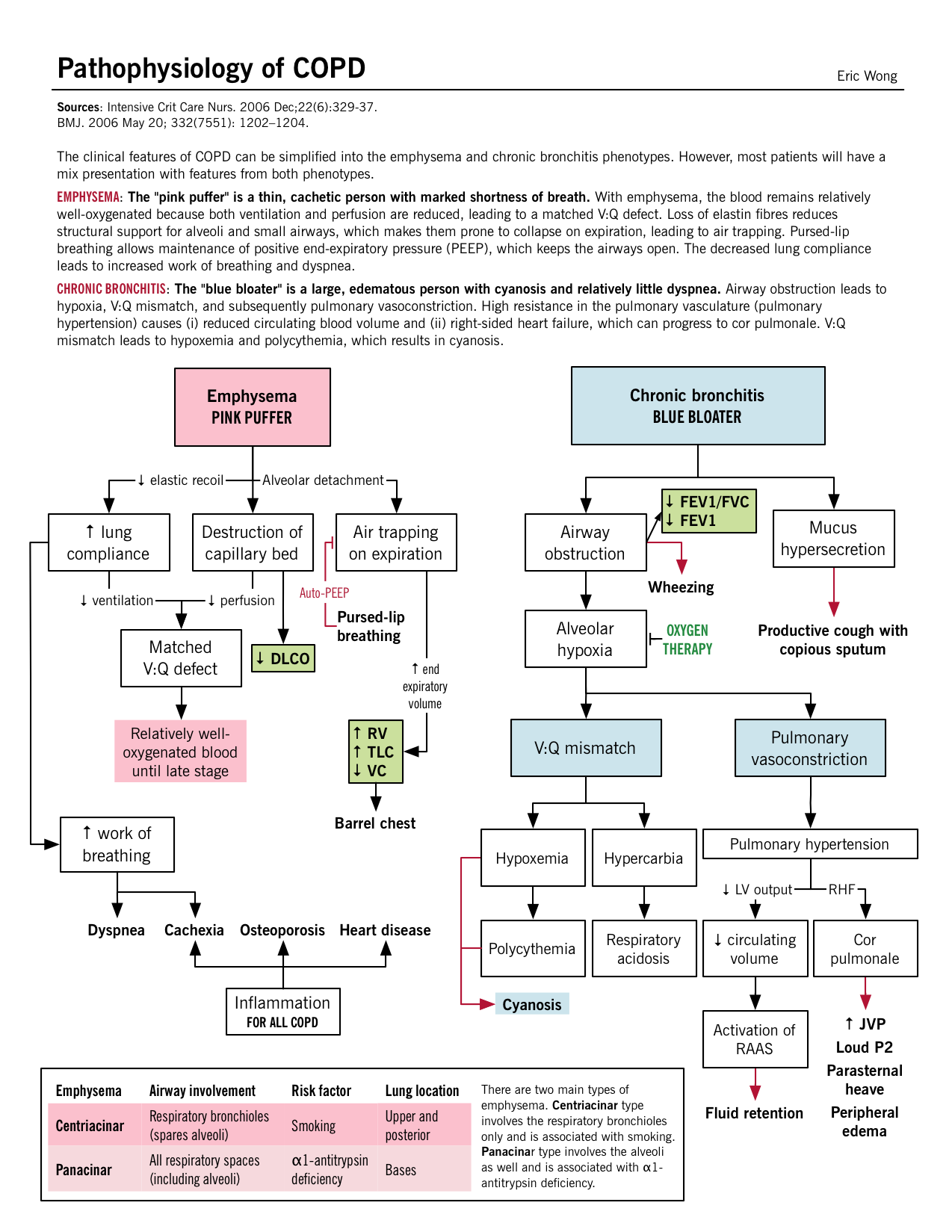
P>Patofisiologia BMJ. 2006 20 de Maio; 332(7551): 1202-1204. |
Destruição parenquimatosa: Os danos recorrentes nos alvéolos levam eventualmente à destruição do septo juntamente com o leito capilar também. Defeito V/Q compatível: Uma vez que tanto os bronquíolos terminais como os alvéolos juntamente com o leito capilar foram destruídos, existe um defeito correspondente entre a ventilação e a perfusão; as áreas de baixa ventilação também têm má perfusão. Hipoxia leve: Apesar do defeito V/Q “correspondente”, desenvolve-se uma hiperventilação suplementar e o débito cardíaco (CO) cai, o que leva a áreas de mau fluxo sanguíneo em áreas relativamente bem oxigenadas. Devido a este pobre CO, o resto do corpo sofre de hipoxia dos tecidos. Cachexia: A nível pulmonar, o baixo CO conduz à caquexia pulmonar; o que induz a perda de peso e o desperdício de músculo. Isto dá a estes pacientes o aspecto característico de “inchaço rosado”. |
Inflamação das vias respiratórias pequenas: Os mecanismos discutidos acima levam à inflamação nos pequenos bronquíolos e secreções de muco que estreitam ainda mais o lúmen das vias aéreas. Apesar disto, o parênquima é relativamente menos danificado. V/Q mismatch: A resposta fisiológica leva a uma queda na ventilação e compensação com o aumento de CO. O aumento da perfusão nas áreas de má ventilação acaba por causar hipoxia e policitemia secundária. Severe hipoxia e hipercarbia: O desfasamento crónico V/Q leva a uma diminuição da oxigenação/deoxigenação do sangue resultando em hipoxemia e aumento da retenção de CO2 (segue-se acidose respiratória). Hipertensão pulmonar e cor pulmonale: Hipercapnia crónica e acidose respiratória levam à vasoconstrição arterial nos pulmões. Com a acumulação de pressão retrógrada, as pressões ventriculares direitas continuam a aumentar e acabam por causar falência do VD. Caso contrário, conhecido como cor pulmonale. |
| Sinais clínicos/sintomas |
“Pink puffer” – tipo A Dispnéia severa constante/tachypnia (“puffing”): Provavelmente relacionada com o aumento do volume expiratório final (diminuição do recuo), tornando cada respiração menos eficiente. Os pacientes utilizam músculos acessórios (posição do tripé) e respiração mais rápida (hiperventilação) para compensar a sensação de ventilação inadequada. A dispneia está também relacionada com a fadiga muscular respiratória devido ao aumento da utilização, bem como com o achatamento do diafragma que prejudica a sua função. Tosse leve: a irritação das vias aéreas mais pequenas pode levar à produção de tosse. Não cianótica (“rosa”): Defeito V:Q correspondente; sem hipoxemia. Fino/cachexico: Perda de músculo esquelético e gordura subcutânea devido à ingestão oral inadequada, bem como altos níveis de citocinas inflamatórias (TNF-α) que causam tal desperdício. Diminuição dos sons respiratórios na auscultação: Hiperinsuflação de alvéolos e destruição da arquitectura alveolar causa diminuição da resistência das vias respiratórias. |
“Eflorescência azul” – tipo B Produção de expectoração copiosa: Elevada quantidade de expectoração produzida pelas células da taça. Ver Patogénese acima. Tosse: Irritação dos receptores da tosse, pela mucosa, nas vias respiratórias mais pequenas e grandes. Cianótica (“azul”): O defeito V/Q desajustado leva a uma oxigenação inadequada do sangue; mais proeminente nos lábios e nos leitos das unhas. Sobrecarga de volume (“bloater”): Muito provavelmente a partir da falha ventricular direita (VD), conhecida como cor pulmonale. Wheezy on auscultation: Devido à obstrução das vias aéreas. Em comparação com a asma, há menos broncoespasmo e mais muco/hipertrofia no COPD. Rhonchi é um som gurgling que pode ser ouvido devido à hipersecreção de muco nas vias respiratórias. |
Exacerbations
N Engl J Med. 2012 Jul 26;367(4):340-7.
Estudos transversais mostraram alguma ligação entre a colonização bacteriana das vias aéreas superiores e inferiores dos pacientes e exacerbações agudas da DPOC. Além disso, as exacerbações parecem coincidir com o aumento das infecções respiratórias virais agudas (gripe, parovírus, etc.). Os agentes patogénicos introduzem novos antigénios nas vias respiratórias e o parênquima que induz a secreção de quimiocinas (TNF-α e IL-6, IL-8 etc.) e leucotrienos, tanto pelos macrófagos das vias aéreas como pelo epitélio, que recrutam neutrófilos. Estes neutrófilos, juntamente com outras células imunitárias, secretam proteases e outros meios que inflamam ainda mais as vias aéreas e destroem o epitélio brônquico, levando a uma exacerbação clínica.
- Am J Respir Crit Crit Care Med. 2013 Fev 15;187(4):347-65.
- Lanceta. 2012 Abr 7;379(9823):1341-51.
- N Engl J Med. 2012 Jul 26;367(4):340-7.
Cessação do tabagismo
Cessação do tabagismo reduz significativamente a progressão da função pulmonar e reduz a mortalidade em 18%. É a intervenção mais eficaz e importante no COPD.
Broncodilatadores
Inhaled β2-agonistas (por exemplo, salbutamol de acção curta ou salmeterol de acção longa) actuam sobre β2-receptores de células musculares lisas para causar broncodilatação. Os anticolinérgicos inalados (por exemplo, ipratrópio de acção curta ou tiotrópio de acção longa) actuam para bloquear o efeito da acetilcolina nos receptores musculares liso das células musculares, permitindo a broncodilatação. Inalados β2-agonistas e anticolinérgicos são utilizados tanto para a gestão sintomática, como para exacerbações agudas da DPOC. Os broncodilatadores de acção prolongada são preferidos aos de acção curta devido a menos doses e a uma melhor gestão dos sintomas. Para um tratamento mais eficaz da DPOC estável, também pode ser utilizada a terapia combinada usando um inalador β2-agonista e um anticolinérgico.
Corticóides
Esteroides suprimem a resposta inflamatória inibindo os factores de transcrição, incluindo o factor nuclear-κB, que regulam a transcrição de várias citocinas, quimiocinas, moléculas de adesão, e outras proteínas que induzem e perpetuam a inflamação. Os corticosteróides inalados não são utilizados para o tratamento de exacerbações da DPOC; no entanto, têm sido utilizados no tratamento a longo prazo da DPOC numa minoria de doentes com DPOC estável que demonstram exacerbações frequentes e reversibilidade dos broncodilatadores. Recomenda-se a utilização de corticosteróides sistémicos durante uma exacerbação aguda que exija hospitalização.
div>Broncodilatadores e corticosteróides não demonstraram reduzir a mortalidade; apenas melhoram o VEF1, sintomas e qualidade de vida.
Oxygen
Cochrane Database Syst Rev. 2005 Oct 19;(4):CD001744.
A oxigenoterapia é frequentemente fornecida juntamente com intervenções farmacológicas para tratar a hipoxemia subjacente em pacientes com DPOC. Ao reduzir a hipoxia nos alvéolos, a vasoconstricção pulmonar é reduzida. A redução da hipertensão pulmonar diminui a pós-carga do coração direito, e melhora a função sistólica do coração direito. O oxigénio também reduz a hipoxemia no sangue, o que reduz o risco de desenvolvimento de policitemia. No entanto, a oxigenoterapia apenas demonstrou reduzir a mortalidade naqueles com hipoxemia grave (PaO2 < 55mmHg); caso contrário, não há benefício de mortalidade.
Reabilitação pulmonar
Chest. 2007 Maio;131(5 Suppl):4S-42S.
O objectivo da reabilitação pulmonar é melhorar a qualidade de vida e o funcionamento diário dos pacientes com DPOC. Através de uma equipa multidisciplinar, os pacientes são normalmente inscritos num programa de 6-12 semanas que inclui formação em exercício, apoio psicossocial, melhoria nutricional, e educação. Numerosos estudos (ver referência ao tórax) mostraram uma melhoria na capacidade de exercício, melhor qualidade de vida, e uma diminuição das hospitalizações. Contudo, a mortalidade mantém-se inalterada.
Cirurgia de redução do volume pulmonar (LVRS)
Ann Thorac Surg. 2006 Ago;82(2):431-43.
LVRS é uma opção cirúrgica que melhora a sobrevivência em pacientes com enfisema do lóbulo superior e baixa capacidade de exercício pós-reabilitação. O procedimento envolve a ressecção de partes do pulmão doente. Isto tem dois efeitos fisiológicos principais: (1) reduz a hiperinflação, permitindo que o diafragma se contraia com a sua força óptima, e (2) melhora o recuo do pulmão porque as porções inelásticas do pulmão são ressecadas.
0 comentários