Introduction
Gatos e cães sem dono representam uma grande ameaça para a propagação de doenças zoonóticas em todo o mundo. Só nos Estados Unidos, 27 milhões de gatos e cães são anualmente limitados. Em 1990, previa-se que nos Estados Unidos 5,7 a 9,5 milhões de gatos e 5,4 a 9,1 milhões de cães fossem eutanizados em casas de animais. Para manter a população de animais de companhia, a esterilização é expressa como o método mais adequado.A esterilização é uma abordagem que prejudica os tecidos testiculares através de vários produtos químicos, causando danos e atrofia das células testiculares ao deduzir ou parar o fornecimento de sangue ou a sua exsicção cirúrgica. A neutralização dos machos é mais significativa do que a das fêmeas, uma vez que os machos têm uma maior capacidade de produção de descendentes em comparação com as fêmeas. Para além do objectivo primário mencionado anteriormente, a esterilização é também utilizada para a erradicação das características sexuais secundárias da marcação, montagem e comportamento agressivo dos animais relativamente a outros machos. Com a evolução da investigação, os cientistas deduziram que mitos como a letargia dos tomos esterilizados ou a obstrução uretral não têm qualquer relação com a esterilização, pelo contrário, estas complicações estão principalmente relacionadas com o plano dietético do animal e as perturbações do tracto urinário. É geralmente percebido que os gatos de rua não possuídos e livres de parasitismo e doenças e que têm um curto período de vida em comparação com os gatos possuídos. Portanto, deduzir a população desses gatos não possuídos é um objectivo que vale a pena.
Várias técnicas de esterilização estão a ser praticadas, incluindo a esterilização hormonal, cirúrgica, mecânica e química. A castração por agentes químicos é uma abordagem não cirúrgica para a esterilização masculina. Tem sido praticada através da injecção de agente tóxico somenecrótico nos testículos de animais pertencentes a famílias infantis como Felidae, Canidae, Rodentia, etc. Os químicos utilizados na esterilização são: cloreto de cálcio, formalina, gluconato de zinco + arginina, solução salina hipertónica, permanganato de potássio, clorhexidinegluconato + cetrimida, glicerol, etanol, fluoreto de sódio, enquanto que o cloreto de sódio concentrado foi utilizado por . A administração destes agentes químicos no epididymidis, testículos e deferência do ducto acabou por provocar azoospermia perpétua, reduzir a produção de testosterona e a alteração da estrutura física dos testículos. Também provoca uma redução na produção de andrógenos e melhora os distúrbios androgénicos, tais como a doença prostática, a doença gonadal e o problema comportamental (montagem, agressão, marcação de urina). A injecção destes esterilizantes químicos no epidídimo, testículos, ou ductusdeferens induz a esterilidade ao danificar o transporte de espermatozóides e ao produzir oclusões fibrosas que causam azoospermia. A injecção intratesticular conduz à necrose testicular e diminui a espermatogénese, bem como a redução da concentração sérica de testosterona. Portanto, a abordagem química da castração é considerada como uma alternativa adequada de método cirúrgico. É menos demorado e exige também menos pessoal técnico. Além disso, é conveniente para a prática e não é necessário nenhum cuidado pós-operatório extra. A solução salina hipertónica (HSS) ainda não foi avaliada para castração química em gatos machos. Portanto, o estudo actual foi planeado com o objectivo de avaliar e comparar a eficácia da solução salina hipertónica (SSH) com cloreto de cálcio como agente quimioterilizante em gatos machos.
Materiais e Métodos
AnimaisExperimentares e Protocolo de Tratamento
AnimaisExperimentares (n=20 toms) foram equitativa e aleatoriamente alocados a quatro grupos contendo cinco animais em cada um. Os tomos dos grupos A e B foram injectados com uma única solução salina hipertónica, bilateral e intra-testicular, respectivamente em concentrações de 20% e 30%. Cloreto de cálcio foi administrado em testículos de animais do grupo C. Enquanto que, no grupo D, foi administrada injecção intra-testicular de solução salina normal esterilizada, e este grupo foi considerado como um grupo de controlo. A quantidade de soluções de teste administrada foi de acordo com a largura dos testes em cada animal.
Injecção intra-esticular
Antes da injecção, o escroto foi raspado e limpo com antiséptico de solução de iodo povidona. A injecção intra-esticular foi dada com uma agulha esterilizada de calibre 21. A agulha foi inserida a partir do aspecto caudoventral do testículo a cerca de 1cm da cauda do epiderme e direccionada para o aspecto dorso-craniano desse testículo, de modo que quando a agulha é retirada da extremidade proximal todistal, a solução foi uniformemente administrada ao longo de todo o percurso do testículo. A tabela 1 dá uma estimativa da quantidade de solução a injectar em relação ao peso dos testículos
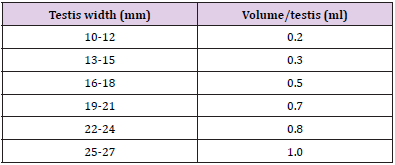
Tabela 1: Volume da solução a injectar em cada testículo com base na largura testicular.
Critérios de avaliação
Avaliação clínica: Foram observadas alterações no escroto (por exemplo, dor, inchaço, dermatite) uma vez por dia durante 3 dias e depois uma vez por semana até à conclusão da experiência. Os calibres de Vernier foram utilizados para medir a largura dos testes após a injecção com o mesmo intervalo de tempo descrito acima .
Análise de concentração de testosterona de Vernier: O sangue foi absorvido em vacuadores de Gel da veia cefálica e foi centrifugado a 2000 rpm durante 15 minutos para separar o soro. O soro foi conservado a -20°C até à conclusão da experiência. O ELISA competitivo foi feito utilizando o Kit de Micropoços de Testosterona Accu-Bind® ELISA disponível comercialmente .
Exame Histológico: Após a remoção dos testes, as amostras foram lavadas com soro fisiológico normal e fixadas na solução fixadora de Bouin em recipientes plásticos de 50 ml para cada teste direito e esquerdo, separadamente. O processamento convencional do tecido das amostras foi feito. As secções de tecido com espessura 5μm foram cortadas com o microtoma rotativo helpof e montadas posteriormente nas lâminas de vidro. As lâminas foram então coradas com Hematoxilina e Eosina e as suas características histológicas foram comparadas com a ajuda de ImageJ®Software.
Análise Estatística
Os dados assim gerados foram analisados pelo modelo LinearModel Generalizado Desenho completamente aleatório (factor CRD-2) e a diferença de significância foi comparada por diferença de significância mínima (LSD) ao nível de 5% de significância .
Resultados
Largura do Testículo
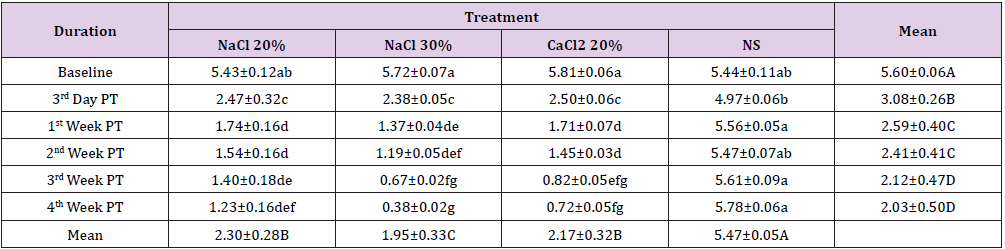
P>Pesando a largura do testículo uma diferença estatisticamente não significativa(p>0,05) foi observada em todos os grupos no início do período de estudo. A administração de medicamentos experimentais resultou em diferenças significativas(p0.05) entre si. Na 1ª semana após a injecção, foi observada uma diminuição estatisticamente não significativa (p>0,05) da largura testicular em todos os grupos em relação ao ponto de tempo anterior à amostragem. Uma diminuição adicional da largura testicular foi observada nos grupos A, B e C na 2ª semana após a injecção, onde o grupoC foi estatisticamente significativo (p0.05) diminuição da largura testicular dos animais do grupo D enquanto que houve um decréscimo tão significativo (p
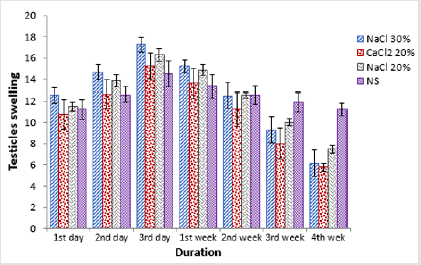
Figure 1:Comparação da largura dos testículos de quatro grupos em diferentes intervalos de tempo.
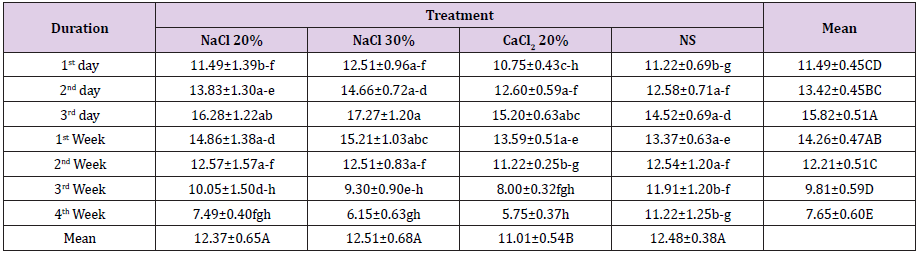
Tabela 2: Largura do testículo (mm; Meios ± SE) em diferentes intervalos de tempo de quatro grupos: injecção intra testicular bilateral de 20% de SSH (Grupo A), 30% de SSH (Grupo B), 20% de CaCl2 (Grupo C) e solução salina normal (Grupo D).
Exame histopatológico
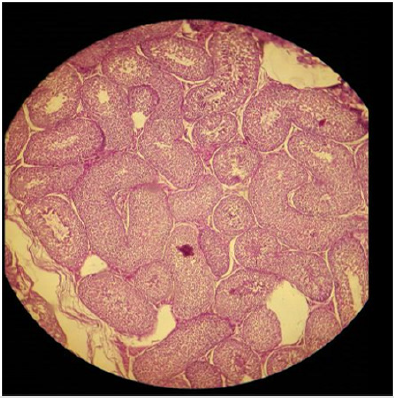
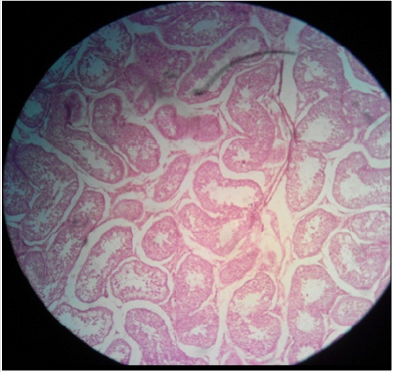
Plate 1: Efeito da solução salina normal (NSS) sobre (a) parênquima testicular e (b) túbulos seminíferos em malecos adultos sexuais; túbulos seminíferos intactos e parênquima testicular normal podem ser notados. H&E; 400 X.
Resultados histopatológicos expuseram que o SSH parênquima testicular deficiente e levou a alterações necróticas no tecido testicular em comensuração com cloreto de cálcio. O aumento da concentração de SSH produziu alterações necróticas inalteráveis. A administração bilateral intratesticular de 20% de concentração de SSH produzida parcialmente para completar as alterações necróticas nos tecidos dos testículos. O epitélio dos túbulos seminíferos foi moderadamente destruído com alterações por ordem de células parênquima. Necrose moderadamente coagulada e vacuolização de Intersticial e Sertolicélicos foi notada incluindo pyknosis dos núcleos (Placas 1 & 2).30% de concentração de SSH produziu necrose aguda nos tecidos das partículas. Foi notada necrose aguda e degeneração de túbulos seminíferos. As células intersticiais e as células de Sertoli também foram severamente degeneradas juntamente com a ruptura de células parenquimatosas. As células germinativas foram diminuídas a partir dos túbulos seminíferos. O lúmen vazio foi notado em túbulos seminíferos (Placa 3). A administração bilateral intratesticular de 20% de concentração de clorideproduziu uma necrose grave nos tecidos dos testículos. Notou-se necrose aguda e degeneração dos túbulos seminíferos. As células de sertoli e as células intersticiais também foram gravemente degeneradas ao longo da retirada de células parenquimatosas. As células germinativas foram diminuídas nos túbulos seminíferos. Lúmen vazio foi notado em túbulos seminíferos (Placa 4). A injecção intra-testicular de 20% e 30% de solução salina hipertónica induziu a destruição de células intersticiais e de túbulos seminíferos, o que levou à atrofia dos testículos. A concentração de30% de necrose induzida por solução salina hipertónica, comparada com 20% de cloreto de cálcio.
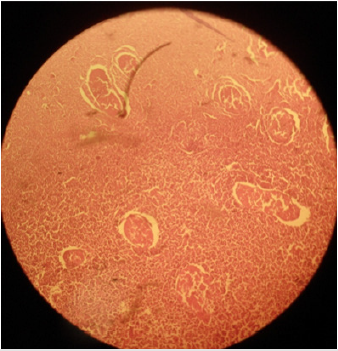
p>Plate 3: Efeito de 30% de solução salina hipertónica (HSS) no parênquima testicular e nos túbulos seminíferos em gatos adultos sexuais; (a) necrose coagulativa dos túbulos seminíferos e células de Leydig e (b) desorganização severa do parênquima celular com (c) diminuição das células germinativas dos túbulos seminíferos pode ser notada. H&E; 400 X.
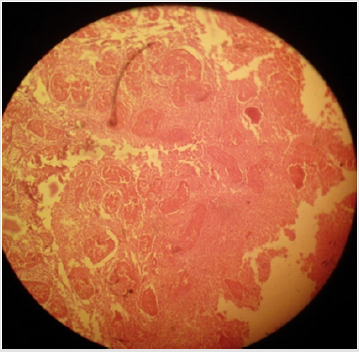
p>Plate 4: Efeito de 20% de cloreto de cálcio (CaCl2) no parênquima testicular e nos túbulos seminíferos em gatos machos sexualmente adultos;(a) necrose coagulativa dos túbulos seminíferos e células de Leydig e (b) desorganização grave das células do parênquima juntamente com(c) diminuição das células germinativas dos túbulos seminíferos podem ser notadas. H&E; 400 X.
Serum Testosterona Concentração
Em animais de base dos grupos, A e D tiveram uma diferença estatisticamente significativa (p0.05)em termos de nível de testosterona sérica entre todos os grupos. Na 3ª semana após o tratamento, houve uma alteração estatisticamente significativa (p0,05) no nível de testosterona sérica dos animais dos grupos B e D (Quadro 3). Foi observada uma tendência semelhante no nível de testosterona sérica de todos os grupos na 4ª semana pós-tratamento em que o grupo B era mais baixo e o grupo D era mais alto (Figura 2).
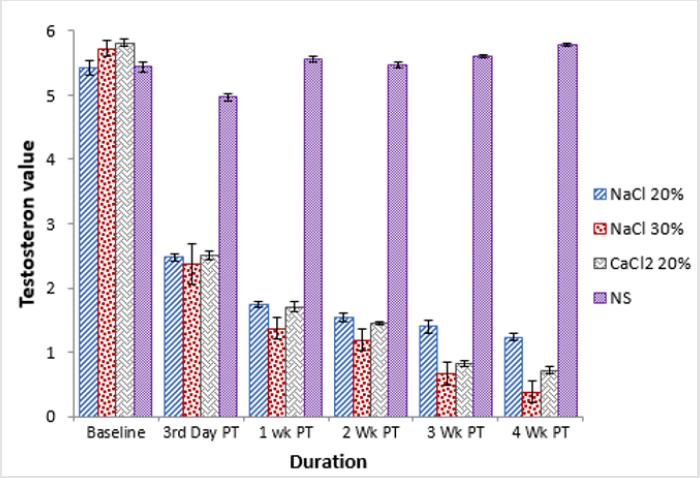
Figure 2:Comparação da concentração de testosterona de quatro grupos em diferentes intervalos de tempo.
Discussão
A esterilização química é uma técnica sem sangue e não cirúrgica para a esterilização masculina. A técnica química de esterilização é muito mais económica, menos exigente e viável para programas de controlo populacional colossal tanto em gatos como em cães. A administração intra-esticular do esterilizante induz a deterioração e necrose das células parenquimatosas dos testículos. Enquanto que as administrações intra-epidimaladministrações provocam a oclusão fibrosa e causam a destruição de transporte de espermatozóides e induzem a azoospermia. Vários agentessterilizantes tais como formalina, acetato de zinco + arginina, gluconato de clorhexidina + cetrimida, glicerol, etanol, fluoreto de sódio, permanganato de potássio e cloreto de cálcio foram utilizados para este objectivo. A eficácia da administração única, bilateralintra-testicular da solução de salina hipertónica em diferentes concentrações como agente quimio-esterilizante e comparação com cloreto de cálcio em gatos machos foi avaliada no presente estudo. Foi conseguido através de estimativa clínica (tamanho dos testículos), concentração de testosterona sérica e investigação histopatológica. A orquiectomia foi realizada no final do estudo para exame histopatológico. Os resultados da presente experiência revelaram que a injecção intra-testicular de solução salina hipertónica e cloreto de cálcio induziu a necrose e a necrose testicular, juntamente com a redução da concentração de testosterona do soro. Estes resultados concordam com a experiência de Emiret al., 2008, que registou resultados análogos em ratos injectando20% de HSS. Devido à necrose e degeneração das células testiculares, a espermatogénese é interrompida, e a destruição das células intersticiais é a causa provável da redução na produção de testosterona.
Resultados semelhantes foram descritos por Jana e Samanta. A concentração plasmática de testosterona diminuiu devido às propriedades necróticas do cloreto de cálcio quando injectado intra-testicularmente em gatos. Além disso, a necrose das células intersticiais secretoras de testosterona também participou na redução da concentração de testosterona no sangue. Abshenas relatou que a concentração de serumtestosterona foi consideravelmente reduzida com a administração de óleo essencial de Eugenia caryophyllata quando este foi injectado intratesticular. Considerando o tamanho dos testículos, o nosso estudo mostrou uma redução considerável na largura dos testículos em comparação com o grupo de controlo na conclusão da duração experimental após o rápido aumento do tamanho em 24-48 horas com uma diminuição gradual da administração química a seguir. Estes resultados são muito semelhantes aos de Leoci que descreveu que a administração bilateral intra-testicular de cloreto de cálcio em soluçãosterilizante produziu uma considerável diminuição da largura dos testículos após um curto período de ligeiro inchaço. Resultados semelhantes foram também relatados por Oliveria que relatou resultados semelhantes com a administração bilateralintra-testicular de solução de gluconato de zinco esterilizado. Concluíram que a hormoneconcentração da testosterona não depende do tamanho testicular. Os nossos resultados demonstraram que tanto o tamanho testicular como a concentração de testosterona foram reduzidos com o prolongamento do tempo.
No que diz respeito aos exames histopatológicos, a corrente-experimento revelou que os testículos injectados com hipertonicalina e cloreto de cálcio apresentavam alterações destrutivas nas células do parênquima dos testículos. Em túbulos seminíferos, a fibrose foi induzida acompanhando alterações destrutivas noepitélio germinal e necrose coagulativa de células de Sertoli e células intersticiais. Estes resultados concordam com Neto, que descreveu que a administração intratesticular do cloreto de sódio concentrado induz alterações destrutivas nos testículos que levaram à fibrose e necrose. A alta concentração de HSS e CaCl2 causa atrofia e formação de tecido cicatricial em túbulos seminíferos. O nível de degeneração de espermatids, espermatócitos e aumenta rapidamente com o aumento da concentração do esterilizante. Um análogoousexperiment foi conduzido por Oliveria que concluiu que a administração intratesticular da solução de base de zinco em gatos machos induziu a proliferação de leucócitos polimorfonucleares e outras células sanguíneas em túbulos seminíferos. Os nossos resultados são também apoiados pelas descobertas de Cavalieri, que revelou que a solução de acetato de zinco produziu alterações destrutivas óbvias nos tecidos dos testículos de vitelos de touro. Estas alterações conduzem à atrofia testicular e à infertilidade total.
Conclusão
Os resultados do estudo levam a concluir que o HSS tem potencial para substituir outros métodos (físicos ou cirúrgicos) na prática para neutralizar os gatos machos. Foi provado ser menos demorado,menos doloroso mas igualmente eficaz.
- Abshenas J, MM Molaei, A Derakhshnfar, N Ghalekhani (2013) Esterilização química por injecção intratesticular de óleo essencial de Eugenia caryophyllata em cão: um estudo histopatológico. Ir J Vet Surg 8(19): 9-16.
- Lecoi R, G Aiudi, F Silvestre, E Lissner, G Lacalandra (2014) Um estudo dose-finding, a longo prazo, sobre a utilização de cloreto de cálcio em solução salina como método de esterilização não cirúrgica em cães: Avaliação da concentração mais eficaz com o menor risco. Acta Vet Scand 56: 62-68.
- Soto FRM, WG Viana, AJ Sousa, SR Pinheiro, GB Mucciolo (2007) Avaliação do gluconato de zinco, associado ou não ao sulfóxido de dimetilo, como método contraceptivo para cães machos. J Anim Repord 4: 119-124.
li>Benjamin MM (1978) Outline of Veterinary Clinical Pathology. Em Benjamin MM (Eds.), (2ª edição) Thelowa state university press, Ames, Iowa, USA.li>Bloomberg MS (1996) Surgical neutering and nonurgical alternatives. J Am Vet Med. Assoc 208: 517-519.li>Cavalieri J, M Wang, L Johnson (2015) Esterilização química de bezerros de touro Bos indicus após injecção intratesticular de acetato de zinco: Efeitos sobre a qualidade do sémen e alterações testiculares. Anim Reprod Sci 156: 23-33.li>Currah JM, SH Hendrick, JM Stooley (2009) A avaliação comportamental e alívio da dor associada à castração em bezerros de carne bovina tratados com fluxin meglumine e lidocaína caudal anestesia epidural com epinefrina. Can Vet J 50(4): 375-382.li>Emir L, M Dadalı, M Sunay, D Erol, M Çaydere, et al. (2008) Castração química com injecção intratesticular de 20% de soro hipertónico: Um método minimamente invasivo. Seminários Urol Oncol e Investigações Originais 26(4): 392-396.li>Fagundes AKF, ECS Oliveira, BM Tenorio, CCS Melo, LTB Nery, et al. (2014) Injecção de um agente químico de castração, gluconato de zinco, nos testículos dos resultados dos gatos no comprometimento da espermatogénese: Uma abordagem potencialmente contraceptiva para esta espécie. Theriogenology 81(2): 230-236.li>Hansen BD (2003) Avaliação da dor em cães: Estudos clínicos veterinários. Inst. laboratório. Animais. Res J 44(3): 197-205.li>Jana K, D Ghosh, PK Samanta (2005) Evaluation of single intratesticular injection of calcium chloride for non-surgical sterilization of male goats (Capra hircus): a dose de estudo dependente. Anim Reprod Sci 86(1-2): 89-108.li>Jana K, PK Samanta (2011) Avaliação clínica da esterilização não-cirúrgica de gatos machos com uma única injecção intra-esticular de cloreto de cálcio. BMC Veterinary Research 7: 39.li>Kutzler M, Wood A (2006) Métodos não cirúrgicos de contracepção e esterilização. Theriogenoly 66(3): 524-525.li>Kwak BK, S Lee (2013) Injeção intratesticular de soro hipertónico: método alternativo não invasivo para modelo de castração animal. Dev Repord 17(4): 435-440
li>Neto OA, BG Gasperin, MT Rovani, GF llha, JE Nobrega, et al. (2014) Tratamento da solução de cloreto de sódio hipertónico intratactivo como método de castração química em bovinos. Theriogenology 82(7): 1007-1011.li>Oliveira ECS, MRP Moura, MJC Desa, VA Silva, JP Kastelic (2012) Contracepção permanente de cães induzida com injecção intratesticular de uma solução à base de Gluconato de Zinco. Theriogenology 77(6): 1056-1063.li>Rajkumar D (2013) Minimização da dor na castração do gado no que diz respeito ao método, idade e alívio da dor. Aust Vet J 55(6): 263-264.
li>Steel RGD, JH Torrie (2004) Princípios e procedimentos de estatística. McGraw Hill Book Co. Inc. New York, USA.li>Vanderstichel R, MJ Forzán, GE Pérez, JA Serpell, E Garde (2015) Alterações nas concentrações de testosterona no sangue após esterilização cirúrgica e química de cães machos em liberdade no sul do Chile. Theriogenology 83(6): 1021-1027.li>Wang M (2004) A injecção intratesticular de Neutersol induz a esterilidade em cães e gatos. No segundo simpósio internacional por ACC&D sobre controlo não cirúrgico de contraceptivos em cães e gatos 165-169.
0 comentários