Fase G1 (G significa intervalo) abrange desde o fim da mitose até ao início da fase S. Durante a fase G1, as células verificam o ambiente externo e o estado intracelular, e decidem se continuam ou não com o ciclo celular. Em organismos multicelulares, o progresso do ciclo celular é principalmente influenciado por sinais extracelulares, como a adesão celular, ou moléculas libertadas por outras células, tais como factores tróficos. Existe também informação interna sobre o estado da célula que afecta o progresso do ciclo celular, como o estado de saúde da célula, se existe um número correcto de componentes celulares após a divisão celular, ou se os cromossomas foram devidamente segregados. Quando os sinais externos e internos estão correctos, as células em proliferação crescem e preparam-se para entrar na fase S.
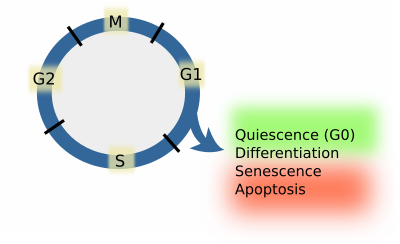
No entanto, as células de organismos multicelulares não proliferam, mas abandonam o ciclo celular da fase G1, seja transitória ou permanentemente. Parar o ciclo celular significa que as células vão diferenciar-se, permanecer quiescentes, passar por processos de senescência, ou morrer por apoptose (Figura 1). Quando as células permanecem em estado quiescente, diz-se que se encontram na fase G0. A partir de G0 e estados diferenciados, alguns tipos de células são capazes de reiniciar o ciclo celular. Entrar em estado de quiescência significa a expressão de um conjunto particular de genes e a repressão dos genes que promovem a diferenciação, senescência ou apoptose. As células quietas reprimem os genes que promovem o ciclo celular. A partir da apoptose ou senescência, as células não podem regressar ao ciclo celular. Assim, estas são quatro decisões possíveis que as células podem tomar durante a fase G1, que depende de complexos moleculares conhecidos como pontos de controlo. As células devem passar por estes pontos de controlo antes de entrarem na fase S. Se as células não passarem um deles, diz-se que foi tomada uma decisão. No entanto, se as células não pararem em nenhum deles, a fase S acabará por começar. Este é o processo padrão. Os mecanismos moleculares nos pontos de controlo têm de ser rápidos, completos, e irreversíveis.
Checkpoints são complexos moleculares que controlam o progresso do ciclo da célula. No núcleo dos pontos de controlo há kinases dependentes de ciclina (CdKs). Nove CdKs diferentes têm sido encontrados em eucariotas. Para serem activos, os CdK precisam de ligar uma proteína reguladora conhecida como ciclina, e também ser fosforilados. Uma vez activados, os CdKs fosforilam vários substratos, tais como inibidores do ciclo celular, permitindo assim o progresso do ciclo celular. As ciclinas são proteínas sintetizadas periodicamente durante o ciclo celular. Existem 16 ciclinas diferentes nas células eucariotas. As ciclinas A, B, D, e E têm mais impacto no progresso do ciclo celular. As ciclinas D (há 3) e E (há 2) são importantes para o progresso da fase G1. CdK4/ciclina D (D/CDK4) e CdK2/ciclina E (E/CDK2) fosforilato o factor de transcrição retinoblastoma, que faz parte do último ponto de controlo da fase G1.
O ponto de verificação onde o retinoblastoma é fosforilado é conhecido como ponto de restrição porque, se este ponto de verificação for passado, as células iniciam imediatamente a fase S. O conceito de ponto de restrição foi introduzido por A. Pardee em 1974. É muito importante porque não há retorno, uma vez iniciada a fase S, as células irão dividir-se e nenhum sinal externo irá parar o ciclo celular. Para alcançar o ponto de restrição durante a fase G1, as células precisam de sinais extracelulares como mitógenos, mas não são necessárias uma vez passado este ponto de restrição. A sequência é a seguinte. As mitógenes activam receptores de membrana plasmática que estimulam Ras-GTPases, que promovem a expressão de genes de factores de transcrição como c-Myc e outros. Os factores de transcrição aumentam a expressão da ciclina D que, por sua vez, activam CdK4 e 6, as proteínas retinoblastómicas fosforilato que libertam o factor E2F (Figura 2).
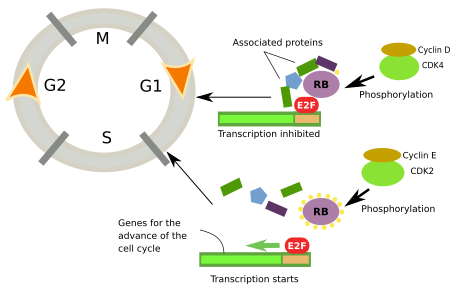
No centro do ponto de restrição estão CdK-cyclin, retinoblastoma e E2F (Figura 2). O retinoblastoma não é fosforilado durante a fase inicial da G1. Nesta forma, o retinoblastoma está ligado ao E2F e inibe a expressão dos genes que promovem o progresso do ciclo celular. O retinoblastoma é primeiro fosforilado por CdK4/ciclina D e depois por CdK2/ciclina E, ambos na fase G1. Os retinoblastomas têm 16 sítios de fosforilação, o que indica quão complexa é a regulação. A fosforilação de todos os sítios é sucessiva, e cada sítio específico de CdK fosforilatos. Parece que quando 14 sítios são fosforilados, a afinidade do retinoblastoma para E2F diminui e, portanto, o factor E2F pode promover a expressão de genes que favorecem o início da fase S.
Neste quadro molecular, os sinais portadores de informação sobre o ambiente (nutrientes, sinais tróficos, e outros), danos no ADN, ou sobre o tamanho adequado para a divisão são integrados. Se tudo estiver correcto, a célula passa o ponto de restrição e começa a fase S. Se algo estiver errado, há vários tipos de inibidores que impedem o progresso do ciclo celular. Um deles é o p53, que é activado em muitos tumores. Quando o ADN é danificado, ou a célula está sob stress, ou há alterações no pH, ou quaisquer outras situações potencialmente perigosas para a célula estão presentes, a p53 é sobre-expressa e activa o género p21, o que por sua vez inibe a fosforilação do retinoblastoma, de modo que o ciclo celular é preso e não inicia a fase S.
Como mencionámos acima, a maioria das células de um organismo multicelular não se encontra em proliferação permanente. Isto porque existem inibidores de Cdk/ciclinas na fase G1 que fazem com que as células abandonem o ciclo celular.
Bibliografia
Blomen VA, Boonstra J. 2007. Determinação do destino celular durante a progressão da fase G1. Ciências da vida celular e molecular. 64:3084-3104.
Matson JP, Cook JG. 2017. Decisões sobre a proliferação do ciclo celular: o impacto das análises de célula única. A revista FEBS. 284: 362-375.
0 comentários