Uma célula electrolítica típica pode ser feita como mostra a figura {1}(PageIndex{1}}). Dois condutores eléctricos (eléctrodos) são imersos no líquido a ser electrolisado. Estes eléctrodos são frequentemente feitos de um material inerte como o aço inoxidável, platina, ou grafite. O líquido a ser electrolisado deve ser capaz de conduzir electricidade, pelo que é geralmente uma solução aquosa de um electrólito ou de um composto iónico fundido. Os eléctrodos são ligados por fios a uma bateria ou outra fonte de corrente contínua. Esta fonte de corrente pode ser pensada como uma “bomba de electrões” que absorve electrões de um eléctrodo e os força a sair para o outro eléctrodo. O eléctrodo do qual os electrões são removidos torna-se positivamente carregado, enquanto que o eléctrodo ao qual são fornecidos tem um excesso de electrões e uma carga negativa.
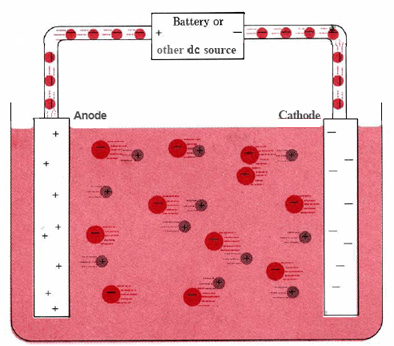
p> O eléctrodo carregado negativamente atrairá iões positivos (catiões) para ele a partir da solução. Pode doar alguns dos seus electrões em excesso a tais catiões ou a outras espécies do líquido a ser electrolisado. Assim, este eléctrodo é, de facto, um agente redutor. Em qualquer célula electroquímica (electrolítica ou galvânica), o eléctrodo em que ocorre a redução chama-se catodo.
O eléctrodo positivo, por outro lado, atrairá iões negativos (aniões) para si próprio. Este eléctrodo pode aceitar electrões desses iões negativos ou de outras espécies na solução e, portanto, comporta-se como um agente oxidante. Em qualquer célula electroquímica, o ânodo é o eléctrodo em que ocorre a oxidação. Uma maneira fácil de lembrar qual é o eléctrodo que é aquele anodo e a oxidação começam com vogais enquanto o cátodo e a redução começam com consoantes.
O vídeo seguinte mostra este processo a ocorrer numa solução neutra de água com alguns electrólitos presentes.
Como exemplo de como a electrólise pode causar uma reacção química, suponhamos que passamos uma corrente eléctrica directa através de 1 M HCl. Os iões H3O+ nesta solução serão atraídos para o cátodo, e os iões Cl- irão migrar para o ânodo. No cátodo, H3O+ será reduzido para gás H2 de acordo com a meia-equação
\
(Como visto noutras secções, escreveremos H+ em vez de H3O+ em meia-equação para poupar tempo). No ânodo, serão aceites electrões de iões Cl-, oxidando-os a Cl2:
\
p>Durante a electrólise H2(g) e a bolha de Cl2(g) do cátodo e ânodo, respectivamente. A equação global para a electrólise é a soma de Eqs. \A reacção líquida é o inverso da combinação espontânea de H2(g) com Cl2(g) para formar HCl(aq). Tal resultado é válido para a electrólise em geral: a corrente eléctrica fornecida do exterior do sistema provoca uma reacção química não espontânea.
Embora a electrólise reverta sempre uma reacção redox espontânea, o resultado de uma dada electrólise pode nem sempre ser a reacção que desejamos. Numa solução aquosa, por exemplo, há sempre um grande número de moléculas de água nas proximidades tanto do ânodo como do cátodo. Estas moléculas de água podem doar electrões ao ânodo ou aceitar electrões do cátodo, tal como os aniões ou cátions podem doar. Consequentemente, a electrólise pode oxidar e/ou reduzir a água em vez de provocar a reacção do electrólito dissolvido. Um exemplo deste problema é a electrólise de fluoreto de lítio, LiF. Podemos esperar redução de Li+ no cátodo e oxidação de F- no ânodo, de acordo com as meias-equações
\
\
No entanto, Li+ é um muito pobre aceitador de electrões, e por isso é muito difícil forçar a equação \(\ref{5}}) a ocorrer. Consequentemente, o excesso de electrões do cátodo é aceite pelas moléculas de água:
\
Uma situação semelhante surge no ânodo. Os iões F são agentes redutores extremamente fracos – muito mais fracos do que as moléculas de H2O – por isso a meia-equação é
>/p>
A equação global pode ser obtida multiplicando a Equação {7}} por 2, adicionando-a à Equação {8} e combinando H+ com OH- para formar H2O:
\\
O vídeo seguinte mostra a electrólise da água a ter lugar, utilizando ácido sulfúrico como ponte para permitir a transferência de carga. Após a electrólise estar completa, as identidades dos gases formados são verificadas utilizando testes de talas de queima.
Assim, esta electrólise inverte a combinação espontânea de H2 e O2 para formar H2O. Ao discutir as reacções redox, mencionamos vários agentes oxidantes, tais como os que são suficientemente fortes para oxidar o H2O. Ao mesmo tempo, descrevemos agentes redutores suficientemente fortes para reduzir o H2O, tais como os metais alcalinos e as terras alcalinas mais pesadas. Como regra geral, tais substâncias não podem ser produzidas por electrólise de soluções aquosas porque o H2O é oxidado ou reduzido em seu lugar. As substâncias que sofrem reacção redox espontânea com H2O são normalmente produzidas por electrólise de sais fundidos ou em algum outro solvente. Existem algumas excepções a esta regra, no entanto, porque algumas reacções de eléctrodos são mais lentas do que outras. Utilizando a Tabela 11.5, por exemplo, prevemos que o H2O é um agente redutor melhor que o Cl-.
Hence, seria de esperar que o O2, e não o Cl2, fosse produzido por electrólise de 1 M HCl, em contradição com a Equação {1}(|ref{1}}). Acontece que o O2 é produzido mais lentamente do que o Cl2, e este último borbulha fora de solução antes de o H2O poder ser oxidado. Por este motivo, a Tabela 1 encontrada na secção de Casais Redox nem sempre pode ser usada para prever o que acontecerá numa electrólise.
Contribuidores
- p>Ed Vitz (Universidade de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.
0 comentários