US Pharm. 2011;36(4):HS2-HS6.
Les neuropathies optiques sont des troubles du nerf optique impliquant une dégénérescence du nerf.1 La neuropathie optique ne doit pas être confondue avec la névrite optique. Les deux peuvent entraîner des problèmes de vision ; la névrite optique implique une inflammation du nerf optique tandis que la neuropathie optique fait référence à des dommages de toute origine. La névrite optique est l’une des nombreuses causes de la neuropathie optique.
Les neuropathies optiques peuvent être soit héréditaires, soit acquises. Les étiologies acquises de la neuropathie optique comprennent les types ischémique, nutritionnel et toxique.1,2 La neuropathie optique d’origine médicamenteuse est de type toxique. Les mécanismes de la neuropathie optique d’origine médicamenteuse comprennent le dysfonctionnement mitochondrial, la perturbation du flux sanguin vers le nerf optique et des mécanismes inconnus.2
Les symptômes courants de la neuropathie optique comprennent une diminution de la vision dans le champ central, qui est généralement bilatérale mais qui peut être unilatérale dans certains cas, des défauts du champ visuel et un gonflement du nerf optique.3 L’apparition est généralement lente et indolore2.
Dans la neuropathie optique d’origine médicamenteuse, le déchallenge (retrait) du médicament incriminé peut entraîner un soulagement des symptômes.3,4 Étant donné que bon nombre des médicaments connus pour provoquer une neuropathie optique sont des médicaments courants, il est important que les pharmaciens connaissent cet effet indésirable afin d’orienter les patients présentant ces symptômes en temps opportun et d’éviter des dommages supplémentaires et permanents.
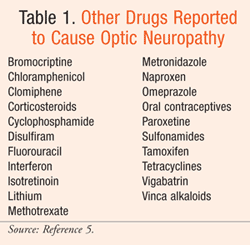
Médicaments pouvant causer une neuropathie optique
Plusieurs médicaments couramment prescrits ont été impliqués dans la neuropathie optique. Sont discutés ici les agents qui ont le plus d’informations à l’appui : les inhibiteurs de la phosphodiestérase de type 5 (PDE-5), l’amiodarone, le linézolide, l’éthambutol et l’isoniazide. D’autres médicaments signalés comme pouvant causer une neuropathie optique sont énumérés dans le TABLEAU 1.5
Inhibiteurs de la PDE-5 : Cette classe de médicaments a révolutionné le traitement de la dysfonction érectile (DE) chez l’homme. Il existe actuellement trois agents disponibles : le sildénafil (Viagra), le tadalafil (Cialis) et le vardénafil (Levitra). Ils exercent leur action en inhibant sélectivement la PDE de type 5. Considérés comme des agents de première ligne pour le traitement de la DE, ils sont très couramment prescrits, avec environ 40 millions d’hommes dans le monde traités pour des dysfonctionnements sexuels avec des inhibiteurs de la PDE-5.6 Bien que le sildénafil, le tadalafil et le vardénafil soient spécifiques de la PDE 5, il a été démontré que ces agents ont des effets inhibiteurs sur la PDE 6, une isoenzyme exprimée dans les bâtonnets et les cônes de l’œil. La théorie veut que l’inhibition de la PDE 6 soit à l’origine des nombreux troubles visuels associés à cette classe de médicaments.7-9 Les inhibiteurs de la PDE-5 représentent environ 19 % des rapports de la FDA sur les toxicités oculaires associées aux médicaments, ce qui en fait la classe de médicaments la plus fréquemment signalée comme étant associée à cette toxicité.10
NAION : La surveillance post-commercialisation a établi un lien entre les inhibiteurs de la PDE-5 et la neuropathie optique ischémique antérieure non artéritique (NAION). Cette relation potentielle a soulevé une controverse. Depuis 2000, au moins 20 rapports de cas ont été publiés dans la littérature décrivant l’utilisation d’inhibiteurs de la PDE-5 et la suspicion de NAION.11,12 La plupart des publications sont liées à l’utilisation du sildénafil, car il s’agit du premier agent de cette classe à être commercialisé (le sildénafil a été introduit en 1998, 5 ans avant le tadalafil et le vardénafil). A ce jour, il n’y a pas eu de rapports de cas publiés impliquant le vardénafil.
La NAION est un trouble oculaire assez rare dans la population générale qui survient soudainement, est généralement indolore et entraîne une perte partielle irréversible de la vision.11,13 Bien qu’il s’agisse de la neuropathie optique aiguë la plus fréquente chez les personnes de plus de 50 ans, seuls 1 500 à 6 000 cas sont signalés chaque année aux États-Unis.14 L’étiologie de la NAION n’est pas bien comprise, mais on pense qu’elle est causée par une insuffisance de l’apport sanguin au nerf optique. Un facteur de risque bien établi pour le développement de la NAION est présent chez les personnes qui ont une petite papille et une petite coupe physiologique ou son absence (c’est-à-dire lorsque le nerf optique est presque aussi grand que l’ouverture à l’arrière de l’œil et que la papille optique semble « encombrée »), également connue sous le nom de disque à risque ou disque encombré. Les autres facteurs de risque associés sont le diabète, l’hypertension, l’hypercholestérolémie, l’athérosclérose, les cardiopathies ischémiques, l’apnée du sommeil et l’hypotension nocturne. Nombre de ces facteurs de risque sont également associés à la DE.8,11
Parmi les cas de NAION rapportés, la plupart sont survenus dans les 24 heures suivant l’administration, généralement au réveil le matin. Les patients présentaient une vision floue et une perte du champ visuel.15 En outre, on a constaté que la plupart des patients présentaient un encombrement discal comme facteur de risque, ainsi que diverses maladies cardiovasculaires, qui sont considérées comme des facteurs de risque à la fois pour la NAION et la DE.
Dans une étude de cohorte rétrospective utilisant les bases de données pharmaceutiques et cliniques de la National Veterans Health Administration de 2004 à 2005, une cohorte de deux ans d’hommes (environ 4 millions) âgés d’au moins 50 ans sans antécédents de maladie du nerf optique a été évaluée.16 Environ 11,5 % de ces patients se sont vus délivrer un inhibiteur de la PDE-5 ; la majorité d’entre eux se sont vus prescrire du sildénafil 100 mg. Dans cette cohorte, 0,09 % des patients ont reçu un diagnostic de nouvelle neuropathie optique ischémique, avec un risque relatif de 1,02 (intervalle de confiance à 95 % , 0,92-1,12).
Une autre étude rétrospective a évalué 38 hommes atteints de NAION et les a comparés à 38 hommes sans antécédents de la maladie.17 Il n’y avait pas de différence globale marquée dans l’utilisation d’inhibiteurs de la PDE-5 dans l’un ou l’autre groupe ; cependant, une association significative a été observée pour les patients ayant des antécédents d’infarctus du myocarde et l’utilisation d’inhibiteurs de la PDE-5 et la survenue de NAION (P = 0,04). De même, l’incidence de la NAION était plus importante chez les patients ayant des antécédents d’hypertension et d’utilisation d’inhibiteurs de la PDE-5, bien que cela ne soit pas significatif (P = 0,07).17
Le mécanisme d’action de cet effet indésirable des inhibiteurs de la PDE-5 n’est pas tout à fait compris, et cela est en partie dû au fait que le mécanisme d’action pour le développement de la NAION n’est pas entièrement compris. Il a été suggéré que l’hypotension nocturne pouvait jouer un rôle dans le développement de la NAION, et que les inhibiteurs de la PDE-5 pouvaient renforcer cet effet, entraînant finalement une ischémie du nerf optique.12,13,18
L’incidence des cas de NAION chez les hommes utilisant des inhibiteurs de la PDE-5 dans le monde correspond à celle de la population générale américaine.14 L’Organisation mondiale de la santé (OMS) et la FDA ont identifié l’association de la NAION et des inhibiteurs de la PDE-5 comme une causalité « possible ». Un événement indésirable « possible » « se produit dans un délai raisonnable après l’administration du médicament, mais pourrait également être expliqué par une maladie concomitante ou d’autres médicaments ou produits chimiques. En 2005, la FDA a recommandé que l’étiquetage du produit soit mis à jour pour contenir une déclaration décrivant cette association temporelle avec l’utilisation des inhibiteurs de la PDE-5. A ce jour, il n’existe pas de preuves convaincantes suggérant que l’utilisation des inhibiteurs de la PDE-5 est associée à une incidence plus élevée de NAION.
Les patients qui ont connu un épisode de NAION devraient éviter d’utiliser des inhibiteurs de la PDE-5, car ces personnes peuvent être susceptibles de développer une NAION dans l’œil controlatéral13,19,20. Certains ophtalmologistes conservateurs peuvent également recommander d’éviter l’utilisation de ces agents chez les patients qui ont un petit disque à risque, un critère qui peut exiger que tous les patients subissent un examen ophtalmologique avant le début du traitement.13 Les patients qui utilisent des inhibiteurs de la PDE-5 doivent être informés du risque de développer une NAION. S’ils remarquent une perte de vision soudaine, ils doivent cesser d’utiliser l’inhibiteur de la PDE-5 et consulter immédiatement un médecin. Toutes les incidences doivent également être signalées à la FDA, y compris les informations sur la durée et la dose du médicament, le délai entre l’ingestion de l’inhibiteur de la PDE-5 et l’apparition des constatations, ainsi que les résultats de tout examen ophtalmologique.19
Amiodarone : Ce médicament, un antiarythmique de classe III utilisé principalement pour les arythmies ventriculaires, a été impliqué dans divers types de modifications de la vision, y compris des anomalies cornéennes, des effets conjonctivaux et une neuropathie optique, mais le mécanisme exact de la neuropathie optique est inconnu21. Des modifications visuelles ont été signalées avec une prévalence variable de 0 % à 11,4 % chez les patients prenant ce médicament ; une étude a révélé que la neuropathie optique se produisait chez 1,79 % des patients20. La neuropathie optique est généralement d’apparition insidieuse, prend des mois à se résorber et se présente de façon bilatérale.4,21,22 Il a été noté que la neuropathie optique induite par l’amiodarone est très similaire à la NAION, mais qu’elle en diffère en ce que la NAION est généralement d’apparition et de résolution rapides et de présentation unilatérale.4,21 Il est souvent difficile de distinguer la NAION de la neuropathie optique induite par l’amiodarone.20
Les informations relatives à la prescription de l’amiodarone recommandent des examens ophtalmiques réguliers, notamment au départ puis tous les 6 mois, pour les patients recevant le médicament4,23. Certains auteurs ont suggéré que des examens ophtalmologiques plus fréquents, tous les 4 mois jusqu’à un an après le début du traitement, pourraient être justifiés.21 En tant qu’agent antiarythmique, l’amiodarone n’est souvent pas interchangeable avec d’autres médicaments, et la décision de changer de traitement doit être prise en consultation avec l’ophtalmologiste et le cardiologue du patient.
Linézolide : Cet antibiotique de la famille des oxazolidinones est utilisé pour son efficacité contre les organismes à Gram positif, plus particulièrement le Staphylococcus aureus résistant à la méthicilline (SARM). Son innocuité globale a été démontrée dans des essais cliniques portant sur des traitements allant jusqu’à 28 jours. La neuropathie optique a été associée à l’utilisation à long terme du linézolide, avec des durées de traitement rapportées allant de 5 à 11 mois à des doses de 600 à 1200 mg/jour, bien en dehors des durées d’essais cliniques étudiées de 28 jours ou moins.4,24 Cependant, une littérature plus récente rapporte une neuropathie optique après une durée de traitement plus courte de seulement 16 jours.25,26
Les symptômes sont graduels, et il y a un début indolore de perte de vision bilatérale. L’arrêt du linézolide a entraîné une amélioration des symptômes visuels dans tous les cas rapportés. Le mécanisme de la neuropathie optique induite par le linézolide n’est pas connu, mais il pourrait être dû à une toxicité mitochondriale provenant de la liaison à l’ARNr 16S mitochondrial.27 Le linézolide pénètre bien dans le système nerveux central et dans l’œil, ce qui peut entraîner une neurotoxicité accrue.24,28 Le retrait du linézolide et le remplacement de la thérapie antibactérienne par un autre agent peuvent favoriser la guérison, bien que dans certains cas, la poursuite du linézolide puisse être nécessaire pour traiter adéquatement certaines infections.2 Des examens ophtalmologiques de base et périodiques sont recommandés pour les patients recevant un traitement au linézolide à long terme.4
Ethambutol : Ce médicament, un agent de première ligne dans le traitement et la prévention de la tuberculose, provoque de nombreux effets indésirables oculaires. Il est bien documenté qu’il provoque une neuropathie optique chez jusqu’à 5 % des patients qui prennent le médicament.2 Le mécanisme de cet effet indésirable n’est pas complètement clair, mais on a supposé qu’il était lié à la chélation du cuivre dans les cellules rétiniennes.4
La plupart des patients présentant cet effet indésirable avaient pris des doses de 60 à 100 mg/kg/jour, les symptômes apparaissant après 2 à 12 mois de traitement.4,29 La dose quotidienne d’éthambutol approuvée par la FDA dans le traitement de la tuberculose est de 15 à 25 mg/kg/jour. On pense que la neuropathie optique induite par l’éthambutol est liée à la dose ; elle survient à des taux de 18 % des patients à une dose de 35 mg/kg/jour, de 5 à 6 % à 25 mg/kg/jour et de moins de 1 % à 15 mg/kg/jour.30 Il est recommandé d’ajuster la posologie chez les patients souffrant d’insuffisance rénale, car une clairance inadéquate du médicament peut entraîner une toxicité oculaire supplémentaire.
La perte de vision associée à l’éthambutol a été couramment rapportée comme étant réversible ; cependant, elle peut être irréversible dans certaines populations, notamment les patients gériatriques et ceux qui ont reçu le médicament de façon chronique.30
L’éthambutol est contre-indiqué chez les patients ayant des antécédents de névrite optique, à moins que le jugement clinique ne justifie son utilisation31. Des examens oculaires de base et périodiques doivent être effectués ; les informations de prescription de l’éthambutol recommandent des examens mensuels pour les patients prenant >15 mg/kg/jour.31 Certains auteurs ont suggéré que des tests annuels pourraient être appropriés pour les patients prenant <15 mg/kg/jour, avec une surveillance plus fréquente pour ceux qui présentent un risque élevé de développer une neuropathie optique. Il s’agirait notamment des patients de plus de 60 ans ou de moins de 16 ans, de ceux souffrant d’une maladie rénale, d’alcoolisme ou de neuropathie périphérique, de ceux prenant plus de 15 mg/kg/jour ou d’un traitement de plus de 6 mois.Les patients présentant des symptômes de neuropathie optique doivent être évalués et le médicament doit être interrompu.
Isoniazide : Cet antibiotique est un autre médicament utilisé dans le traitement et la prévention de la tuberculose. On a rapporté qu’il provoquait une neuropathie optique ; cependant, comme l’isoniazide est utilisé en conjonction avec l’éthambutol, qui est également impliqué dans la neuropathie optique, il est souvent difficile de déterminer la cause des problèmes de vision20. La neuropathie optique induite par l’isoniazide serait moins fréquente et réversible2.
Traitement
Une évaluation ophtalmique rapide est primordiale, et cela, ainsi que l’arrêt du médicament incriminé lorsque cela est possible, constitue la base du traitement de la neuropathie optique d’origine médicamenteuse.4 Bien que l’arrêt du médicament soit souvent recommandé, cela n’est pas toujours possible, car des médicaments comme l’amiodarone, le linézolide et l’éthambutol peuvent être nécessaires pour traiter le patient de manière optimale. Dans ces circonstances, une surveillance attentive et des soins continus par un ophtalmologiste sont nécessaires.
Implications
De nombreux médicaments peuvent provoquer des effets indésirables oculaires, et les risques potentiels doivent être discutés avec les patients avant d’initier le traitement. Les pharmaciens sont dans la position unique d’être le fournisseur de soins de santé le plus accessible ; ils peuvent être ceux que les patients consulteront plus volontiers lorsqu’ils ressentiront des effets indésirables dus à leurs médicaments. Il n’est peut-être pas possible de connaître tous les effets indésirables oculaires induits par les médicaments, mais il est important de reconnaître que de nombreux médicaments systémiques peuvent affecter la santé oculaire. Une détection précoce peut potentiellement prévenir ou minimiser des dommages sérieux. Les pharmaciens doivent savoir que la plupart des patients souffrant de neuropathie optique d’origine médicamenteuse présenteront une baisse de la vision.2 Tout patient se plaignant d’une baisse soudaine et indolore de sa vision doit être invité à signaler immédiatement ces changements.
En plus de contacter la FDA et le fabricant du médicament, les pharmaciens peuvent signaler les cas suspects de neuropathie optique d’origine médicamenteuse au National Registry of Drug-Induced Ocular Side Effects (www.eyedrugregistry.com). Les informations qui seront utiles lors du signalement des effets indésirables oculaires comprennent le nom du médicament, la durée et la dose, le délai entre l’ingestion du médicament et l’apparition des constatations, ainsi que les résultats de tout examen ophtalmologique.
1. O’Neill EC, Danesh-Meyer HV, Connell PP, et al. La tête du nerf optique dans les neuropathies optiques acquises. Nat Rev Neurol. 2010;6:221-236.
2. Lloyd MJ, Fraunfelder FW. Neuropathies optiques d’origine médicamenteuse. Drugs Today. 2007;43:827-836.
3. Spiteri MA, James DG. Réactions oculaires indésirables aux médicaments. Postgrad Med J. 1983;59:343-349.
4. Li J, Tripathi RC, Tripathi BJ. Troubles oculaires induits par les médicaments. Drug Saf. 2008;21:127-141.
5. Kaakeh Y, Abel SR. Visual disturbances. In : Tisdale JE, Miller DA, eds. Drug-Induced Diseases : Prevention, Detection, and Management. 2e éd. Bethesda, MD : American Society of Health-Systems Pharmacists ; 2010 :
250-274.
6. Hatzimouratidis K, Hatzichristou D. Inhibiteurs de la phosphodiestérase de type 5 : le jour d’après. Eur Urol. 2007;51:75-89.
7. Lee M. Chapitre 86. Erectile dysfunction. In : DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy : A Pathophysiologic Approach. 7th ed. New York, NY : McGraw-Hill ; 2010. www.accesspharmacy.com/content.aspx?aID=3209583. Consulté le 24 février 2011.
8. Kerr NM, Danesh-Meyer HV. Les inhibiteurs de la phosphodiestérase et l’œil. Clin Experiment Ophthalmol. 2009;37:514-523.
9. Bischoff E. Puissance, sélectivité et conséquences de la non-sélectivité de l’inhibition de la PDE. Int J Impot Res. 2004;16(suppl 1):S11-S14.
10. Barbehenn E, Lurie P, Wolfe SM, et al. Pétition à la FDA pour exiger un avertissement boîte noire pour les médicaments contre la dysfonction érectile sildénafil (Viagra), tadalafil (Cialis), vardénafil (Levitra) pour avertir du potentiel de perte de vision irréversible. Public Citizen. 20 octobre 2005. www.citizen.org/hrg1753. Consulté le 24 février 2011.
11. Laties AM. Troubles de la vision et inhibiteurs de la phosphodiestérase de type 5 : un examen des preuves à ce jour. Sécurité des médicaments. 2009;32:1-18.
12. Danesh-Meyer HV, Levin HA. Médicaments contre la dysfonction érectile et risque de neuropathie optique ischémique antérieure : association fortuite ou causale ? Br J Ophthalmol. 2007;91:1551-1555.
13. Carter JE. Neuropathie optique ischémique antérieure et accident vasculaire cérébral avec l’utilisation d’inhibiteurs de la PDE-5 pour la dysfonction érectile : cause ou coïncidence ? J Neurol Sci. 2007;262:89-97.
14. Gorkin L, Hvidsten, Sobel RE, et al. L’utilisation du citrate de sildénafil et l’incidence de la neuropathie optique ischémique antérieure non artéritique. Int J Clin Pract. 2006;60:500-503.
15. Pomeranz HD, Bhavsar AR. Neuropathie optique ischémique non artéritique se développant peu après l’utilisation du sildénafil (Viagra) : un rapport de sept nouveaux cas. J Neurol Ophthalmol. 2005;25:9-13.
16. Margo CE, French DD. Ischemic optic neuropathy in male veterans prescribed phosphodiesterase-5 inhibitors. Am J Ophthalmol. 2007;143:538-539.
17. McGwin G, Vaphiades MS, Hall TA, et al. Neuropathie optique ischémique antérieure non artéritique et traitement de la dysfonction érectile. Br J Ophthalmol. 2006;90:154-157.
18. Fraunfelder FW. Effets secondaires visuels associés aux agents de dysfonctionnement érectile. Am J Ophthalmol. 2005;140:723-724.
19. McKoy JM, Bolden CR, Samaras A, et al. Sildenafil- et tadalafil-associated optic neuropathy : implications for men after prostate cancer treatment. Community Oncol. 2009;6:78-79.
20. Santaella RM, Fraunfelder FW. Effets indésirables oculaires associés aux médicaments systémiques. Médicaments. 2007;67:75-93.
21. Johnson LN, Krohel GB, Thomas ER. The clinical spectrum of amiodarone-associated optic neuropathy. J Nat Med Assoc. 2004;96:1477-1491.
22. Mantyjarvi M, Tuppurainen K, Ikaheimo K. Ocular side effects of amiodarone. Surv Ophthalmol. 1998;42:360-366.
23. Cordarone (amiodarone HCl) notice d’emballage. Philadelphie, PA : Wyeth Pharmaceuticals, Inc ; décembre 2010.
24. Jahaveri M, Khurana RN, O’Hearn TM, et al. Linezolid-induced optic neuropathy : a mitochondrial disorder ? Br J Ophthalmol. 2007;91:111-115.
25. Azamfirei L, Copotoiu SM, Branzaniuc K, et al. Complete blindness after optic neuropathy induced by short-term linezolid treatment in a patient suffering from muscle dystrophy. Pharmacoepidemiol Drug Saf. 2007;16:402-404.
26. Joshi L, Taylor SR, Large O, et al. A case of optic neuropathy after short-term linezolid use in a patient with acute lymphocytic leukemia. Clin Infect Dis. 2009;48:e73-e74.
27. Narita M, Tsuji BT, Yu VL. Linezolid-associated peripheral and optic neuropathy, lactic acidosis, and serotonin syndrome. Pharmacothérapie. 2007;27:1189-1197.
28. Rucker JC, Hamilton SR, Bardenstein D, et al. Linezolid-associated toxic optic neuropathy. Neurologie. 2006;66:595-598.
29. Melamud A, Kosmorsky GS, Lee MS. Toxicité oculaire de l’éthambutol. Mayo Clin Proc. 2003;78:1409-1411.
30. Kokkada SB, Barthakur R, Natarajan M, et al. Ocular side effects of antitubercular drugs-a focus on prevention, early detection and management. Kathmandu Univ Med J. 2005;3:438-441.
31. Notice d’utilisation du myambutol (éthambutol). Northport, NY : X-Gen Pharmaceuticals, Inc ; mai 2007.
0 commentaire