Définition
Lancet. 2012 7 avril;379(9823):1341-51.
Am J Respir Crit Care Med. 15 sept. 2007;176(6):532-55.
La BPCO est une maladie caractérisée par une limitation persistante du débit d’air qui est habituellement progressive et associée à une réponse inflammatoire chronique accrue dans les voies respiratoires et le poumon à des particules ou des gaz nocifs.
Asthme vs BPCO
Asthme = rétrécissement des voies respiratoires entièrement réversible
MPOC. = rétrécissement des voies respiratoires non entièrement réversible
La BPCO peut être divisée en 2 phénotypes cliniques : l’emphysème et la bronchite chronique.
- L’emphysème est défini pathologiquement comme un élargissement des espaces aériens distaux.
- La bronchite chronique est définie cliniquement comme une toux productive d’expectorations survenant la plupart des jours pendant 3 mois consécutifs sur 2 années consécutives.
Étiologie
- Lancet. 2012 Apr 7;379(9823):1341-51.
- Am J Respir Crit Care Med. 15 sept. 2007;176(6):532-55.
- Lancet. 2009 Aug 29;374(9691):733-43.
De nombreux facteurs contribuent au développement de la BPCO, notamment des facteurs génétiques comme le déficit en alpha1-antitrypsine, les expositions professionnelles aux poussières et aux produits chimiques, la pollution, les infections respiratoires dans l’enfance et la fumée de cigarette.
| Etiologie | Mécanisme(s) |
| Fumée de cigarette fumée | La présence de particules de fumée dans les poumons entraîne une réponse inflammatoire avec une augmentation de l’infiltration des macrophages et des neutrophiles dans les poumons. Ces cellules immunitaires libèrent des cytokines, des chimiokines et des élastases, ce qui endommage le parenchyme pulmonaire au fil du temps. |
| Expositions professionnelles à la poussière et aux produits chimiques | L’étiologie n’est pas claire, mais on suppose qu’il s’agit d’une réponse inflammatoire similaire qui endommage les alvéoles. |
| Déficience en alpha-1 antitrypsine | L’alpha-1 antitrypsine est un inhibiteur de la sérine protéase (SERPIN) sécrété par le foie dans le sang qui empêche l’enzyme élastase neutrophile d’endommager le tissu pulmonaire. La déficience de cette alpha-1 antitrypsine entraîne une élastolyse sans opposition (destruction des fibres d’élastine dans les parois alvéolaires) et le développement d’un emphysème précoce. C’est l’hypothèse protéase-antiprotéase du développement de l’emphysème. |
| Utilisation chronique de drogues par voie intraveineuse | Les utilisateurs de drogues par voie intraveineuse de cocaïne, de méthadone et d’héroïne ont un risque plus élevé de développer une BPCO ; ceci est attribué aux dommages vasculaires induits par la charge insoluble (amidon de maïs, cellulose, talc, fibres, etc.) que l’on trouve dans les drogues par voie intraveineuse. |
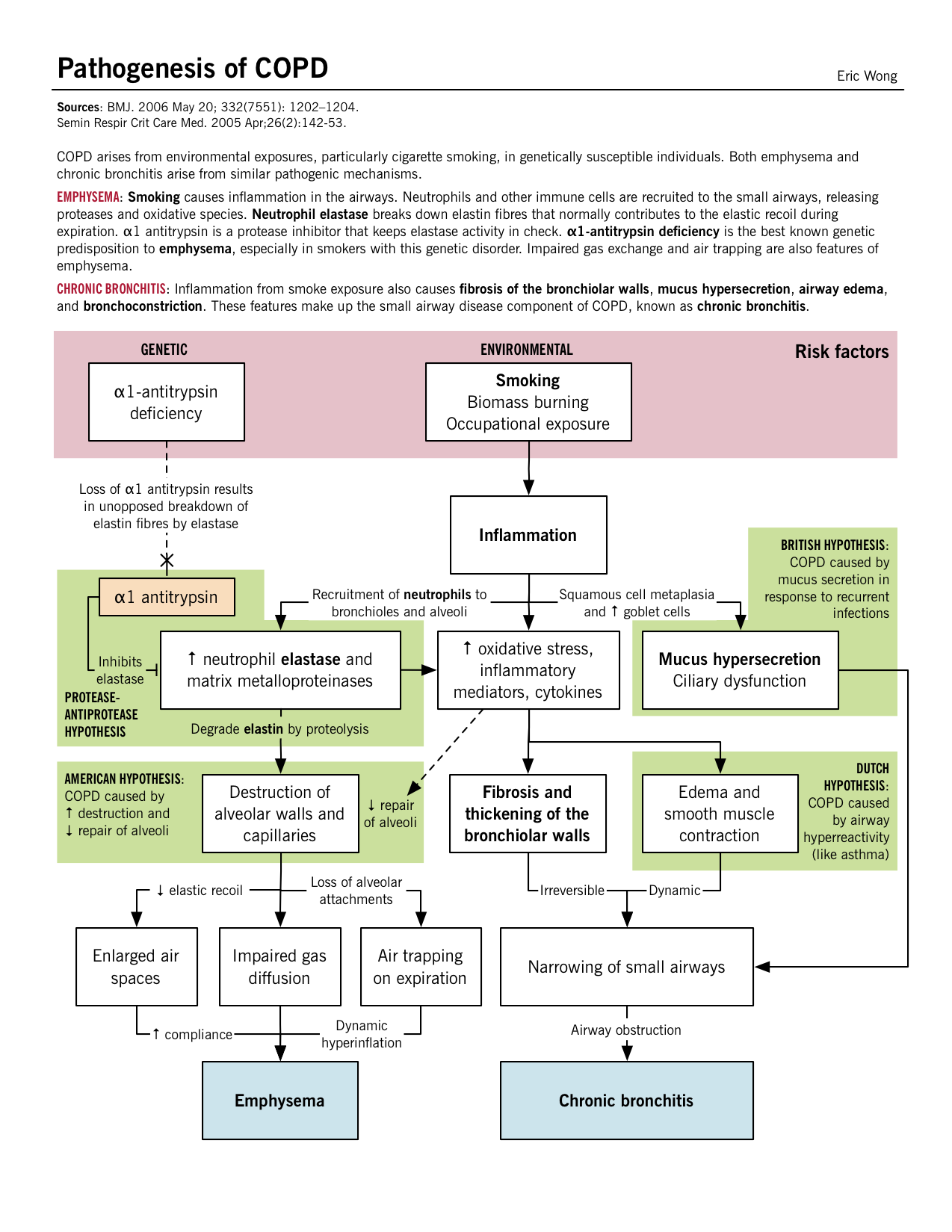
Pathogenèse, physiopathologie et caractéristiques cliniques
BMJ. 2006 May 20 ; 332(7551) : 1202-1204.
Bien qu’une décomposition de la BPCO en emphysème et bronchite chronique soit utile, généralement les patients présentent des caractéristiques et des résultats de chacun d’eux et ne peuvent être simplement classés.
| Emphysème | Bronchite chronique | |
|
Pathogenèse Am J Respir Cell Mol Biol. 2005 May;32(5):367-72. |
La réponse inflammatoire, médiée par les neutrophiles, les macrophages et les cellules T CD8+, libère des médiateurs inflammatoires et des enzymes qui endommagent le parenchyme pulmonaire. Les protéases comme l’élastase et les métalloprotéinases matricielles (MMP) libérées par ces cellules inflammatoires dégradent le tissu conjonctif des parois alvéolaires et des septums. Une perte de recul élastique entraîne une diminution des débits expiratoires, un piégeage de l’air et un effondrement des voies aériennes. | L’hypertrophie des glandes muqueuses, l’hyperplasie des cellules gobelets et le dysfonctionnement mucociliaire se produisent dans les voies aériennes plus larges, entraînant une production et une accumulation excessives de mucus réduisant la lumière des voies aériennes.Bien que ces changements pathologiques dans les grandes voies aériennes, il semble que le site principal de l’augmentation de la résistance des voies aériennes soit les petites voies aériennes (≤ 2mm). Une fibrose et une hypertrophie des muscles lisses peuvent se produire ainsi qu’une production excessive de mucus et une infiltration cellulaire dans les voies aériennes périphériques. |
|
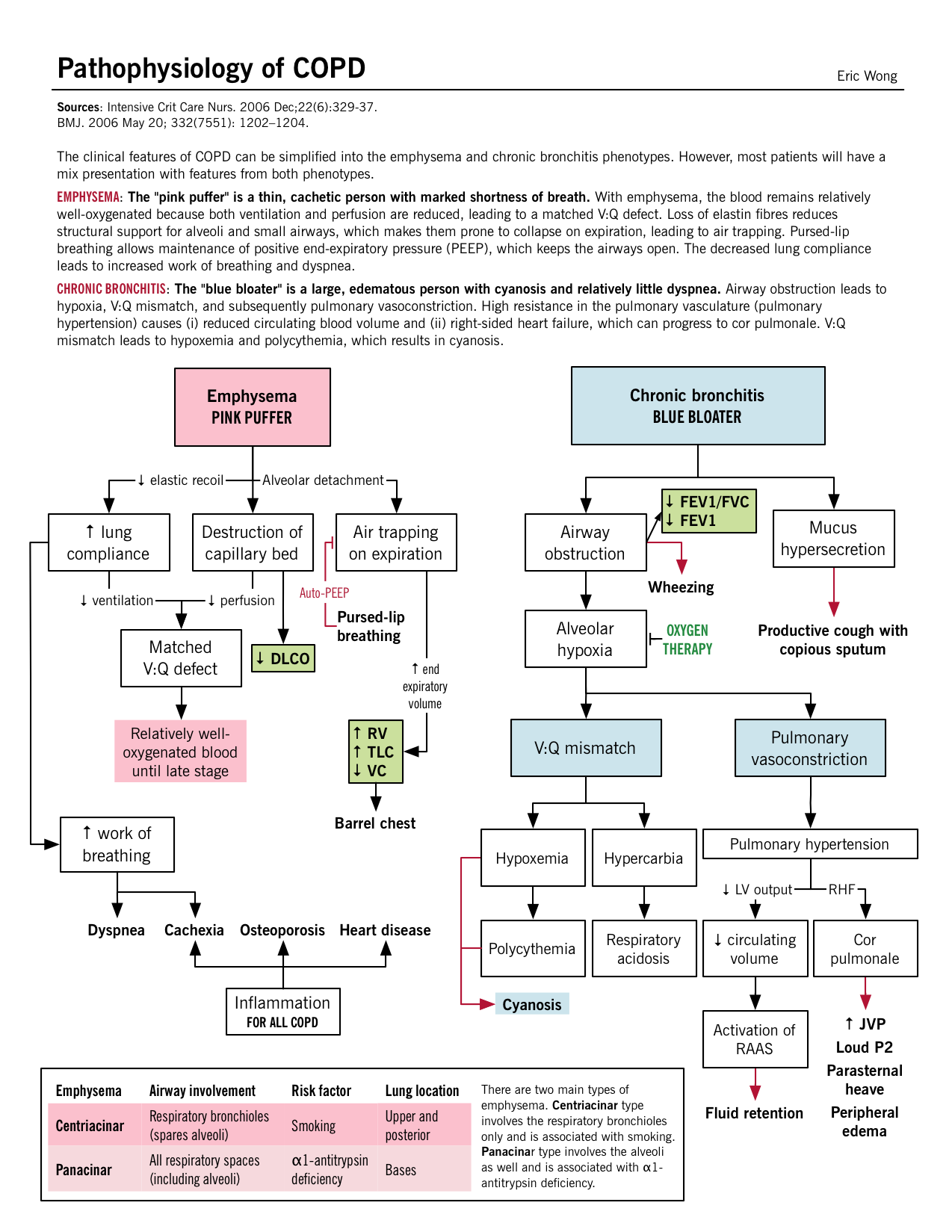
Pathophysiologie BMJ. 20 mai 2006 ; 332(7551) : 1202-1204. |
Destruction du parenchyme : Les dommages récurrents aux alvéoles finissent par entraîner une destruction septale en même temps que le lit capillaire également. Défaut de V/Q apparié : Comme les bronchioles terminales et les alvéoles ainsi que le lit capillaire ont été détruits, il existe un défaut apparié entre la ventilation et la perfusion ; les zones de faible ventilation ont également une mauvaise perfusion. Hypoxie légère : Malgré le défaut V/Q » apparié « , une hyperventilation excessive se développe et le débit cardiaque (CO) diminue, ce qui entraîne des zones de faible débit sanguin dans des zones relativement bien oxygénées. En raison de ce faible CO, le reste du corps souffre d’hypoxie tissulaire. Cachexie : Au niveau pulmonaire, le faible CO entraîne une cachexie pulmonaire ; ce qui induit une perte de poids et une fonte musculaire. Cela donne à ces patients l’aspect caractéristique de » bouffeur de rose « . |
Inflammation des petites voies respiratoires : Les mécanismes évoqués ci-dessus entraînent une inflammation dans les petites bronchioles et les sécrétions de mucus rétrécissent encore plus la lumière des voies respiratoires. Malgré cela, le parenchyme est relativement moins endommagé. Mécanisme V/Q : La réponse physiologique entraîne une baisse de la ventilation et une compensation avec l’augmentation du CO. Une augmentation de la perfusion dans les zones de mauvaise ventilation a lieu, provoquant finalement une hypoxie et une polyglobulie secondaire. Sévère hypoxie et hypercarbie : Le décalage V/Q chronique entraîne une diminution de l’oxygénation/désoxygénation du sang, ce qui entraîne une hypoxémie et une augmentation de la rétention de CO2 (une acidose respiratoire s’ensuit). Hypertension pulmonaire et cor pulmonaire : L’hypercapnie chronique et l’acidose respiratoire entraînent une vasoconstriction artérielle dans les poumons. Avec l’accumulation de pression rétrograde, les pressions du ventricule droit continuent d’augmenter et finissent par provoquer une insuffisance du VR. Autrement, on parle de cor pulmonaire. |
| Signes/symptômes cliniques |
« Pouffeur rose » – type A Dyspnée/tachypnée constante sévère (« pouffement ») : Probablement liée à l’augmentation du volume expiratoire final (diminution du recul), rendant chaque respiration moins efficace. Les patients utilisent des muscles accessoires (position tripode) et respirent plus rapidement (hyperventilation) pour compenser la sensation de ventilation insuffisante. La dyspnée est également liée à la fatigue des muscles respiratoires due à une utilisation accrue ainsi qu’à l’aplatissement du diaphragme qui altère sa fonction. Toux légère : l’irritation des petites voies respiratoires peut entraîner la production de toux. Non cyanotique (« rose ») : Défaut V:Q apparié ; pas d’hypoxémie. Minceur/cachexie : Perte de muscle squelettique et de graisse sous-cutanée due à un apport oral inadéquat ainsi qu’à des niveaux élevés de cytokines inflammatoires (TNF-α) qui provoquent cette cachexie. Diminution des bruits respiratoires à l’auscultation : L’hyperinflation des alvéoles et la destruction de l’architecture alvéolaire entraînent une diminution de la résistance des voies respiratoires. |
« Ballon bleu » – type B Production d’expectoration copieuse : Quantité élevée d’expectorations produites par les cellules gobelets. Voir Pathogénie ci-dessus. Toux : Irritation des récepteurs de la toux, par le mucus, dans les petites et les grandes voies respiratoires. Cyanotique (« bleu ») : Le défaut d’appariement V/Q entraîne une oxygénation inadéquate du sang ; plus marqué au niveau des lèvres et du lit des ongles. Surcharge de volume (« ballonnement ») : Provenant très probablement de l’insuffisance du ventricule droit (VD), connue sous le nom de cor pulmonaire. Souffle à l’auscultation : Due à une obstruction des voies respiratoires. Par rapport à l’asthme, il y a moins de bronchospasme et plus de mucus/hypertrophie dans la BPCO. Le rhonchi est un gargouillement qui peut être entendu en raison de l’hypersécrétion de mucus dans les voies respiratoires. |
Exacerbations
N Engl J Med. 2012 Jul 26;367(4):340-7.
Plusieurs études ont montré un certain lien entre la colonisation bactérienne des voies aériennes supérieures et inférieures des patients et les exacerbations aiguës de la BPCO. De plus, les exacerbations semblent coïncider avec l’augmentation des infections virales respiratoires aiguës (grippe, parovirus, etc.). Les agents pathogènes introduisent de nouveaux antigènes dans les voies respiratoires et le parenchyme, ce qui induit la sécrétion de chimiokines (TNF-α et IL-6, IL-8, etc.) et de leucotriènes, tant par les macrophages des voies respiratoires que par l’épithélium, qui recrutent des neutrophiles. Ces neutrophiles, ainsi que d’autres cellules immunitaires, sécrètent des protéases et d’autres milieux qui enflamment davantage les voies respiratoires et détruisent l’épithélium bronchique, entraînant une exacerbation clinique.
Traitement
- Am J Respir Crit Care Med. 2013 Feb 15;187(4):347-65.
- Lancet. 2012 Apr 7;379(9823):1341-51.
- N Engl J Med. 2012 Jul 26;367(4):340-7.
L’arrêt du tabac
L’arrêt du tabac ralentit significativement la progression du déclin de la fonction pulmonaire et réduit la mortalité de 18%. Il s’agit de l’intervention la plus efficace et la plus importante dans la BPCO.
Bronchodilatateurs
Les β2-agonistes en inhalation (par exemple le salbutamol à courte durée d’action ou le salmétérol à longue durée d’action) agissent sur les récepteurs β2 des cellules musculaires lisses pour provoquer une bronchodilatation. Les anticholinergiques inhalés (par exemple l’ipratropium à courte durée d’action ou le tiotropium à longue durée d’action) agissent pour bloquer l’effet de l’acétylcholine sur les récepteurs muscariniques des cellules musculaires lisses, permettant ainsi une bronchodilatation. Les β2-agonistes et les anticholinergiques inhalés sont utilisés à la fois pour le traitement symptomatique et pour les exacerbations aiguës de la BPCO. Les bronchodilatateurs à longue durée d’action sont préférés aux bronchodilatateurs à courte durée d’action en raison de la diminution des doses et de l’amélioration de la gestion des symptômes. Pour un traitement plus efficace de la BPCO stable, une thérapie combinée utilisant un β2-agoniste inhalé et un anticholinergique peut également être utilisée.
Corticostéroïdes
Les stéroïdes suppriment la réponse inflammatoire en inhibant les facteurs de transcription, notamment le facteur nucléaire-κB, qui régulent la transcription de diverses cytokines, chimiokines, molécules d’adhésion et autres protéines qui induisent et perpétuent l’inflammation. Les corticostéroïdes inhalés ne sont pas utilisés pour le traitement des exacerbations de la BPCO ; toutefois, ils ont été utilisés dans le traitement à long terme de la BPCO chez une minorité de patients atteints de BPCO stable qui présentent des exacerbations fréquentes et une réversibilité des bronchodilatateurs. Il est recommandé d’utiliser les corticostéroïdes systémiques lors d’une exacerbation aiguë nécessitant une hospitalisation.
Oxygène
Cochrane Database Syst Rev. 2005 Oct 19 ;(4):CD001744.
L’oxygénothérapie est fréquemment fournie avec des interventions pharmacologiques pour traiter l’hypoxémie sous-jacente chez les patients atteints de BPCO. En réduisant l’hypoxie dans les alvéoles, la vasoconstriction pulmonaire est réduite. La réduction de l’hypertension pulmonaire diminue la postcharge du cœur droit et améliore la fonction systolique du cœur droit. L’oxygène réduit également l’hypoxémie dans le sang, ce qui diminue le risque de développer une polyglobulie. Cependant, il a été démontré que l’oxygénothérapie ne réduit la mortalité que chez les personnes présentant une hypoxémie sévère (PaO2 < 55mmHg) ; dans le cas contraire, il n’y a pas de bénéfice en termes de mortalité.
Réhabilitation pulmonaire
Chest. 2007 May;131(5 Suppl):4S-42S.
Le but de la réadaptation pulmonaire est d’améliorer la qualité de vie et le fonctionnement quotidien des patients atteints de BPCO. Par l’intermédiaire d’une équipe multidisciplinaire, les patients sont généralement inscrits à un programme de 6 à 12 semaines qui comprend un entraînement à l’exercice, un soutien psychosocial, une amélioration de la nutrition et une éducation. De nombreuses études (voir la référence Chest) ont montré une amélioration de la capacité d’exercice, une meilleure qualité de vie et une diminution des hospitalisations. Cependant, la mortalité reste inchangée.
Lung volume reduction surgery (LVRS)
Ann Thorac Surg. 2006 Aug;82(2):431-43.
LVRS est une option chirurgicale qui améliore la survie des patients atteints de BPCO avec un emphysème du lobe supérieur et une faible capacité d’exercice post-réhabilitation. L’intervention consiste à réséquer des parties du poumon malade. Cela a deux effets physiologiques principaux : (1) elle réduit l’hyperinflation, permettant au diaphragme de se contracter à sa force optimale, et (2) elle améliore le recul du poumon car les parties inélastiques du poumon sont réséquées.
0 commentaire