COVID-19, scatenata dal betacoronavirus SARS-CoV-2, è diventata una delle peggiori pandemie del nostro tempo, causando un’alta incidenza di polmonite, sindrome da distress respiratorio acuto (ARDS) e morte3,4. Una delle caratteristiche più notevoli dell’infezione da SARS-CoV-2 è che passa inosservata per un periodo di tempo notevolmente prolungato, con un decorso di malattia lieve o non complicata per settimane, fino a quando in un sottogruppo di pazienti si sviluppano sintomi improvvisi e gravi, che richiedono l’ospedalizzazione, il supporto di ossigeno e/o il ricovero in un’unità di terapia intensiva (ICU)3,4. Questo scenario è coerente con un periodo di incubazione insolitamente lungo del virus, che va da 2 a 14 d e una presenza insolitamente lunga del virus nel tratto respiratorio, spesso rilevabile per oltre un mese dopo l’infezione iniziale da test diagnostici molecolari convenzionali5,6. In confronto, l’infezione da virus dell’influenza, il principale virus respiratorio che rappresenta i ricoveri di polmonite fino ad ora, ha un tempo di incubazione di 1 a 4 d, una breve finestra di positività del virus di pochi giorni e un brusco inizio dei sintomi che causano polmonite entro 1-3 d7,8. Altri virus respiratori frequenti come i virus respiratori sinciziali, i rinovirus, i virus parainfluenzali, i metapneumonovirus e i comuni coronavirus del raffreddore hanno anche tempi di incubazione più brevi (che vanno da 1 a 5 d) e una manifestazione più rapida e acuta dei sintomi9, rendendo la SARS-CoV-2 abbastanza unica sotto questo aspetto. La base di questa differenza è sconosciuta, ma è probabile che sia un fattore chiave della fisiopatologia della COVID-19 che sta alla base del suo particolare decorso della malattia e delle sue manifestazioni cliniche.
Il segno distintivo della COVID-19 è lo sviluppo di una risposta iper-infiammatoria, nota anche come “tempesta di citochine”, che compromette la funzione di scambio dei gas e porta all’ARDS, all’insufficienza multiorgano e alla morte10,11,12. Noi e altri abbiamo precedentemente dimostrato che una risposta antivirale finemente sintonizzata, orchestrata da IFN-λ (IFN di tipo III) e IFN di tipo I è fondamentale per bilanciare l’immunità per una protezione ottimale e danni minimi13,14,15. La deviazione da questo equilibrio può scatenare una dannosa “tempesta di citochine” con conseguenze devastanti per la salute umana. Uno studio recente ha suggerito che nei pazienti con COVID-19, l’IFN di tipo I e l’IFN-λ non sono prodotti in quanto non potevano essere rilevati nei sieri di una piccola coorte COVID-19 con caratteristiche cliniche altrimenti non specificate16. Al contrario, un altro studio ha riportato che l’IFN di tipo I è indotto nei pazienti con COVID-19 e ha indicato che la sua concentrazione potrebbe essere ridotta in quelli che sono gravemente malati17. Tale discrepanza potrebbe essere dovuta al fatto che ognuno di questi studi si concentra su una singola e probabilmente distinta istantanea di un processo di malattia apparentemente eterogeneo. Pertanto, perseguire analisi cinetiche è pertinente a delineare il corso della risposta immunitaria, soprattutto dato che le citochine sono prodotte transitoriamente. Questo criterio è particolarmente vero per IFNs, che sono espressi presto durante l’infezione e sono rapidamente downregulated in seguito.
Qui, abbiamo eseguito un’analisi temporale completa di tipo I e tipo III IFNs e modelli principali citochine infiammatorie in 32 pazienti con COVID-19 e 16 pazienti con influenza ricoverati per polmonite acquisita in comunità e longitudinalmente seguita secondo le attuali linee guida dell’Organizzazione mondiale della sanità18. Entrambi i gruppi di pazienti hanno mostrato caratteristiche clinicopatologiche simili e la gravità della malattia comparabile all’ammissione (Tabella 1 supplementare). Abbiamo anche analizzato 24 pazienti con casi più lievi di influenza senza reperti radiologici di polmonite e senza necessità di ricovero (indicati come influenza lieve; Tabella supplementare 1), così come 10 individui sani. Utilizzando Luminex ad alta sensibilità e saggi ELISA, abbiamo quantificato 18 citochine e chemochine rilevanti per l’immunità antivirale e l’iperinfiammazione nel siero dei pazienti raccolto a intervalli di tempo definiti dopo il ricovero in ospedale (Fig. 1a e Extended Data Fig. 1a). Questa analisi allinea i pazienti sulla base degli stessi criteri clinici di sintomi e gravità della malattia, principalmente la presenza di polmonite e la richiesta di supporto di ossigeno.

a, Schema che mostra il disegno sperimentale con campionamento a intervalli di tempo specifici dopo il ricovero in ospedale di 32 pazienti con COVID-19 e 16 pazienti con influenza con polmonite seguita longitudinalmente. Le linee tratteggiate indicano il tempo della prima e ultima insorgenza della malattia critica, rispettivamente. b, livelli sierici di IFN-λ1, IFN-α, IFN-γ, TNF, IL-6, IL-7, IL-8, IL-10 e CCL3 a vari intervalli di tempo dopo il ricovero in ospedale. I dati sono presentati come diagrammi di dispersione con punti che mostrano le misure dei singoli pazienti, le colonne i valori mediani e le barre di errore l’intervallo. Per COVID-19, n = 16, 17, 21, 15, 11 e 8 per ciascuno dei sei intervalli di tempo consecutivi. Per l’influenza, n = 16, 14 e 11, rispettivamente. Per il sano, n = 10. L’ombreggiatura grigia segna il limite di quantificazione del test. I valori P sono stati determinati da un test Mann-Whitney U a due code per confronti non parametrici. *P < 0,05, **P < 0,01 e ***P < 0,001 mostrano la significatività rispetto ai controlli sani. #P < 0.05, ##P < 0.01 e ###P < 0.001 mostrano significatività tra i gruppi COVID-19 e influenza.
Abbiamo scoperto che i pazienti con COVID-19 avevano un’induzione profondamente compromessa sia di IFN-λ che di IFN di tipo I. IFN-λ e IFN di tipo I non erano rilevabili nella maggior parte dei pazienti con COVID-19 (con livelli mediani al limite di quantificazione del saggio), anche se alcuni pazienti hanno fatto IFN-λ e meno di loro anche IFN-α (Fig. 1b). Questa osservazione contrasta con i pazienti con influenza che hanno espresso quasi uniformemente entrambi i tipi di IFN, entro il primo (giorno 1-3) intervallo di tempo di ammissione e a concentrazioni significativamente più elevate. In tutti i casi, l’espressione di IFN era transitoria, con i livelli di IFN di tipo I che diminuivano rapidamente dopo i primi 3 giorni di ricovero, mentre IFN-λ persisteva più a lungo. In particolare, nonostante la loro limitata capacità di fare IFN, i pazienti con COVID-19 robustamente espresso citochine pro-infiammatorie come TNF, IL-6, IL-7, IL-8, IL-10, IFN-γ e CCL3 che sono stati mantenuti ad alte concentrazioni per un tempo prolungato (Fig. 1b). Altre citochine come IL-1β, IL-12, IL-23 e CCL4 sono state anche significativamente aumentate in intervalli di tempo specifici rispetto agli individui sani, riflettendo l’eterogeneità del decorso della malattia (Dati estesi Fig. 2).
Un modello simile è emerso quando i confronti sono stati fatti secondo l’inizio dei sintomi della malattia (Dati estesi Fig. 1b). I pazienti con COVID-19 hanno mostrato livelli di IFN-λ e IFN di tipo I marcatamente ritardati e ridotti, che erano rilevabili solo in una frazione dei pazienti e a partire dai giorni 7-10 dall’inizio dei sintomi (Dati estesi Fig. 3a,b). In confronto, tutti i pazienti con l’influenza hanno mostrato alti livelli di queste citochine durante i primi 6 giorni (Dati estesi Fig. 3a,b). Anche se i pazienti con COVID-19 hanno prodotto poco IFN durante i primi 6 giorni dall’inizio dei sintomi, hanno prodotto potentemente citochine pro-infiammatorie e chemochine come TNF, IL-6, IL-8, IL-10 e CCL3 a concentrazioni simili all’influenza (Dati estesi Fig. 3b,c). Inoltre, hanno esibito l’espressione prolungata di mediatori pro-infiammatori, con alte concentrazioni di TNF, IL-6, IL-7, IL-8, IL-10 e CCL4 rimanendo rilevabile per oltre 3 settimane di esordio, mentre nei pazienti con influenza un certo numero di questi erano da quel momento downregulated.
In particolare, i pazienti con COVID-19 sono stati ricoverati in ospedale con marcatori simili di infiammazione sistemica, come le concentrazioni di proteina C-reattiva (CRP), la conta dei globuli bianchi (WBC) e dei neutrofili e il rapporto neutrofili/linfociti (N/L) dei pazienti con influenza (Tabella 1 supplementare e Dati estesi Fig. 4a-f). Avevano anche una febbre più bassa e un punteggio CURB-65 più basso, una misura comunemente usata della gravità della polmonite19 (Dati estesi Fig. 4g,h). Tuttavia, durante il follow-up, i pazienti con COVID-19 hanno sviluppato un’incidenza molto più alta di ARDS che richiedeva il supporto dell’ICU. Nella nostra coorte, 16 dei 32 pazienti (50%) hanno sviluppato una malattia critica, 3 dei quali sono morti, rispetto a solo 3 dei 16 pazienti con influenza (18,7%), nessuno dei quali è morto (Dati estesi Fig. 5). I pazienti con COVID-19 si sono ammalati in modo critico in una finestra temporale molto più ampia (con l’esordio del primo paziente al giorno 1 e l’ultimo al giorno 9 dopo il ricovero in ospedale; Fig. 1a e Dati estesi Fig. 5) rispetto ai pazienti con influenza, che hanno manifestato la malattia critica entro il primo giorno dal ricovero. Questo risultato è in accordo con l’alta incidenza e il corso prolungato dell’insufficienza respiratoria grave descritto per COVID-19 (rif. 4,12). È interessante notare che tra i pazienti con COVID-19, quelli che si sono ammalati in modo critico avevano più alte concentrazioni di CRP, conta dei WBC e dei neutrofili e rapporto N/L all’ammissione (Dati estesi Fig. 4a-f), ma non CURB-65 o febbre (Dati estesi Fig. 4g,h e Tabella supplementare 2). I pazienti critici con l’influenza avevano anche una tendenza a conteggi più alti di WBC e neutrofili, rapporto N/L e CURB-65, mentre i pazienti non ospedalizzati con l’influenza non hanno mostrato nessuno di questi aumenti (Dati estesi Fig. 4a-h).
Abbiamo quindi esaminato se i modelli temporali delle citochine differiscono tra i vari gruppi di pazienti. In particolare, abbiamo osservato che anche se i pazienti con COVID-19 che non si sono ammalati criticamente hanno prodotto poco IFN di tipo I o III, quelli che si sono ammalati criticamente avevano livelli di IFN-λ che erano significativamente più alti nell’intervallo di tempo del giorno 1-3 rispetto ai pazienti sani e non malati criticamente (Fig. 2a). Alcuni dei malati critici hanno anche prodotto IFN-α (Fig. 2a), anche se in quantità significativamente inferiori rispetto ai pazienti non ospedalizzati con influenza lieve (Fig. 2a) o al totale dei pazienti ospedalizzati con influenza (sia malati critici che non critici; P < 0,05). Al contrario, tutti i pazienti con COVID-19 hanno prodotto citochine pro-infiammatorie come TNF, IL-6, IL-8, IL-10 e IFN-γ, con i pazienti criticamente malati che esibiscono anche concentrazioni significativamente più elevate di IL-6 e IL-7 rispetto ai pazienti non criticamente malati a intervalli di tempo specifici e una tendenza per una maggiore IFN-γ, coerente con l’aumentato stato iper-infiammatorio in cui si trovavano (Fig. 2a e Extended Data Fig. 6). I dati dei singoli pazienti hanno ulteriormente confermato queste tendenze (Dati estesi Fig. 7). CCL3 era significativamente più alto rispetto ai controlli sani nei pazienti non gravemente malati con COVID-19, ma non in quelli che erano gravemente malati (Fig. 2a). In confronto, i pazienti criticamente malati e non criticamente malati con l’influenza non differivano nella loro capacità di fare tipo I e tipo III IFNs né citochine pro-infiammatorie come TNF, IL-6 o IL-7 (Fig. 2a e Extended Data Fig. 6). Allo stesso modo, i pazienti non ospedalizzati con influenza con malattia lieve hanno esibito una forte produzione di IFN di tipo I e di tipo III, indicando che attraverso lo spettro della gravità della malattia influenzale la risposta antivirale rimane robusta. Hanno anche esibito una produzione simile di citochine pro-infiammatorie come TNF, IL-6, IL-7, IL-8 e IFN-γ ma livelli più alti di CCL3 rispetto ai pazienti ospedalizzati con influenza non critici o critici. La visualizzazione di questi modelli su un grafico radar rivela un importante squilibrio nell’induzione di risposte antivirali e pro-infiammatorie dei pazienti con COVID-19 che non si verifica nell’influenza (Fig. 2b).

a, livelli sierici di IFN-λ1, IFN-α, IFN-γ, TNF, IL-6, IL-7, IL-8, IL-10 e CCL3 per i pazienti critici e non critici con COVID-19 e influenza e per i pazienti non ospedalizzati con influenza lieve nei giorni 1-3 e 7-10 intervalli di tempo dopo il ricovero in ospedale o la visita, rispettivamente, così come gli individui sani. I punti mostrano le misure individuali e le linee i valori mediani dei pazienti ospedalizzati e degli individui sani. I quadrati mostrano pazienti non ospedalizzati con influenza. Ombreggiatura grigia segna il limite di quantificazione del test. b, diagrammi radar dei livelli mediani di citochine e gamma di pazienti ospedalizzati con COVID-19 e l’influenza sviluppando malattia critica rispetto a non critica, pazienti non ospedalizzati con l’influenza e individui sani al giorno 1-3 intervallo di tempo dopo l’ammissione. Ogni cerchio nel grafico radar rappresenta concentrazioni logaritmicamente crescenti da 4-256 pg ml-1 come mostrato nei controlli sani. Per i giorni 1-3, n = 9, 7, 24, 13 e 3 per ciascuno dei cinque gruppi consecutivi, rispettivamente. Per i giorni 7-10, n = 8, 13, 15, 12 e 2, rispettivamente. Per gli individui sani, n = 10. I valori P sono stati determinati da un test Mann-Whitney U a due code per confronti non parametrici. *P < 0,05, **P < 0,01 e ***P < 0,001 mostrano significatività rispetto ai controlli sani. #P < 0.05, ##P < 0.01 e ###P < 0.001 mostrano significatività tra COVID-19 e sottogruppi di influenza.
Abbiamo poi cercato di determinare se i modelli di citochine squilibrati nei pazienti con COVID-19 sono legati agli effetti immunitari sistemici e ai parametri legati alla gravità della malattia. A tal fine, abbiamo ottenuto trascrittomi WBC temporali da cinque individui sani e nove pazienti con COVID-19, cinque non critici e quattro critici, a partire dal giorno 1 di ingresso in reparto o in terapia intensiva e in diversi punti temporali successivi. In totale, sono stati analizzati 24 set di dati completi di espressione genica RNA-seq. Le analisi di clustering hanno rivelato che i campioni si raggruppano secondo la gravità del fenotipo clinico, indicando questo come la principale fonte di variazione e fornendo un modo per prevedere quali pazienti progrediranno per sviluppare la malattia critica o non critica (Fig. 3a e Extended Data Fig. 8). Concentrandosi sul giorno 1 come il punto temporale più rilevante, abbiamo trovato che 4.225 geni erano differenzialmente espressi nei pazienti con COVID-19 rispetto agli individui sani (Tabella 3 supplementare). Quando i pazienti criticamente e non criticamente malati sono stati confrontati separatamente ai controlli sani, 4.214 e 4.902 geni differenzialmente espressi (DEG) sono stati osservati, rispettivamente, di cui 1.979 erano comuni mentre il resto sono stati trovati unicamente in uno o l’altro gruppo di pazienti (Fig. 3b e tabelle supplementari 3 e 4). Di questi DEG, 2.674 geni erano anche significativamente diversi tra i pazienti critici e non critici (Tabella supplementare 5). Trame vulcano sottolineato notevoli differenze nei geni più altamente regolati tra i gruppi, con i pazienti critici esibendo più forte immunitario e antivirale modelli gene risposta (Fig. 3c-e). L’analisi dei percorsi dei DEG ha infatti rivelato che i percorsi più significativi sovrarappresentati nei pazienti critici erano legati alla regolazione positiva del sistema immunitario, l’attivazione della risposta immunitaria innata, la risposta di difesa al virus e la risposta cellulare all’IFN (Fig. 3f e Tabella 6 supplementare). Anche l’induzione della via di produzione dell’IL-1β e la risposta all’IL-1 erano prominenti. Al contrario, nei pazienti non gravemente malati queste vie non sono state significativamente upregolate con l’eccezione della via di produzione di IL-1β (Fig. 3f). Altri percorsi sovrarappresentati invece includevano la regolazione della dimensione della componente cellulare e la citotossicità delle cellule natural killer (NK) (Fig. 3f).
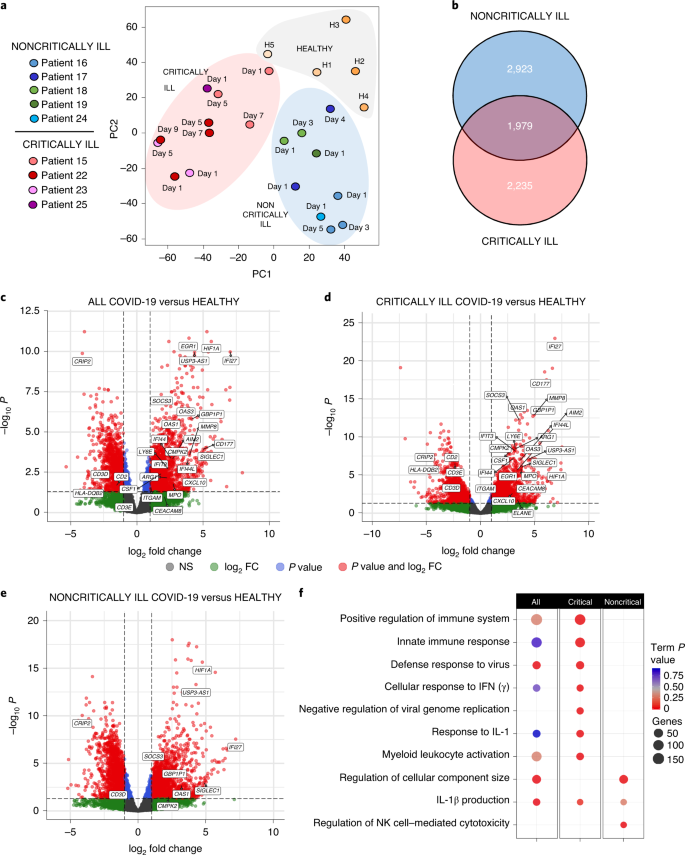
a, Analisi principale-componente dei trascrittomi WBC periferici di pazienti malati critici (n = 4) e non critici (n = 5) o controlli sani (H1-H5) (n = 5). b, diagramma di Venn che mostra l’unico e comune DEGs di trascrittomi WBC periferici da criticamente malato (n = 4) e non criticamente malato (n = 5) pazienti rispetto agli individui sani (n = 5). c-e, trame vulcano che mostra il DEGs più significativamente upregolato e rilevante in tutti i pazienti con COVID-19 (c) e loro criticamente (d) e non criticamente malato (e) sottogruppi rispetto agli individui sani al giorno 1 di ricovero. L’analisi DEG è stata eseguita utilizzando DESeq2 v.1.22.2. FC, fold change; NS, non significativo. f, Gene ontology (GO) pathway-enrichment analysis of DEGs of all, critically ill and noncritically ill patients with COVID-19 at day 1 of hospital or ICU entry. ClueGO è stato impiegato e i valori di termine P sono stati aggiustati usando la correzione di Bonferroni per i confronti multipli. La visualizzazione è stata eseguita utilizzando il pacchetto ggplot2 R. La dimensione del punto indica il numero di geni differenzialmente espressi per percorso, e il colore rosso indica la significatività statistica.
Secondo, mappe di calore con informazioni temporali svelato forte induzione di una lunga serie di geni antivirali in pazienti criticamente malati rispetto a solo una frazione di loro essere upregulated nel gruppo noncritically ill (Fig. 4a e Tabella supplementare 3). Questo insieme include geni classici di risposta antivirale, che possono essere indotti da IFN di tipo I e III, come Stat1, Stat3, Irf1, Irf2, Socs3, Isg20, Oasl, Ifi5, Ifit1b, Ifit5, Ifitm10, Gbp1, Gbp2, Gbp4, Gbp5 e Gbp6, tutti significativamente upregolati in pazienti criticamente malati sopra non criticamente malati o individui sani e Irf3, Socs3, Mx1, Oas1, Ifi27, Ifi44 e Ifitm5 anche upregolato in pazienti non criticamente malati anche se in misura inferiore rispetto ai pazienti critici (Tabella supplementare 5). Confronto del set totale di geni antivirali espressi al giorno 1 come mostrato in Fig. 4a ha confermato una differenza statisticamente significativa tra i pazienti criticamente e non criticamente malati (P = 1.25 × 10-20), in accordo con i modelli distinti di produzione di IFN-λ e IFN di tipo I in questi pazienti. Questo più forte tipo I/III risposta IFN in pazienti critici era improbabile che sia dovuto alla maggiore espressione di componenti del recettore IFN, come non sono state osservate differenze significative tra Ifnlr1, Il10rb e Ifnar1 livelli di mRNA tra i gruppi di pazienti e gli individui sani tranne un aumento di due volte di Ifnar2 in pazienti critici (Tabella supplementare 3).
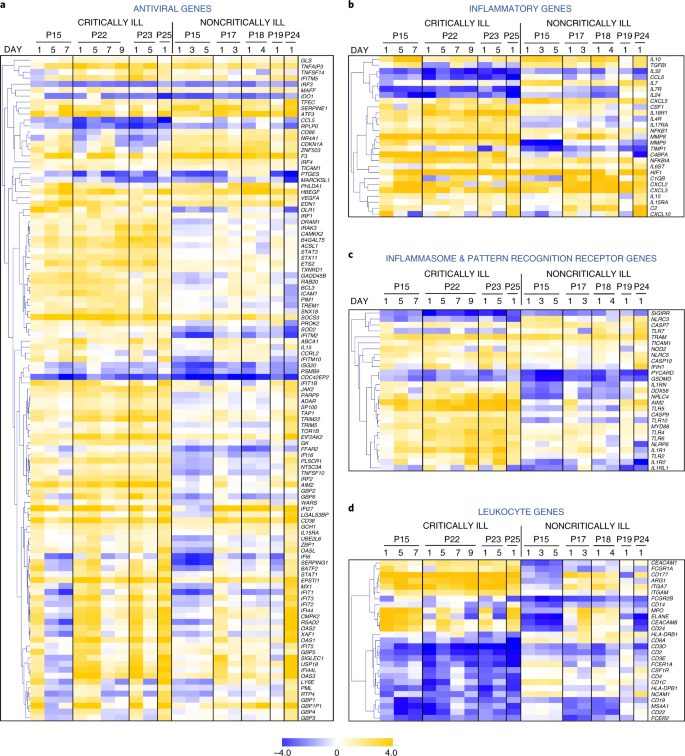
a-d, mappe di calore che mostrano i modelli temporali dei geni antivirali differenzialmente espressi (a), geni infiammatori (b), inflammasoma e geni PRR (c) e geni leucocitari (d) di pazienti critici e non critici con COVID-19 rispetto agli individui sani. Colori blu e giallo rappresentano down- e upregulated geni, rispettivamente. I dati sono espressi come valori log2 fold rispetto ai controlli sani. P, patient.
Analisi della mappa di calore ulteriore ha indicato una risposta immunitaria innata sistemica più forte nei pazienti gravemente malati contrassegnati da una maggiore espressione dei mediatori pro-infiammatori chiave, compresi i componenti del complemento (C2, C4bpa), citochine (Csf1, Cxcl10) e metalloproteinasi di matrice (Mmp8, Mmp9) su individui sani (Fig. 4b). Al contrario, i pazienti non gravemente malati hanno esibito una maggiore espressione di Il10, una grande citochina anti-infiammatoria che smorza le tempeste di proteine e Il7, che è coinvolta nel mantenimento dell’omeostasi delle cellule T in periferia. In particolare, i geni dell’inflammasoma come Nlrp6, Nrlc4, Nod2, Aim2, Casp9, Casp10, Il1rn e Il1r1, tutti legati alla produzione di IL-1β o alla risposta20, sono stati anche upregolati nei pazienti critici con COVID-19, mentre Pycard (Asc), un componente chiave dell’assemblaggio dell’inflammasoma, è stato downregolato nei pazienti non critici rispetto agli individui sani, indicando un ruolo prominente del percorso IL-1β nella malattia più grave (Fig. 4c). I recettori di riconoscimento del modello (PRRs) coinvolti nel riconoscimento microbico come Ddx58 (Rigi), Aim2, Ifih1 (Mda5), Ifi16, Tlr2 e Tlr4, erano anche upregolati. Nel complesso, se confrontati come set, i geni dell’inflammasoma e del PRR mostrati in Fig. 4c erano significativamente diversi tra i due gruppi (P = 9.72 × 10-7). A livello di tipo cellulare, l’analisi dell’espressione genica ha rivelato una firma dominante di cellule neutrofile/mieloidi attivate (Mpo, Elane, Cd177, Itgam, Arg1, Ceacam8 e Fcgr1a) nel gruppo di malati critici che era più lieve e non significativa nei pazienti non critici (Fig. 4d). Al contrario, i linfociti T, B e NK e i geni correlati (Cd3d, Cd3e, Cd4, Cd8a, Cd19, Cd22 e Ncam1) erano marcatamente downregolati nei pazienti critici. Questi dati sono coerenti con la linfopenia, l’alta conta dei neutrofili e un alto rapporto N/L presenti anche in questi pazienti (dati estesi Fig. 4) e precedentemente riportati per essere associati a una malattia più grave e a esiti peggiori nei pazienti con COVID-19 (rif. 3,4). Citochine come TNF, IL-6 e IL-8 possono essere direttamente responsabili di questi effetti, in quanto sono ben note per innescare la mobilitazione e l’attivazione dei neutrofili, lo sviluppo di linfopenia e l’induzione di risposte immunitarie innate e infiammazione sistemica21,22. Così, i trascrittomi WBC dei pazienti con COVID-19, all’inizio durante l’ospedalizzazione, possono fornire informazioni vitali sulla gravità della malattia e guidare il trattamento come la somministrazione di inibitori IL-1 in modo più personalizzato.
Interessante, i modelli di citochine squilibrati nei pazienti con COVID-19 con polmonite erano associati a un esito della malattia molto peggiore rispetto all’influenza. In primo luogo, il gruppo COVID-19 ha mostrato una maggiore incidenza di malattia critica e di mortalità (dati estesi Fig. 5). In secondo luogo, i pazienti con COVID-19 nel complesso, così come quando raggruppati come malati critici e non critici, hanno richiesto un tempo di ospedalizzazione più lungo rispetto alle loro controparti influenzali (Fig. 5a-c). Per i pazienti con COVID-19 malati non critici e critici, il tempo mediano era di 14 e 23 d, rispettivamente, rispetto all’influenza a 7 e 19 d (Fig. 5b,c). L’ospedalizzazione prolungata potrebbe essere attribuita alle risposte antivirali non sintonizzate, portando a un decorso clinico più prolungato della COVID-19 rispetto all’influenza e a una necessità di recupero più lungo anche per il gruppo di pazienti non critici.
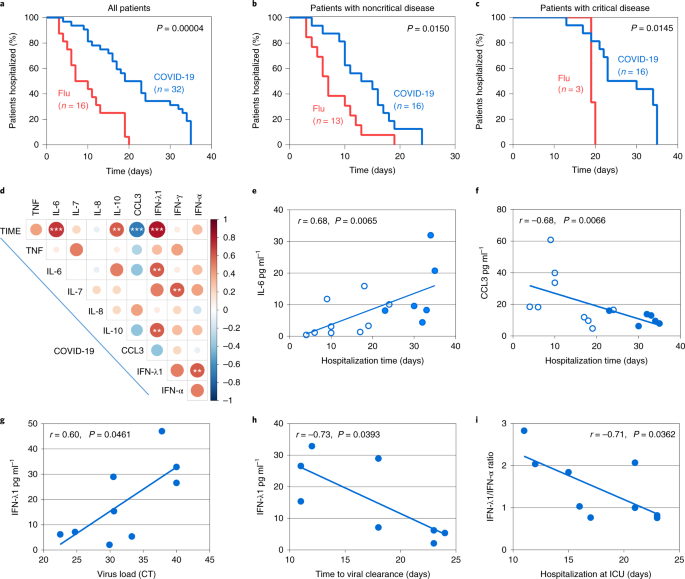
a-c, Confronto del tempo di ospedalizzazione tra i pazienti con COVID-19 e influenza. Tutti i pazienti (a), i pazienti con malattia non critica (b) e i pazienti con malattia critica (c) sono mostrati. d, matrice di correlazione dei livelli di concentrazione delle citochine nel siero all’intervallo di tempo del giorno 1-3 dopo il ricovero in ospedale dei pazienti con COVID-19, indicando le correlazioni tra le citochine e il tempo totale di ospedalizzazione (TIME) o altre citochine. e,f, correlazione dei livelli di IL-6 (e) e CCL3 (f) nel siero con la durata del ricovero totale di tutti i pazienti con COVID-19. g, Correlazione dei livelli di IFN-λ1 con la carica virale espressa come valori della tomografia computerizzata negli aspirati bronchiali raccolti nello stesso intervallo di tempo dei sieri usati per la quantificazione di IFN-λ1. h, Correlazione dei livelli di IFN-λ1 con il tempo necessario per la clearance virale valutata come il primo test SARS-CoV-2 negativo. i, Correlazione del rapporto IFN-λ1:IFN-α con la durata dell’ospedalizzazione in ICU. I punti mostrano le misure individuali dei pazienti con COVID-19. I punti aperti e quelli ombreggiati corrispondono ai pazienti non critici e critici con COVID-19, rispettivamente (e-i). Per a-c, i valori P per il confronto delle curve di ospedalizzazione tra i gruppi di pazienti sono stati determinati utilizzando il test log-rank. Per d-i, i valori P per la forza e la direzione dell’associazione tra le due variabili, come indicato in ogni pannello, sono stati determinati utilizzando il coefficiente di correlazione di rango Spearman per dati non parametrici. **P < 0,01 e ***P < 0,001.
Per identificare le citochine e le combinazioni di citochine che possono predire il tempo di ospedalizzazione, e quindi essere di valore prognostico per la stratificazione del rischio indipendentemente dai parametri di laboratorio e di gravità clinica noti (come la saturazione di O2, frequenza respiratoria o rapporto N/L), abbiamo generato una matrice di correlazione dei livelli di citochine all’ammissione (intervallo giorno 1-3) e la durata del ricovero (Fig. 4d). Abbiamo trovato che più alte IL-6 e IL-10, e più basse concentrazioni di CCL3, erano direttamente proporzionali alla durata del ricovero (Fig. 5d-f). Il valore di IL-6 e IL-10 come biomarcatori per il monitoraggio della gravità della COVID-19 è stato riportato4,23,24 ma per CCL3 questo è nuovo. In particolare, la concentrazione di IFN-λ anche correlato con più alto IL-6 e IL-10 e il tempo di ospedalizzazione più lungo, coerente con la loro induzione quasi esclusiva nei pazienti critici, ma non acriticamente malati (Fig. 5d).
Una domanda che sorge è se i livelli di IFN indotti in pazienti critici sono benefici, come ritardata tipo I o tipo III produzione IFN ha dimostrato in modelli animali di causare immunopatologia 13,14,25 o interferire con la riparazione epiteliale26,27, rispettivamente. Abbiamo scoperto che concentrazioni più elevate di IFN-λ durante l’ingresso in terapia intensiva erano associate a una minore carica virale di SARS-CoV-2 nel tratto respiratorio e a una più rapida eliminazione virale (Fig. 5g,h). Inoltre, un rapporto IFN-λ più alto rispetto all’IFN di tipo I in quel momento era legato a un soggiorno più breve in terapia intensiva (Fig. 5i), con i due pazienti con i livelli più alti di IFN-α che presentavano anche il soggiorno più lungo (entrambi 23 d su una mediana di 17 d). Questi dati suggeriscono che l’induzione ritardata di IFN-λ può ancora essere protettiva nei pazienti critici con COVID-19, mentre l’IFN-α può fare più male che bene, almeno in un sottogruppo di pazienti.
Insieme, i nostri risultati dimostrano che l’infezione da SARS-CoV-2 non segue il paradigma convenzionale di immunità antivirale. Invece di attivare prima la risposta antivirale seguita dal processo pro-infiammatorio come seconda linea di protezione, fa il contrario: scatena la risposta pro-infiammatoria molto prima che le difese antivirali mediate dall’IFN siano indotte, se non del tutto. Questo scenario è un grande paradosso e aiuta a spiegare molte delle caratteristiche uniche o insolite del COVID-19. Il lungo tempo di incubazione del virus e la persistenza nel tratto respiratorio, che dà test positivi alla SARS-CoV-2 per settimane, possono essere attribuiti alla ritardata e/o ridotta produzione di IFN di tipo I e III. I sintomi assenti o molto lievi dei pazienti per un periodo di tempo insolitamente esteso, possono essere attribuiti alla mancanza o alla ridotta e ritardata espressione degli IFN di tipo I, principali mediatori della malattia simil-influenzale e di sintomi quali naso che cola, tosse, affaticamento, dispnea e febbre nell’uomo28. Infine, l’espressione precoce e persistente di citochine pro-infiammatorie che culminano in un’iperinfiammazione prolungata può promuovere lo sviluppo improvviso di un’insufficienza respiratoria che richiede l’ospedalizzazione e spesso il ricovero in terapia intensiva. Degno di nota, nell’influenza la rapida induzione della risposta IFN di tipo I e III, attraverso lo spettro della gravità della malattia, è correlata a un recupero più rapido e a un’incidenza nettamente inferiore di malattia critica o mortalità13,25. La recente dimostrazione in uno studio di coorte retrospettivo di 446 pazienti con COVID-19 che la somministrazione precoce di IFN-α (IFN-a2b) è legata a una ridotta mortalità in ospedale, mentre una terapia tardiva di IFN-α porta a un aumento della mortalità e a un recupero ritardato, lascia pochi dubbi sul fatto che il momento della produzione di IFN sia cruciale anche nei pazienti con COVID-19 (rif. 29). Concepibilmente, la produzione tardiva di IFN di tipo I o III potrebbe non conferire alcuna resistenza virale, ma invece promuovere l’immunopatologia.
Se questo unico decorso clinico della COVID-19 sia legato alla presenza di inibitori IFN derivati dalla SARS-CoV-2 come precedentemente proposto per la SARS-CoV30,31 e la MERS-CoV32 non è noto ma è una possibilità. Come per altri virus, l’inibizione può essere superata una volta raggiunti carichi virali più elevati, per esempio dopo l’incubazione del virus e l’eventuale diffusione in individui suscettibili. Nel nostro studio, non abbiamo visto differenze significative nei livelli di virus tra pazienti non critici e critici al momento in cui sono stati misurati gli IFN (Extended Data Fig. 9). Tuttavia, una carica virale più elevata nella malattia grave rispetto a quella lieve è stata descritta in uno studio ma non è stata confermata in un altro33,34. Inoltre, una maggiore carica virale può superare la soppressione dose-dipendente della produzione di IFN nelle cellule epiteliali respiratorie coltivate16. In primo luogo, caratterizza i modelli di citochine nella circolazione e anche se questi sono comunemente utilizzati per analizzare ‘citochine storms’ in risposta all’infezione, quanto bene si correlano alle risposte immunitarie nel tratto respiratorio è difficile da sapere. In secondo luogo, il nostro studio è relativamente piccolo e i nostri risultati attendono la convalida in altre coorti. Tuttavia, il nostro studio è unicamente informativo in quanto affronta la produzione di IFN e l’attivazione della “tempesta di citochine” nella COVID-19 in modo temporale, dall’ammissione in ospedale all’ingresso in terapia intensiva, e dovrebbe quindi essere particolarmente utile per la progettazione di studi clinici che testano le terapie IFN. Descrive anche biomarcatori come IL-6 e CCL3 e firme di espressione genica che possono essere particolarmente utili per valutare il rischio di sviluppo della malattia critica e la durata dell’ospedalizzazione dei pazienti con COVID-19 appena ricoverati. Infine, fornisce un confronto side-by-side di COVID-19 con l’influenza, studiando popolazioni di pazienti con caratteristiche genetiche, demografiche e clinicopatologiche simili, e quindi scopre importanti differenze nella risposta immunitaria antivirale tra queste due malattie che non sono state precedentemente sospettate.
0 commenti