Definizione
Lancet. 2012 Apr 7;379(9823):1341-51.
Am J Respir Crit Care Med. 2007 Sep 15;176(6):532-55.
La BPCO è caratterizzata da una limitazione persistente del flusso d’aria che di solito è progressiva e associata a una maggiore risposta infiammatoria cronica nelle vie aeree e nei polmoni a particelle o gas nocivi.
Asma vs BPCO
Asma = restringimento delle vie aeree completamente reversibile
COPD = restringimento delle vie aeree non completamente reversibile
La BPCO può essere divisa in 2 fenotipi clinici: enfisema e bronchite cronica.
- L’enfisema è definito patologicamente come l’allargamento degli spazi aerei distali.
- La bronchite cronica è definita clinicamente come tosse produttiva di espettorato che si verifica nella maggior parte dei giorni in 3 mesi consecutivi per 2 anni consecutivi.
Eziologia
- Lancet. 2012 Apr 7;379(9823):1341-51.
- Am J Respir Crit Care Med. 2007 Sep 15;176(6):532-55.
- Lancet. 2009 Aug 29;374(9691):733-43.
Molti fattori contribuiscono allo sviluppo della BPCO, inclusi fattori genetici come il deficit di alfa1-antitripsina, esposizioni professionali a polveri e sostanze chimiche, inquinamento, infezioni respiratorie nell’infanzia e fumo di sigaretta.
| Eziologia | Meccanismo(i) |
| Sigaretta fumo | La presenza di particelle di fumo nei polmoni porta ad una risposta infiammatoria con aumento dell’infiltrazione di macrofagi e neutrofili nei polmoni. Queste cellule immunitarie rilasciano citochine, chemochine ed elastasi, che danneggiano il parenchima polmonare nel tempo. |
| Esposizioni professionali a polvere e sostanze chimiche | Eziologia non chiara, tuttavia, si ipotizza che sia una risposta infiammatoria simile che danneggia gli alveoli. |
| Carenza di alfa-1 antitripsina | L’alfa-1 antitripsina è un inibitore della serina proteasi (SERPIN) secreto dal fegato nel sangue che inibisce l’enzima neutrofilo elastasi dal danneggiare il tessuto polmonare. La carenza di questa alfa-1 antitripsina porta all’elasteolisi non contrastata (distruzione delle fibre di elastina nelle pareti alveolari) e allo sviluppo dell’enfisema precoce. Questa è l’ipotesi proteasi-antiproteasi dello sviluppo dell’enfisema. |
| Uso cronico di droghe per via endovenosa | I consumatori di cocaina, metadone ed eroina sono a maggior rischio di sviluppare la BPCO; ciò è attribuito al danno vascolare indotto dal riempitivo insolubile (amido di mais, cellulosa, talco, fibre ecc.) presente nelle droghe per via endovenosa. |
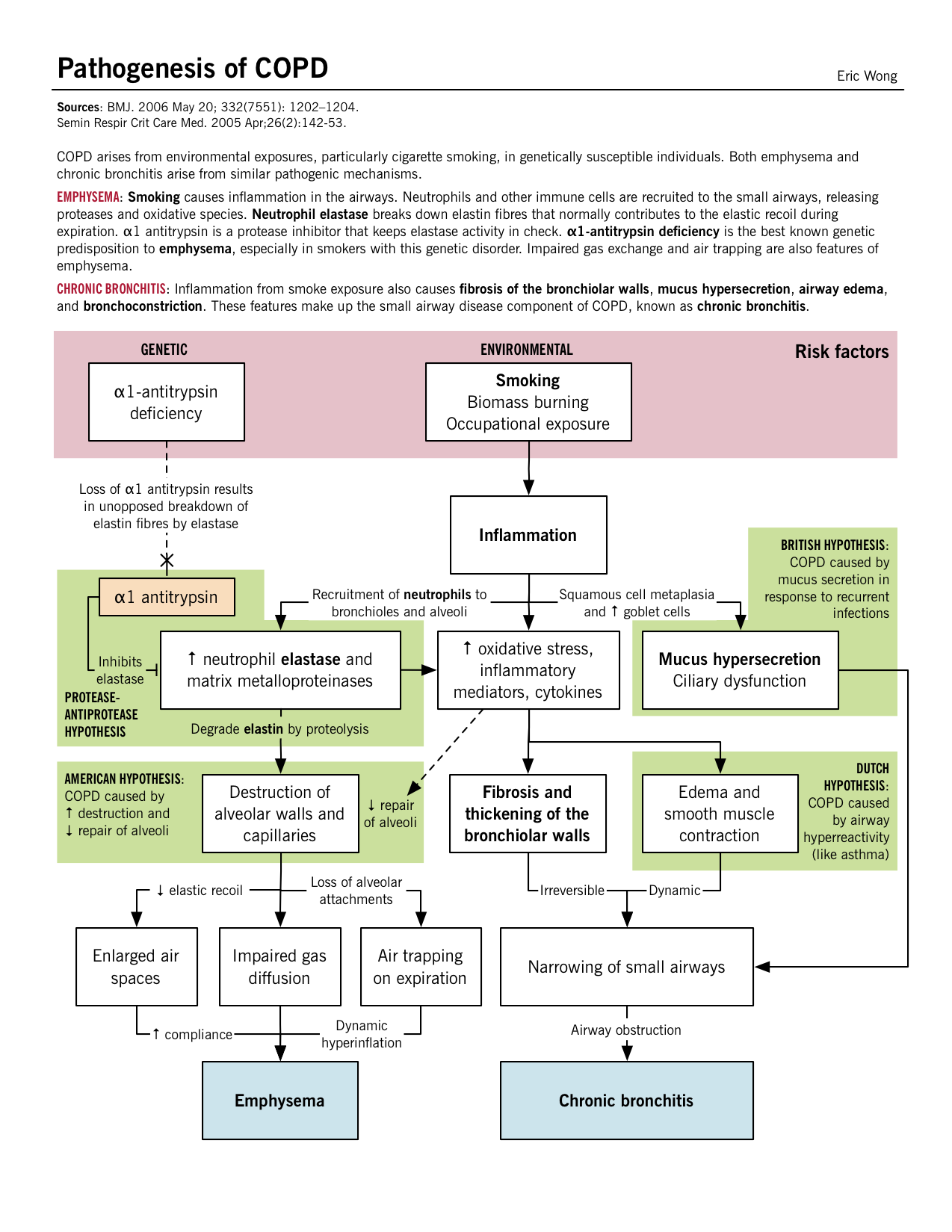
Patogenesi, fisiopatologia e caratteristiche cliniche
BMJ. 2006 May 20; 332(7551): 1202-1204.
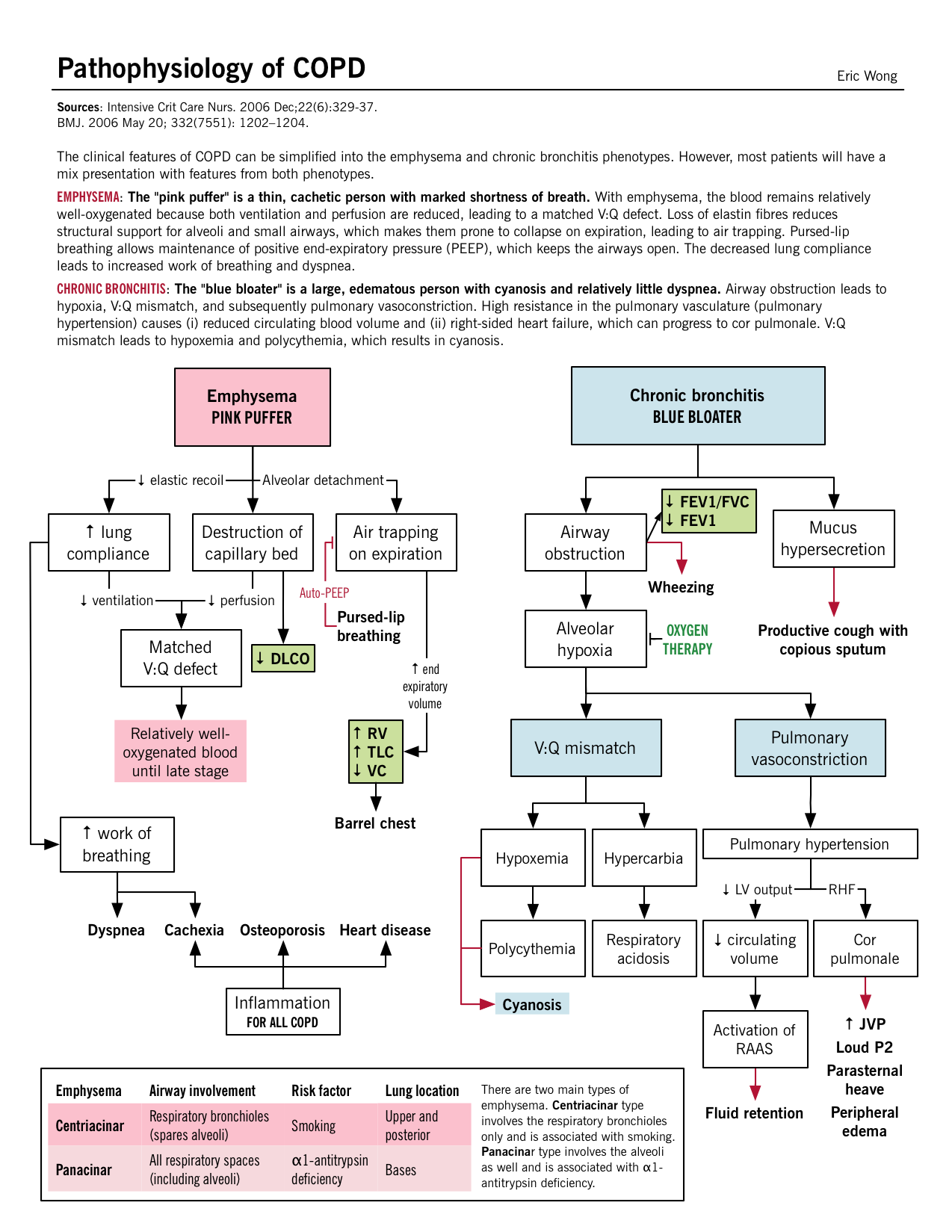
Anche se una suddivisione della BPCO in enfisema e bronchite cronica è utile, tipicamente i pazienti hanno caratteristiche e risultati di ciascuno e non possono essere semplicemente classificati.
| Emphysema | Bronchite cronica | |
|
Patogenesi Am J Respir Cell Mol Biol. 2005 May;32(5):367-72. |
La risposta infiammatoria, mediata da neutrofili, macrofagi e cellule T CD8+, rilascia mediatori infiammatori ed enzimi che danneggiano il parenchima polmonare. Proteasi come l’elastasi e le metalloproteinasi di matrice (MMP) rilasciate da queste cellule infiammatorie rompono il tessuto connettivo delle pareti alveolari e dei setti. Una perdita di rinculo elastico porta a una diminuzione del flusso espiratorio, all’intrappolamento dell’aria e al collasso delle vie aeree. | L’allargamento delle ghiandole mucose, l’iperplasia delle cellule del calice e la disfunzione mucociliare si verificano nelle vie aeree più grandi, causando un’eccessiva produzione e accumulo di muco che riduce il lume delle vie aeree.Anche se questi cambiamenti patologici nelle grandi vie aeree, sembra che il sito principale di aumento della resistenza delle vie aeree sia le piccole vie aeree (≤ 2 mm). La fibrosi e l’ipertrofia della muscolatura liscia possono verificarsi insieme alla produzione di muco in eccesso e l’infiltrazione cellulare nelle vie aeree periferiche. |
|
Patofisiologia BMJ. 2006 May 20; 332(7551): 1202-1204. |
Distruzione parenchimale: Il danno ricorrente agli alveoli porta alla fine alla distruzione del setto insieme al letto capillare anche. Defetto V/Q abbinato: Dal momento che sia i bronchioli terminali che gli alveoli insieme al letto capillare sono stati distrutti, esiste un difetto abbinato tra la ventilazione e la perfusione; le aree di bassa ventilazione hanno anche una cattiva perfusione. Ipoxia lieve: Nonostante il difetto V/Q “abbinato”, si sviluppa un’iperventilazione eccessiva e la gittata cardiaca (CO) scende, il che porta ad aree di scarso flusso sanguigno in aree relativamente ben ossigenate. A causa di questa scarsa CO, il resto del corpo soffre di ipossia tissutale. Cachessia: A livello polmonare, la bassa CO porta alla cachessia polmonare, che induce perdita di peso e deperimento muscolare. Questo dà a questi pazienti il caratteristico aspetto “pink-puffer”. |
Infiammazione delle piccole vie aeree: I meccanismi discussi sopra portano all’infiammazione nei bronchioli più piccoli e le secrezioni di muco restringono ulteriormente il lume delle vie aeree. Nonostante questo, il parenchima è relativamente meno danneggiato. V/Q mismatch: La risposta fisiologica porta a un calo della ventilazione e alla compensazione con l’aumento della CO. L’aumento della perfusione nelle aree di scarsa ventilazione avviene alla fine causando ipossia e policitemia secondaria. Ipoxia grave e ipercarbia: Il mismatch V/Q cronico porta a una diminuzione dell’ossigenazione/deossigenazione del sangue con conseguente ipossiemia e aumento della ritenzione di CO2 (segue acidosi respiratoria). Ipertensione polmonare e cor pulmonare: L’ipercapnia cronica e l’acidosi respiratoria portano alla vasocostrizione arteriosa nei polmoni. Con l’accumulo di pressione retrograda, le pressioni del ventricolo destro continuano a salire e alla fine causano l’insufficienza del RV. Altrimenti, noto come cor pulmonale. |
| Segni/sintomi clinici |
“Pink puffer” – tipo A Dispnea/tachipnia costante grave (“puffing”): Probabilmente legato all’aumento del volume end-espiratorio (diminuzione del rinculo), rendendo ogni respiro meno efficiente. I pazienti usano i muscoli accessori (posizione a treppiede) e respirano più velocemente (iperventilazione) per compensare la sensazione di ventilazione inadeguata. La dispnea è anche legata all’affaticamento dei muscoli respiratori dovuto all’aumento dell’uso e all’appiattimento del diaframma che ne compromette la funzione. Tosse lieve: L’irritazione delle piccole vie aeree può portare alla produzione di tosse. Non cianotico (“rosa”): Difetto V:Q corrispondente; nessuna ipossiemia. Magro/cachessico: Perdita di muscolo scheletrico e di grasso sottocutaneo a causa di un’inadeguata assunzione orale e di alti livelli di citochine infiammatorie (TNF-α) che causano tale deperimento. Suoni respiratori diminuiti all’auscultazione: Iperinflazione degli alveoli e distruzione dell’architettura alveolare causano una diminuzione della resistenza delle vie aeree. |
“Blue bloater” – tipo B Produzione di espettorato copioso: Elevata quantità di espettorato prodotto dalle cellule goblet. Vedere Patogenesi sopra. Tosse: Irritazione dei recettori della tosse, da parte del muco, nelle piccole e grandi vie aeree. Cianotico (“blu”): Il difetto V/Q non corrispondente porta ad una inadeguata ossigenazione del sangue; più evidente nelle labbra e nel letto ungueale. Sovraccarico di volume (“bloater”): Molto probabilmente dal fallimento del ventricolo destro (RV), noto come cor pulmonale. Volatile all’auscultazione: Dovuto all’ostruzione delle vie aeree. Rispetto all’asma, c’è meno broncospasmo e più muco/ipertrofia nella BPCO. Rhonchi è un suono gorgogliante che può essere sentito a causa dell’ipersecrezione di muco nelle vie aeree. |
Esacerbazioni
N Engl J Med. 2012 Jul 26;367(4):340-7.
Diversi studi hanno dimostrato un certo legame tra la colonizzazione batterica delle vie aeree superiori e inferiori dei pazienti e le esacerbazioni acute della BPCO. Inoltre, le esacerbazioni sembrano coincidere con l’aumento delle infezioni virali respiratorie acute (influenza, parovirus ecc.). Gli agenti patogeni introducono nuovi antigeni nelle vie aeree e nel parenchima che inducono la secrezione di chemochine (TNF-α e IL-6, IL-8 ecc.) e leucotrieni, sia da parte dei macrofagi delle vie aeree che dell’epitelio, che reclutano neutrofili. Questi neutrofili, insieme ad altre cellule immunitarie, secernono proteasi e altri mezzi che infiammano ulteriormente le vie aeree e distruggono l’epitelio bronchiale, portando a una esacerbazione clinica.
Trattamento
- Am J Respir Crit Care Med. 2013 Feb 15;187(4):347-65.
- Lancet. 2012 Apr 7;379(9823):1341-51.
- N Engl J Med. 2012 Jul 26;367(4):340-7.
Cessazione del fumo
La cessazione del fumo rallenta significativamente la progressione del declino della funzione polmonare e riduce la mortalità del 18%. È il singolo intervento più efficace e importante nella BPCO.
Broncodilatatori
I β2-agonisti per via inalatoria (ad esempio salbutamolo a breve durata d’azione o salmeterolo a lunga durata d’azione) agiscono sui recettori β2 delle cellule muscolari lisce per causare broncodilatazione. Gli anticolinergici inalati (per esempio ipratropio a breve durata d’azione o tiotropio a lunga durata d’azione) agiscono per bloccare l’effetto dell’acetilcolina sui recettori muscarinici delle cellule muscolari lisce, permettendo la broncodilatazione. I β2-agonisti inalati e gli anticolinergici sono usati sia per la gestione sintomatica, sia per le esacerbazioni acute della BPCO. I broncodilatatori a lunga durata d’azione sono preferiti a quelli a breve durata d’azione a causa del minor numero di dosi e della migliore gestione dei sintomi. Per un trattamento più efficace della BPCO stabile, può essere usata anche una terapia combinata con un β2-agonista inalatorio e un anticolinergico.
Corticosteroidi
Gli steroidi sopprimono la risposta infiammatoria inibendo i fattori di trascrizione, compreso il fattore nucleare-κB, che regolano la trascrizione di varie citochine, chemochine, molecole di adesione e altre proteine che inducono e perpetuano l’infiammazione. I corticosteroidi per via inalatoria non sono utilizzati per il trattamento delle esacerbazioni della BPCO; tuttavia, sono stati utilizzati nel trattamento a lungo termine della BPCO in una minoranza di pazienti con BPCO stabile che dimostrano frequenti esacerbazioni e reversibilità dei broncodilatatori. I corticosteroidi sistemici sono raccomandati per essere usati durante un’esacerbazione acuta che richiede l’ospedalizzazione.
Ossigeno
Cochrane Database Syst Rev. 2005 Oct 19;(4):CD001744.
L’ossigenoterapia è spesso fornita insieme a interventi farmacologici per trattare l’ipossiemia sottostante nei pazienti con BPCO. Riducendo l’ipossia negli alveoli, si riduce la vasocostrizione polmonare. La riduzione dell’ipertensione polmonare abbassa il postcarico del cuore destro e migliora la funzione sistolica del cuore destro. L’ossigeno riduce anche l’ipossiemia nel sangue, il che riduce il rischio di sviluppare policitemia. Tuttavia, l’ossigenoterapia ha dimostrato di ridurre la mortalità solo in quelli con ipossiemia grave (PaO2 < 55mmHg); altrimenti non vi è alcun beneficio di mortalità.
Riabilitazione polmonare
Chest. 2007 May;131(5 Suppl):4S-42S.
L’obiettivo della riabilitazione polmonare è di migliorare la qualità della vita e il funzionamento quotidiano nei pazienti con BPCO. Attraverso un team multidisciplinare, i pazienti sono tipicamente arruolati in un programma di 6-12 settimane che include allenamento fisico, supporto psicosociale, miglioramento nutrizionale ed educazione. Numerosi studi (vedi riferimento Chest) hanno mostrato un miglioramento della capacità di esercizio, una migliore qualità di vita e una diminuzione delle ospedalizzazioni. Tuttavia, la mortalità è invariata.
Lung volume reduction surgery (LVRS)
Ann Thorac Surg. 2006 Aug;82(2):431-43.
LVRS è un’opzione chirurgica che migliora la sopravvivenza nei pazienti BPCO con enfisema del lobo superiore e bassa capacità di esercizio post-riabilitazione. La procedura comporta la resezione di parti del polmone malato. Questo ha due effetti fisiologici principali: (1) riduce l’iperinflazione, permettendo al diaframma di contrarsi alla sua forza ottimale, e (2) migliora il rinculo polmonare perché le porzioni anelastiche del polmone vengono resecate.
0 commenti