Aloalcani e aloeeniModifica
Negli aloalcani e negli aloeeni (R-X), i gruppi funzionali alogeni hanno il prefisso della posizione di legame e prendono la forma di fluoro-, cloro-, bromo-, iodo-, ecc. I gruppi multipli sono dicloro-, tricloro-, ecc. e i gruppi dissimili sono ordinati alfabeticamente come prima. Per esempio, CHCl3 (cloroformio) è triclorometano. L’anestetico alotano (CF3CHBrCl) è 2-bromo-2-cloro-1,1,1-trifluoroetano.
AlcoliModifica
Gli alcoli (R-OH) prendono il suffisso “-ol” con un infisso in posizione numerica di legame: CH3CH2CH2OH è il propan-1-olo. I suffissi -diolo, -triolo, -tetraolo, ecc. sono usati per gruppi -OH multipli: Il glicole etilenico CH2OHCH2OH è etano-1,2-diolo.
Se sono presenti gruppi funzionali di precedenza superiore (vedi ordine di precedenza, sotto), il prefisso “hydroxy” è usato con la posizione di legame: CH3CHOHCOOH è l’acido 2-idrossipropanoico.
EteriModifica
Gli eteri (R-O-R) consistono in un atomo di ossigeno tra le due catene di carbonio attaccate. La più corta delle due catene diventa la prima parte del nome con il suffisso -ane cambiato in -oxy, e la catena alcano più lunga diventa il suffisso del nome dell’etere. Così, CH3OCH3 è metossimetano, e CH3OCH2CH3 è metossietano (non etossimetano). Se l’ossigeno non è attaccato alla fine della catena principale dell’alcano, allora l’intero gruppo alchilico più etere è trattato come una catena laterale e preceduto dalla sua posizione di legame sulla catena principale. Così CH3OCH(CH3)2 è il 2-metossipropano.
In alternativa, una catena eterea può essere chiamata come un alcano in cui un carbonio è sostituito da un ossigeno, una sostituzione indicata dal prefisso “oxa”. Per esempio, CH3OCH2CH3 potrebbe anche essere chiamato 2-oxabutane, e un epossido potrebbe essere chiamato oxacyclopropane. Questo metodo è particolarmente utile quando entrambi i gruppi attaccati all’atomo di ossigeno sono complessi.
AldeidiModifica
Le aldeidi (R-CHO) prendono il suffisso “-al”. Se sono presenti altri gruppi funzionali, la catena è numerata in modo che il carbonio dell’aldeide sia nella posizione “1”, a meno che non siano presenti gruppi funzionali di precedenza superiore.
Se è richiesta una forma di prefisso, si usa “oxo-” (come per i chetoni), con il numero di posizione che indica la fine della catena: CHOCH2COOH è l’acido 3-oxopropanoico. Se il carbonio del gruppo carbonile non può essere incluso nella catena attaccata (per esempio nel caso delle aldeidi cicliche), si usa il prefisso “formyl-” o il suffisso “-carbaldehyde”: C6H11CHO è cicloesanecarbaldeide. Se un’aldeide è attaccata ad un benzene ed è il gruppo funzionale principale, il suffisso diventa benzaldeide.
ChetoniModifica
In generale i chetoni (R-CO-R) prendono il suffisso “-one” (pronunciato proprio, non vinto) con un numero di posizione infisso: CH3CH2CH2COCH3 è pentan-2-one. Se è in uso un suffisso di precedenza superiore, si usa il prefisso “oxo-“: CH3CH2CH2COCH2CHO è 3-oxohexanal.
Acidi carbossiliciModifica
In generale, gli acidi carbossilici sono chiamati con il suffisso -oic acid (etimologicamente una retroformazione da acido benzoico). Come per le aldeidi, il gruppo funzionale carbossilico deve prendere la posizione “1” sulla catena principale e quindi non è necessario indicare la locante. Per esempio, CH3-CH(OH)-COOH (acido lattico) è chiamato acido 2-idrossipropanoico senza “1”. Alcuni nomi tradizionali per gli acidi carbossilici comuni (come l’acido acetico) sono di uso così diffuso che vengono mantenuti nella nomenclatura IUPAC, anche se vengono usati anche nomi sistematici come acido etanoico. Gli acidi carbossilici attaccati a un anello benzenico sono analoghi strutturali dell’acido benzoico (Ph-COOH) e sono nominati come uno dei suoi derivati.
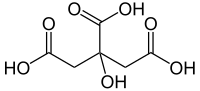
Se ci sono più gruppi carbossilici sulla stessa catena madre, si usano prefissi moltiplicatori: L’acido malonico, CH
2(COOH)
2, è sistematicamente chiamato acido propanedioico. In alternativa, si può usare il suffisso “-acido carbossilico”, combinato con un prefisso moltiplicatore se necessario – l’acido mellitico è l’acido benzene-esacarbossilico, per esempio. In quest’ultimo caso, l’atomo o gli atomi di carbonio nel gruppo o nei gruppi carbossilici non contano come parte della catena principale, una regola che si applica anche alla forma di prefisso “carboxy-“. L’acido citrico serve come esempio: è formalmente chiamato acido 2-idrossipropano-1,2,3-tricarbossilico piuttosto che acido 3-carbossi-3-idrossipentanedioico.
CarbossilatiEdit
I sali di acidi carbossilici sono nominati seguendo le solite convenzioni catione-en-anione usate per i composti ionici sia nel sistema IUPAC che in quello di nomenclatura comune. Il nome dell’anione carbossilato è derivato da quello dell’acido padre sostituendo la terminazione “-oic acid” con “-oate”. Per esempio, C
6H
5CO
2Na, il sale di sodio dell’acido benzoico (C
6H
5COOH), è chiamato sodio benzoato. Quando un acido ha sia un nome sistematico che un nome comune (come CH
3COOH, per esempio, che è conosciuto sia come acido acetico che come acido etanoico), i suoi sali possono essere nominati da uno dei due nomi genitori. Così, CH
3CO
2K può essere chiamato come acetato di potassio o come etanoato di potassio.
EsteriModifica
Gli esteri (R-CO-O-R’) sono chiamati come derivati alchilici degli acidi carbossilici. Il gruppo alchilico (R’) viene nominato per primo. La parte R-CO-O è poi nominata come una parola separata basata sul nome dell’acido carbossilico, con la terminazione cambiata da -oic acid a -oate. Per esempio, CH3CH2CH2CH2COOCH3 è il pentanoato di metile, e (CH3)2CHCH2CH2COOCH2CH3 è il 4-metilpentanoato di etile. Per gli esteri come l’acetato di etile (CH3COOCH2CH3), il formiato di etile (HCOOCH2CH3) o il dimetil ftalato che sono basati su acidi comuni, la IUPAC raccomanda l’uso di questi nomi stabiliti, chiamati nomi conservati. Il -oate cambia in -ate. Alcuni semplici esempi, nominati in entrambi i modi, sono mostrati nella figura sopra.
Se il gruppo alchilico non è attaccato alla fine della catena, la posizione del legame al gruppo estere è infissa prima di “-yl”: CH3CH2CH(CH3)OOCCH2CH3 può essere chiamato butan-2-il propanoato o butan-2-il propionato.
Gruppi aciliciModifica

I gruppi acilici sono nominati togliendo l’acido -ic del corrispondente acido carbossilico e sostituendolo con -yl. Per esempio, CH3CO-R è chiamato Ethanoyl-R.
Alogenuri aciliciModifica
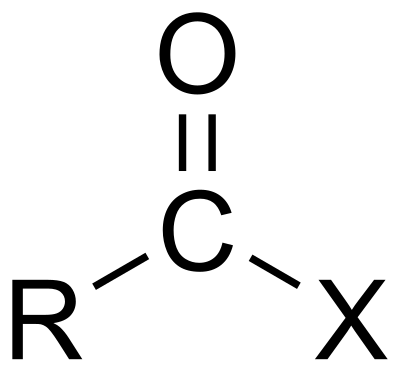
Basta aggiungere il nome dell’alogenuro collegato alla fine del gruppo acile. Per esempio, CH3COCl è cloruro di etanoile.

Anidridi acideModifica

Se entrambi i gruppi acilici sono uguali, allora il nome dell’acido carbossilico con la parola acido sostituita con anidride e il nome IUPAC consiste di due parole. Se i gruppi acilici sono diversi, allora sono nominati in ordine alfabetico allo stesso modo, con l’anidride che sostituisce l’acido e il nome IUPAC consiste di tre parole. Per esempio, CH3CO-O-OCCH3 è chiamato anidride etanoica,
CH3CO-O-OCCH2CH3 è chiamato anidride propanoica etanoica.
AminesEdit
Le ammine (R-NH2) sono chiamate per la catena di alcani attaccata con il suffisso “-ammina” (per esempio CH3NH2 metanammina). Se necessario, la posizione di legame è infissa: CH3CH2CH2NH2 propan-1-amina, CH3CHNH2CH3 propan-2-amina. Il prefisso è “amino-“.
Per le ammine secondarie (della forma R-NH-R), la catena di carbonio più lunga attaccata all’atomo di azoto diventa il nome primario dell’ammina; l’altra catena è prefissata come un gruppo alchilico con prefisso di posizione dato come N in corsivo: CH3NHCH2CH3 è N-metiletanamina. Le ammine terziarie (R-NR-R) sono trattate in modo simile: CH3CH2N(CH3)CH2CH2CH3 è N-etil-N-metilpropanamina. Di nuovo, i gruppi sostituenti sono ordinati alfabeticamente.
AmidiModifica
Le ammidi (R-CO-NH2) prendono il suffisso “-amide”, o “-carboxamide” se il carbonio del gruppo ammidico non può essere incluso nella catena principale. La forma del prefisso è sia “carbamoil-” che “amido-“.es. HCONH2 Metanamide,CH3CONH2 Ethanamide.
Le ammidi che hanno ulteriori sostituenti sull’azoto sono trattate in modo simile al caso delle ammine: sono ordinate alfabeticamente con il prefisso di posizione N: HCON(CH3)2 è N,N-dimetilmetanamide,CH3CON(CH3)2 è N,N-dimetiletanamide.
NitrilesEdit
I nitrili (RCN) sono nominati aggiungendo il suffisso -nitrile alla catena idrocarburica più lunga (compreso il carbonio del gruppo ciano). Possono anche essere nominati sostituendo il -oic acid dei loro corrispondenti acidi carbossilici con -onitrile. La nomenclatura IUPAC della classe funzionale può anche essere usata sotto forma di alchilcianuri. Per esempio, CH 3 CH 2 CH 2 CH 2 C ≡ N {\displaystyle {\ce {CH3CH2CH2CH2C#N}}}

è chiamato pentanenitrile o cianuro di butile.
Composti cicliciModifica
Cicloalcani e composti aromatici possono essere trattati come la catena madre principale del composto, nel qual caso le posizioni dei sostituenti sono numerate intorno alla struttura dell’anello. Per esempio, i tre isomeri dello xilene CH3C6H4CH3, comunemente le forme orto, meta e para, sono 1,2-dimetilbenzene, 1,3-dimetilbenzene e 1,4-dimetilbenzene. Le strutture cicliche possono anche essere trattate come gruppi funzionali stessi, nel qual caso prendono il prefisso “cycloalkyl-” (ad esempio, “cicloesil-“) o per il benzene, “fenil-“.
Lo schema di nomenclatura IUPAC diventa rapidamente più elaborato per le strutture cicliche più complesse, con notazione per i composti che contengono anelli congiunti, e molti nomi comuni come fenolo sono accettati come nomi base per i composti derivati da essi.
0 commenti