US Pharm. 2011;36(4):HS2-HS6.
Le neuropatie ottiche sono disturbi del nervo ottico che coinvolgono la degenerazione del nervo.1 La neuropatia ottica non deve essere confusa con la neurite ottica. Entrambi possono portare a problemi di vista; la neurite ottica comporta l’infiammazione del nervo ottico, mentre la neuropatia ottica si riferisce a danni di qualsiasi causa. La neurite ottica è una delle molte cause di neuropatia ottica.
Le neuropatie ottiche possono essere ereditarie o acquisite. Le eziologie acquisite della neuropatia ottica includono i tipi ischemico, nutrizionale e tossico.1,2 La neuropatia ottica indotta da farmaci è del tipo tossico. I meccanismi della neuropatia ottica indotta da farmaci includono la disfunzione mitocondriale, l’interruzione del flusso di sangue al nervo ottico e meccanismi sconosciuti.2
I sintomi comuni della neuropatia ottica includono la diminuzione della visione nel campo centrale, che è tipicamente bilaterale ma può essere unilaterale in alcuni casi; difetti del campo visivo e gonfiore del nervo ottico.3 L’esordio è tipicamente lento e indolore.2
Nella neuropatia ottica indotta da farmaci, il dechallenge (ritiro) del farmaco incriminato può portare al sollievo dei sintomi.3,4 Poiché molti dei farmaci noti per causare neuropatia ottica sono comuni, è importante che i farmacisti siano consapevoli di questo effetto avverso al fine di indirizzare i pazienti con questi sintomi in modo tempestivo ed evitare ulteriori danni permanenti.
Farmaci che possono causare neuropatia ottica
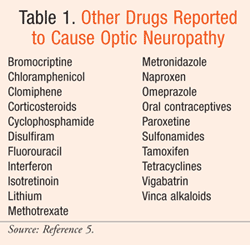
Molti farmaci comunemente prescritti sono stati implicati nella neuropatia ottica. Qui sono discussi gli agenti che hanno più informazioni di supporto: inibitori della fosfodiesterasi di tipo 5 (PDE-5), amiodarone, linezolid, etambutolo e isoniazide. Altri farmaci segnalati come causa di neuropatia ottica sono elencati nella TABELLA 1.5
Inibitori della PDE-5: Questa classe di farmaci ha rivoluzionato il trattamento della disfunzione erettile (DE) negli uomini. Attualmente ci sono tre agenti disponibili -ildenafil (Viagra), tadalafil (Cialis) e vardenafil (Levitra). Esercitano la loro azione inibendo selettivamente la PDE di tipo 5. Considerati agenti di prima linea per il trattamento della DE, sono molto comunemente prescritti, con circa 40 milioni di uomini in tutto il mondo trattati per la disfunzione sessuale con inibitori della PDE-5.6 Sebbene il sildenafil, il tadalafil e il vardenafil siano specifici per la PDE 5, questi agenti hanno dimostrato di avere effetti inibitori sulla PDE 6, un isoenzima espresso nei bastoncelli e nei coni dell’occhio. Si teorizza che l’inibizione della PDE 6 provochi i numerosi disturbi visivi associati a questa classe di farmaci.7-9 Gli inibitori della PDE-5 sono responsabili di circa il 19% delle segnalazioni della FDA di tossicità oculari associate ai farmaci, il che ne fa la classe di farmaci più comunemente riportata associata a questa tossicità.10
NAION: La sorveglianza post-marketing ha collegato gli inibitori della PDE-5 alla neuropatia ottica ischemica anteriore non arteritica (NAION). Questa potenziale relazione ha sollevato controversie. Dal 2000, sono stati pubblicati in letteratura almeno 20 casi che descrivono l’uso degli inibitori della PDE-5 e il sospetto di NAION.11,12 La maggior parte della letteratura pubblicata è relativa all’uso del sildenafil, poiché questo è stato il primo agente di questa classe ad essere commercializzato (il sildenafil è stato introdotto nel 1998, 5 anni prima del tadalafil e del vardenafil). Fino ad oggi, non ci sono stati rapporti di casi pubblicati riguardanti il vardenafil.
La NAION è un disordine oculare piuttosto raro nella popolazione generale che si verifica improvvisamente, è solitamente indolore e provoca una perdita parziale irreversibile della vista.11,13 Sebbene sia la neuropatia ottica acuta più comune nelle persone di età superiore ai 50 anni, negli Stati Uniti vengono riportati solo tra i 1.500 e i 6.000 casi all’anno.14 L’eziologia della NAION non è ben compresa, ma si ritiene che sia causata da una carenza di sangue al nervo ottico. Un fattore di rischio ben stabilito per lo sviluppo della NAION si verifica in individui che hanno un disco piccolo e una coppa fisiologica piccola o assente (cioè, quando il nervo ottico è quasi grande come l’apertura nella parte posteriore dell’occhio e il disco ottico appare “affollato”), noto anche come disco a rischio o disco affollato. Altri fattori di rischio associati includono diabete, ipertensione, ipercolesterolemia, aterosclerosi, cardiopatia ischemica, apnea notturna e ipotensione notturna. Molti di questi fattori di rischio sono anche associati alla DE.8,11
Tra i casi di NAION riportati, la maggior parte si è verificata entro 24 ore dalla somministrazione, di solito al risveglio al mattino. I pazienti presentavano visione offuscata e perdita del campo visivo.15 Inoltre, la maggior parte dei pazienti è risultata avere il disco affollato come fattore di rischio insieme a varie malattie cardiovascolari, che sono considerate fattori di rischio sia per la NAION che per la DE.
In uno studio retrospettivo di coorte che ha utilizzato i database clinici e farmaceutici della National Veterans Health Administration dal 2004 al 2005, è stata valutata una coorte di 2 anni di uomini (circa 4 milioni) di almeno 50 anni senza una precedente storia di malattia del nervo ottico.16 Circa l’11,5% di questi pazienti ha ricevuto un inibitore della PDE-5; alla maggior parte è stato prescritto sildenafil 100 mg. Da questa coorte, lo 0,09% dei pazienti ha avuto una diagnosi di nuova neuropatia ottica ischemica, con un rischio relativo di 1,02 (intervallo di confidenza al 95%, 0,92-1,12).
Un altro studio retrospettivo ha valutato 38 uomini con NAION e li ha confrontati con 38 uomini senza una storia di malattia.17 Non c’era una marcata differenza generale nell’uso di PDE-5 inibitori in entrambi i gruppi; tuttavia, è stata osservata un’associazione significativa per quei pazienti con una storia di infarto del miocardio e l’uso di PDE-5 inibitori e la comparsa di NAION (P = .04). Allo stesso modo, l’incidenza di NAION era maggiore in quei pazienti con una storia di ipertensione e uso di inibitori PDE-5, anche se questo non era significativo (P = .07).17
Il meccanismo d’azione di questo effetto avverso degli inibitori PDE-5 non è del tutto compreso, e questo è in parte dovuto al fatto che il meccanismo d’azione per lo sviluppo di NAION non è pienamente compreso. È stato suggerito che l’ipotensione notturna possa giocare un ruolo nello sviluppo della NAION, e che gli inibitori della PDE-5 possano potenziare questo effetto, con conseguente ischemia del nervo ottico.12,13,18
L’incidenza dei casi di NAION negli uomini che usano inibitori della PDE-5 in tutto il mondo è coerente con quella della popolazione generale degli Stati Uniti.14 L’Organizzazione Mondiale della Sanità (OMS) e la FDA hanno identificato l’associazione tra NAION e inibitori della PDE-5 come causalità “possibile”. Un evento avverso “possibile” “si verifica entro un tempo ragionevole dopo la somministrazione del farmaco, ma potrebbe anche essere spiegato da una malattia concomitante o da altri farmaci o sostanze chimiche. In questa categoria mancano o non sono chiari i dati di dechallenge positivi”.2 Nel 2005, la FDA ha raccomandato di aggiornare l’etichettatura del prodotto per contenere una dichiarazione che descriva questa associazione temporale con l’uso degli inibitori della PDE-5. Ad oggi, non ci sono prove convincenti che suggeriscano che l’uso degli inibitori della PDE-5 sia associato ad una maggiore incidenza di NAION.
I pazienti che hanno avuto un episodio di NAION dovrebbero evitare di usare gli inibitori della PDE-5, poiché tali individui possono essere suscettibili di sviluppare NAION nell’occhio controlaterale.13,19,20 Alcuni oftalmologi conservatori possono anche raccomandare di evitare l’uso di questi agenti in quei pazienti che hanno un piccolo disco a rischio, un criterio che può richiedere a tutti i pazienti un esame oftalmologico prima di iniziare il trattamento.13 I pazienti che stanno usando gli inibitori della PDE-5 dovrebbero essere consigliati sul rischio di sviluppo di NAION. Se notano un’improvvisa perdita della vista, devono interrompere l’uso dell’inibitore PDE-5 e consultare immediatamente un medico. Tutti i casi devono essere segnalati alla FDA, comprese le informazioni sulla durata e la dose del farmaco, il tempo trascorso dall’ingestione dell’inibitore PDE-5 alla comparsa dei risultati, e qualsiasi risultato dell’esame oftalmologico.19
Amiodarone: Questo farmaco, un agente antiaritmico di classe III usato principalmente per le aritmie ventricolari, è stato implicato in vari tipi di cambiamenti della vista, tra cui anomalie corneali, effetti congiuntivali e neuropatia ottica, ma l’esatto meccanismo della neuropatia ottica non è noto.21 Sono stati riportati cambiamenti della vista con prevalenza variabile dallo 0% all’11,4% nei pazienti che assumono questo farmaco; in uno studio la neuropatia ottica è stata riscontrata nell’1,79% dei pazienti.20 La condizione è tipicamente insidiosa nell’insorgenza, impiega mesi per risolversi e si presenta bilateralmente.4,21,22 È stato notato che la neuropatia ottica indotta da amiodarone è molto simile alla NAION, ma differisce da essa in quanto la NAION mostra tipicamente un’insorgenza rapida, una risoluzione rapida e una presentazione unilaterale.4,21 Distinguere la NAION dalla neuropatia ottica indotta dall’amiodarone è spesso difficile.20
Le informazioni sulla prescrizione dell’amiodarone raccomandano regolari esami oftalmici, anche al basale e poi ogni 6 mesi, per i pazienti che ricevono il farmaco.4,23 Alcuni autori hanno suggerito che esami oculistici più frequenti, ogni 4 mesi per un massimo di un anno dopo l’inizio del trattamento, possono essere giustificati.21 Come agente antiaritmico, l’amiodarone spesso non è intercambiabile con altri farmaci, e la decisione di cambiare terapia deve essere presa in consultazione con l’oculista e il cardiologo del paziente.
Linezolid: Questo antibiotico oxazolidinone è usato per la sua efficacia contro gli organismi gram-positivi, in particolare lo Staphylococcus aureus meticillino-resistente (MRSA). La sua sicurezza generale è stata dimostrata in studi clinici fino a 28 giorni di trattamento. La neuropatia ottica è stata associata all’uso a lungo termine del linezolid, con una durata del trattamento riportata che va da 5 a 11 mesi in dosi da 600 a 1.200 mg/giorno, ben al di fuori della durata degli studi clinici di 28 giorni o meno.4,24 Tuttavia, la letteratura più recente riporta una neuropatia ottica dopo una durata più breve del trattamento di soli 16 giorni.25,26
I sintomi sono graduali, e c’è un inizio indolore della perdita della vista bilaterale. La sospensione del linezolid ha portato a un miglioramento dei sintomi visivi in tutti i casi riportati. Il meccanismo della neuropatia ottica indotta dal linezolid non è noto, ma potrebbe essere dovuto alla tossicità mitocondriale dal legame con il 16S rRNA mitocondriale.27 Il linezolid penetra bene nel sistema nervoso centrale e nell’occhio, il che può portare a una maggiore neurotossicità.24,28 La sospensione del linezolid e il passaggio della terapia antibatterica a un altro agente possono favorire la guarigione, anche se in alcuni casi la continuazione del linezolid può essere necessaria per trattare adeguatamente alcune infezioni.2 Si raccomandano esami oftalmologici di base e periodici per i pazienti in trattamento con linezolid a lungo termine.4
Ethambutol: Questo farmaco, un agente di prima linea nel trattamento e nella prevenzione della tubercolosi, causa numerosi effetti avversi oculari. È stato ben documentato che provoca neuropatia ottica fino al 5% dei pazienti che assumono il farmaco.2 Il meccanismo di questo effetto avverso non è completamente chiaro, ma è stato ipotizzato che sia legato alla chelazione del rame nelle cellule retiniche.4
La maggior parte dei pazienti con questo effetto avverso aveva assunto dosi da 60 a 100 mg/kg/giorno con comparsa dei sintomi dopo 2-12 mesi di trattamento.4,29 La dose giornaliera di etambutolo approvata dalla FDA nel trattamento della tubercolosi è di 15-25 mg/kg/giorno. Si pensa che la neuropatia ottica indotta dall’etambutolo sia correlata alla dose; si verifica in percentuali del 18% dei pazienti con una dose di 35 mg/kg/giorno, dal 5% al 6% con 25 mg/kg/giorno, e meno dell’1% con 15 mg/kg/giorno.30 Si raccomanda un aggiustamento del dosaggio per i pazienti con insufficienza renale, poiché una clearance inadeguata del farmaco può portare a un’ulteriore tossicità oculare.
La perdita della vista associata all’etambutolo è stata comunemente riportata come reversibile; tuttavia, può essere irreversibile in certe popolazioni, compresi i pazienti geriatrici e quelli che hanno ricevuto il farmaco cronicamente.30
L’etambutolo è controindicato nei pazienti con una storia di neurite ottica a meno che il giudizio clinico ne giustifichi l’uso.31 Devono essere condotti esami oculistici di base e periodici; le informazioni per la prescrizione dell’etambutolo raccomandano esami mensili per i pazienti che assumono >15 mg/kg/giorno.31 Alcuni autori hanno suggerito che i test annuali possono essere appropriati per quei pazienti che assumono <15 mg/kg/giorno, con un monitoraggio più frequente per quelli ad alto rischio di sviluppare neuropatia ottica. Questo includerebbe i pazienti sopra i 60 anni o sotto i 16 anni; quelli con malattia renale, alcolismo o neuropatia periferica; quelli che prendono più di 15 mg/kg/giorno; o trattamento per più di 6 mesi.2 I pazienti che mostrano sintomi di neuropatia ottica devono essere valutati e il farmaco deve essere interrotto.
Isoniazid: Questo antibiotico è un altro farmaco usato nel trattamento e nella prevenzione della tubercolosi. È stato segnalato come causa di neuropatia ottica; tuttavia, poiché l’isoniazide è usato insieme all’etambutolo, che è anche implicato nella neuropatia ottica, determinare la causa dei problemi di visione è spesso difficile.20 Si pensa che la neuropatia ottica indotta dall’isoniazide sia meno frequente e reversibile.2
Trattamento
La valutazione oftalmica tempestiva è fondamentale, e questo, insieme alla sospensione del farmaco incriminato quando possibile, costituisce la base del trattamento della neuropatia ottica indotta da farmaci.4 Mentre la sospensione del farmaco è spesso raccomandata, questo può non essere sempre possibile, poiché farmaci come l’amiodarone, il linezolid e l’etambutolo possono essere necessari per trattare il paziente in modo ottimale. In queste circostanze, è necessario un attento monitoraggio e una cura continua da parte di un oftalmologo.
Implicazioni
Molti farmaci possono causare effetti avversi oculari e i potenziali rischi dovrebbero essere discussi con i pazienti prima di iniziare la terapia. I farmacisti sono nella posizione unica di essere il fornitore di assistenza sanitaria più accessibile; possono essere quelli che i pazienti consultano più probabilmente quando sperimentano effetti avversi dovuti ai loro farmaci. Potrebbe non essere possibile conoscere tutti gli effetti avversi oculari indotti dai farmaci, ma è importante riconoscere che molti farmaci sistemici possono influenzare la salute degli occhi. La rilevazione precoce può potenzialmente prevenire o minimizzare un danno grave. I farmacisti devono essere consapevoli che la maggior parte dei pazienti che soffrono di neuropatia ottica indotta da farmaci si presentano con una diminuzione della vista.2 Qualsiasi paziente che lamenta un improvviso e indolore declino della vista deve essere avvisato di segnalare immediatamente questi cambiamenti.
Oltre a contattare la FDA e il produttore del farmaco, i farmacisti possono segnalare casi sospetti di neuropatia ottica indotta da farmaci al National Registry of Drug-Induced Ocular Side Effects (www.eyedrugregistry.com). Le informazioni che saranno utili quando si segnalano le reazioni avverse oculari includono il nome del farmaco, la durata e la dose; il tempo dall’ingestione del farmaco alla comparsa dei risultati; e qualsiasi risultato dell’esame oftalmologico.
1. O’Neill EC, Danesh-Meyer HV, Connell PP, et al. La testa del nervo ottico nelle neuropatie ottiche acquisite. Nat Rev Neurol. 2010;6:221-236.
2. Lloyd MJ, Fraunfelder FW. Neuropatie ottiche indotte da farmaci. Farmaci Oggi. 2007;43:827-836.
3. Spiteri MA, James DG. Reazioni oculari avverse ai farmaci. Postgrad Med J. 1983;59:343-349.
4. Li J, Tripathi RC, Tripathi BJ. Disturbi oculari indotti da farmaci. Drug Saf. 2008;21:127-141.
5. Kaakeh Y, Abel SR. Disturbi visivi. In: Tisdale JE, Miller DA, eds. Malattie indotte da droghe: Prevenzione, individuazione e gestione. 2a ed. Bethesda, MD: American Society of Health-Systems Pharmacists; 2010:
250-274.
6. Hatzimouratidis K, Hatzichristou D. Inibitori della fosfodiesterasi tipo 5: il giorno dopo. Eur Urol. 2007;51:75-89.
7. Lee M. Capitolo 86. Disfunzione erettile. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmacoterapia: A Pathophysiologic Approach. 7° ed. New York, NY: McGraw-Hill; 2010. www.accesspharmacy.com/content.aspx?aID=3209583. Accessed February 24, 2011.
8. Kerr NM, Danesh-Meyer HV. Inibitori della fosfodiesterasi e l’occhio. Clin Experiment Ophthalmol. 2009;37:514-523.
9. Bischoff E. Potenza, selettività e conseguenze della non selettività dell’inibizione della PDE. Int J Impot Res. 2004;16(suppl 1):S11-S14.
10. Barbehenn E, Lurie P, Wolfe SM, et al. Petizione alla FDA per richiedere un’avvertenza sulla scatola nera per i farmaci per la disfunzione erettile sildenafil (Viagra), tadalafil (Cialis), vardenafil (Levitra) per avvertire della potenziale perdita irreversibile della vista. Public Citizen. 20 ottobre 2005. www.citizen.org/hrg1753. Accesso 24 febbraio 2011.
11. Laties AM. Disturbi della vista e inibitori della fosfodiesterasi di tipo 5: una revisione delle prove ad oggi. Sicurezza dei farmaci. 2009;32:1-18.
12. Danesh-Meyer HV, Levin HA. Farmaci per la disfunzione erettile e rischio di neuropatia ottica ischemica anteriore: associazione casuale o causale? Br J Ophthalmol. 2007;91:1551-1555.
13. Carter JE. Neuropatia ottica ischemica anteriore e ictus con uso di inibitori PDE-5 per la disfunzione erettile: causa o coincidenza? J Neurol Sci. 2007;262:89-97.
14. Gorkin L, Hvidsten, Sobel RE, et al. Uso di citrato di Sildenafil e l’incidenza di neuropatia ottica ischemica anteriore non arteriosa. Int J Clin Practice. 2006;60:500-503.
15. Pomeranz HD, Bhavsar AR. Neuropatia ottica ischemica non arteriosa che si sviluppa subito dopo l’uso di sildenafil (Viagra): un rapporto di sette nuovi casi. J Neurol Ophthalmol. 2005;25:9-13.
16. Margo CE, French DD. Neuropatia ottica ischemica in veterani maschi prescritti inibitori della fosfodiesterasi-5. Am J Ophthalmol. 2007;143:538-539.
17. McGwin G, Vaphiades MS, Hall TA, et al. Neuropatia ottica ischemica anteriore non arteritica e il trattamento della disfunzione erettile. Br J Ophthalmol. 2006;90:154-157.
18. Fraunfelder FW. Effetti collaterali visivi associati agli agenti di disfunzione erettile. Am J Ophthalmol. 2005;140:723-724.
19. McKoy JM, Bolden CR, Samaras A, et al. Neuropatia ottica associata a Sildenafil e tadalafil: implicazioni per gli uomini dopo il trattamento del cancro alla prostata. Comunità Oncol. 2009;6:78-79.
20. Santaella RM, Fraunfelder FW. Effetti avversi oculari associati a farmaci sistemici. Farmaci. 2007;67:75-93.
21. Johnson LN, Krohel GB, Thomas ER. Lo spettro clinico della neuropatia ottica associata all’amiodarone. J Nat Med Assoc. 2004;96:1477-1491.
22. Mantyjarvi M, Tuppurainen K, Ikaheimo K. Effetti collaterali oculari dell’amiodarone. Surv Ophthalmol. 1998;42:360-366.
23. Cordarone (amiodarone HCl) foglietto illustrativo. Philadelphia, PA: Wyeth Pharmaceuticals, Inc; dicembre 2010.
24. Jahaveri M, Khurana RN, O’Hearn TM, et al. neuropatia ottica indotta da Linezolid: un disturbo mitocondriale? Br J Ophthalmol. 2007;91:111-115.
25. Azamfirei L, Copotoiu SM, Branzaniuc K, et al. Cecità completa dopo neuropatia ottica indotta da un trattamento a breve termine con linezolid in un paziente affetto da distrofia muscolare. Pharmacoepidemiol Drug Saf. 2007;16:402-404.
26. Joshi L, Taylor SR, Large O, et al. Un caso di neuropatia ottica dopo l’uso a breve termine di linezolid in un paziente con leucemia linfocitica acuta. Clin Infect Dis. 2009;48:e73-e74.
27. Narita M, Tsuji BT, Yu VL. Linezolid-associato neuropatia periferica e ottica, acidosi lattica, e la sindrome della serotonina. Farmacoterapia. 2007;27:1189-1197.
28. Rucker JC, Hamilton SR, Bardenstein D, et al. Neuropatia ottica tossica associata a Linezolid. Neurologia. 2006;66:595-598.
29. Melamud A, Kosmorsky GS, Lee MS. Tossicità oculare dell’etambutolo. Mayo Clin Proc. 2003;78:1409-1411.
30. Kokkada SB, Barthakur R, Natarajan M, et al. Effetti collaterali oculari dei farmaci antitubercolari – un focus sulla prevenzione, la diagnosi precoce e la gestione. Kathmandu Univ Med J. 2005;3:438-441.
31. Myambutol (etambutolo) foglietto illustrativo. Northport, NY: X-Gen Pharmaceuticals, Inc; maggio 2007.
0 commenti