Estrogeni e DE nella ricerca di base
Interessante, la somministrazione di estrogeni diminuisce la funzione erettile nei modelli animali. I ricercatori hanno somministrato estradiolo per via orale ai ratti, ottenendo alti livelli di estradiolo e bassi livelli di testosterone. Inoltre, la risposta della pressione intracavernosa (ICP) alla stimolazione nervosa è stata compromessa in tutti i gruppi trattati, e la colorazione tricromica ha dimostrato la presenza di iperplasia del tessuto connettivo cavernoso nei gruppi di studio a lungo termine. La somministrazione orale di estradiolo ai conigli ha prodotto alti livelli di estradiolo e bassi livelli di testosterone, simili agli effetti nei ratti. Inoltre, l’acetilcolina ha indotto il rilassamento mediato dall’endotelio negli animali normali, ma questo effetto è stato significativamente attenuato nei gruppi trattati, e la neurotrasmissione non adrenergica e non colinergica mediata da NO è diminuita nei gruppi di trattamento. Inoltre, abbiamo somministrato testosterone ai ratti con carenza di testosterone indotta da estrogeni elevati; tuttavia, la funzione erettile non è migliorata. È interessante notare che la somministrazione di estrogeni aumenta la contrazione della muscolatura liscia nei corpi cavernosi, aumentando la via di segnalazione RhoA/Rho-chinasi, che è coinvolta nella DE. Vignozzi et al. hanno dimostrato che la DE indotta dalla dieta ad alto contenuto di grassi è associata ad alti livelli di estradiolo, piuttosto che a bassi livelli di testosterone.
Abbiamo anche studiato l’influenza dello squilibrio estradiolo-testosterone sulla funzione erettile nei ratti (Figure 1-6; Tabella 1). I ratti maschi Wistar ST (11 settimane di età, Japan SLC Inc., Hamamatsu, Giappone) sono stati separati in cinque gruppi. Nel gruppo a basso testosterone (Low-T) (n = 11), i ratti sono stati iniettati con goserelin (LH-RH agonista, 0.9 mg/kg, s.c.). Nel gruppo di testosterone basso ed estrogeno alto (Low-T/High-E) (n = 11), i ratti sono stati iniettati con goserelin ed estradiolo (3 μg/kg/giorno, s.c.) ogni giorno dalla settimana 2 alla 4. Nel gruppo di estrogeno alto (High-E) (n = 11), i ratti sono stati iniettati con estradiolo ogni giorno dalla settimana 2 alla 4. Nel gruppo estrogeni e testosterone (High-E/High-T) (n = 11), i ratti sono stati iniettati con estradiolo e testosterone (3 mg / kg / giorno, s.c.) ogni giorno dalle settimane 2 a 4. Nel gruppo di controllo (n = 11), i ratti non sono stati iniettati con qualsiasi ormone. La tabella 1 mostra le concentrazioni di ormoni sessuali nei ratti. L’iniezione di goserelin ha diminuito significativamente il testosterone biodisponibile nel siero (controllo: 1.20 ± 0.13 ng/mL, Low-T: 0.55 ± 0.04 ng/mL, P < 0.01 rispetto al controllo; Low-T/High-E: 0.73 ± 0.06 ng/mL, P < 0.05 rispetto al controllo). L’iniezione di testosterone ha aumentato significativamente il testosterone biodisponibile nel siero (controllo: 1,20 ± 0,13 ng/mL, High-E/High-T: 2,58 ± 0,31 ng/mL, P < 0,001 rispetto al controllo). L’iniezione di estradiolo ha aumentato significativamente gli estrogeni nel siero (controllo: 102.5 ± 8.7 pg./mL, Low-T/High-E: 275.4 ± 34.4 pg./mL, P < 0.01 rispetto al controllo; Alta-E: 332,3 ± 17,4 pg./mL, P < 0,001 rispetto al controllo; Alta-E/Alta-T: 401,5 ± 51,6 pg./mL, P < 0,001 rispetto al controllo).
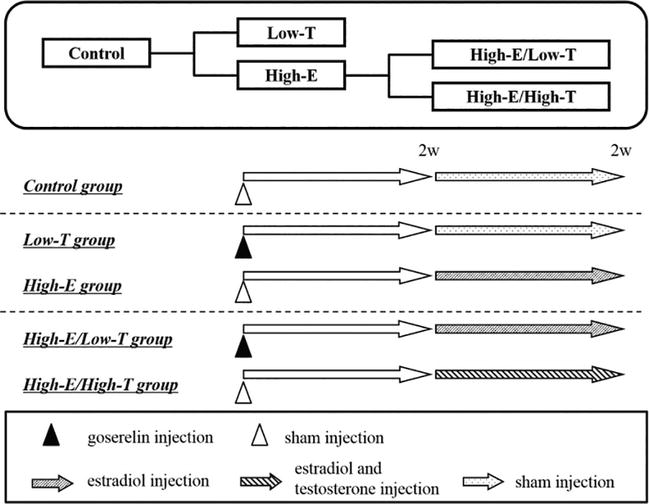
Figura 1.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceDisegno sperimentale. Nel gruppo di controllo, i ratti sono stati iniettati con veicolo per 2 settimane. Nei gruppi Low-T e High-E, i ratti sono stati iniettati con goserelin acetato (agonista LH-RH, 0.9 mg/kg per via sottocutanea) al giorno 0. Nel gruppo trattato con estrogeni (High-E), i ratti sono stati iniettati con estradiolo (3 mg/kg/giorno per via sottocutanea) per 2 settimane. Nel gruppo trattato con estrogeni e testosterone (High-E/High-T), i ratti sono stati iniettati con estradiolo (3 mg/kg/giorno per via sottocutanea) e testosterone (3 mg/kg/giorno per via sottocutanea) per 2 settimane. Alla fine del periodo, i ratti sono stati sottoposti a test della funzione erettile in vivo o in vitro.

Figura 2.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceMisurazione della pressione intracavernosa (ICP). Variazioni massime di ICP durante la stimolazione elettrica del nervo cavernoso nel controllo, Low-T, High-E, High-E/Low-T, e High-E/High-T gruppi. I dati rappresentano le medie ± errori standard dei mezzi (n = 6 per gruppo). **P < 0,01 rispetto al gruppo di controllo mediante analisi della varianza e test t multiplo tipo Bonferroni.
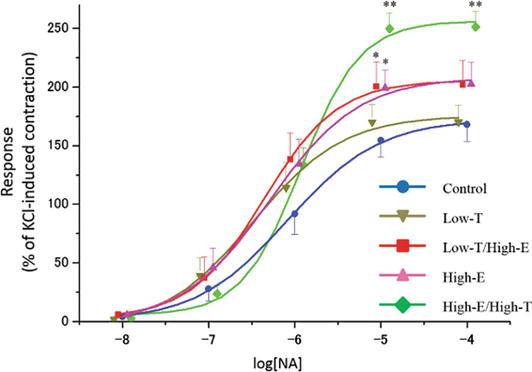
Figura 3.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceLe curve di contrazione indotte dalla noradrenalina (NA) nelle strisce dei corpi cavernosi di ratto. Il tono contrattile indotto da 80 mM KCl è stato preso come 100%. I dati riportati in tutti i grafici rappresentano le medie ± errori standard delle medie (n = 5 per gruppo). *P < 0.05, **P < 0.01 rispetto al gruppo di controllo mediante analisi della varianza e test t multiplo tipo Bonferroni. I valori Emax sono riportati nel testo.
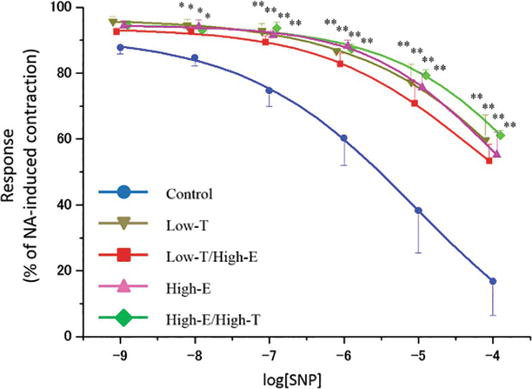
Figura 4.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceLa curva di rilassamento indotta da nitroprussiato di sodio (SNP) in strisce di corpus cavernosum di ratto. Le strisce sono state precontratte utilizzando 10-5 M NA. I dati riportati in tutti i grafici rappresentano le medie ± errori standard delle medie (n = 5 per gruppo). *P < 0.05, **P < 0.01 rispetto al gruppo di controllo mediante analisi della varianza e test t multiplo tipo Bonferroni. I valori Emax sono riportati nel testo.

Figura 5.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceLe curve di rilassamento indotte dall’inibitore della Rho-chinasi Y-27632 in strisce del corpo cavernoso di ratto. Le strisce sono state precontratte utilizzando 10-5 M NA. I dati riportati in tutti i grafici rappresentano le medie ± errori standard delle medie (n = 5 per gruppo). *P < 0.05, **P < 0.01 rispetto al gruppo di controllo mediante analisi della varianza e test t multiplo tipo Bonferroni. I valori IC50 sono riportati nel testo.
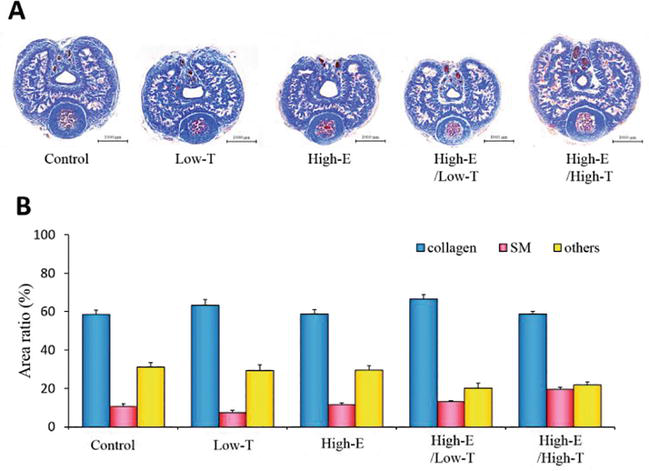
Figura 6.
xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceLe sezioni del pene di ratto della colorazione tricromica di Masson. (A) Campioni rappresentativi dei corpi cavernosi di ogni gruppo di ratti. (B) Valutazione istologica dei tessuti. I rapporti di area delle fibre di collagene, del muscolo liscio (SM) e di altri sono stati calcolati usando l’analisi computerizzata dell’immagine. I dati riportati in tutti i grafici rappresentano le medie ± errori standard delle medie (n = 3 per gruppo).
| Bio-T (ng/mL) | Estrogeni (pg/mL) | ||
|---|---|---|---|
| Controllo | 1.20 ± 0,13 | 102,5 ± 8,7 | |
| Low-T | 0,55 ± 0,04** | 51,2 ± 4.2 | |
| High-E | 0,90 ± 0,12 | 332,3 ± 17,4** | |
| High-E/Low-T | 0.73 ± 0,06* | 275,4 ± 34,4** | |
| High-E/High-T | 2,58 ± 0,31** | 401,5 ± 51.6** |
Tabella 1.
Livelli sierici di estrogeni e testosterone biodisponibile (bio-T) nei ratti.
I dati sono espressi come medie ± errori standard delle medie. *P < 0,05, **P < 0,01 rispetto al gruppo di controllo mediante analisi della varianza e test t multiplo tipo Bonferroni (n = 6 per gruppo).
La figura 2 mostra la risposta erettile alla stimolazione del campo elettrico del nervo cavernoso nei diversi gruppi sperimentali. L’analisi del rapporto ICP/MAP ha rivelato che i rapporti nei gruppi Low-T (0,52 ± 0,03), Low-T/High-E (0,46 ± 0,03), High-E (0,44 ± 0,03), e High-E/High-T (0,44 ± 0,02), che rappresentavano tutti i ratti trattati, erano significativamente inferiori rispetto al gruppo di controllo (0,70 ± 0,04, P < 0,01). Questi dati hanno suggerito che le risposte erettili erano diminuite nei ratti con uno squilibrio degli ormoni sessuali.
La figura 3 mostra la risposta contrattile delle strisce di corpora cavernosa di ratto a concentrazioni crescenti di noradrenalina (NA). Concentrazioni crescenti di NA sono state trovate per contrarre le strisce dei corpi cavernosi di ratto in tutti i gruppi. In particolare, 10 μM NA ha portato a differenze statisticamente significative nella risposta contrattile peniena in vitro tra i gruppi sperimentali (controllo: 154,5 ± 14,1%, Low-T: 169,8 ± 14,8%, Low-T/High-E: 200,2 ± 21,1%, High-E: 198,9 ± 15,3%, High-E/High-T: 249,7 ± 13,5%). Anche se la risposta contrattile non differiva tra il gruppo di controllo e il gruppo Low-T (P > 0,05), le risposte contrattili nei gruppi Low-T/High-E, High-E, e High-E/High-T erano superiori alla risposta nel gruppo di controllo (P < 0.05).
Le figure 4 e 5 mostrano la risposta rilassante delle strisce di corpora cavernosa di ratto precontratte con NA a concentrazioni crescenti di nitroprussiato di sodio (SNP) e Y-27632. In tutti i gruppi, concentrazioni crescenti del donatore di NO SNP rilassato strisce corpora cavernosa ratto (controllo: Emax = 16,8 ± 10,3%, Low-T: Emax = 59,7 ± 7,6%, Low-T/High-E: Emax = 53,4 ± 5,0%, High-E: Emax = 55,2 ± 6,8%, High-E/High-T: Emax = 61,1 ± 1,5%). Nei gruppi trattati, le sensibilità a SNP erano significativamente più basse che nel gruppo di controllo (P < 0.01). Concentrazioni crescenti dell’inibitore della Rho chinasi Y-27632 hanno completamente rilassato le strisce dei corpi cavernosi di ratto in tutti i gruppi (controllo: concentrazione inibitoria semimassima = 1,22 × 10-6 M, Low-T: IC50 = 2,43 × 10-7 M, Low-T/High-E: IC50 = 1,31 × 10-7 M, High-E: IC50 = 2,26 × 10-7 M, High-E/High-T: IC50 = 1,25 × 10-7 M). Quando si utilizza 10-6 M e 10-5 M Y-27632, le sensibilità a Y-27632 nei gruppi trattati erano significativamente inferiori rispetto al gruppo di controllo (P < 0.01); quindi, i grafici per i gruppi trattati sono stati spostati a sinistra.
La figura 6 mostra l’analisi istologica dei corpi cavernosi dei ratti. Il rapporto di area del muscolo liscio cavernoso è stato analizzato (controllo: 10,5 ± 1,4%, Low-T: 7,4 ± 1,1%, Low-T/High-E: 13,2 ± 0,4%, High-E: 11,6 ± 0,1%, High-E/High-T: 19,4 ± 1,1%). Allo stesso modo, è stato analizzato il rapporto di area della fibra di collagene (controllo: 58,4 ± 2,5%, Low-T: 63,2 ± 3,0%, Low-T/High-E: 66,5 ± 2,3%, High-E: 58,8 ± 2,2%, High-E/High-T: 58,7 ± 1,4%). Non sono state osservate differenze statisticamente significative tra i gruppi sperimentali nei rapporti complessivi di area del muscolo liscio, delle fibre collagene e di altri parametri secondo i test χ2 per l’indipendenza (P > 0,05). Nel complesso, abbiamo dimostrato che i cambiamenti nel milieu degli ormoni sessuali hanno influenzato la funzione erettile nei ratti, e la nostra ipotesi che lo squilibrio degli ormoni sessuali associato alla DE è stata supportata sia da esperimenti in vivo che in vitro utilizzando strumenti farmacologici.
0 commenti