È stato notato l’uso dell’idruro di litio alluminio (LiAlH4) e della boroidruro di sodio (NaBH4) come reagenti per la riduzione di aldeidi e chetoni rispettivamente a 1º e 2º-alcoli. Di questi, l’idruro di alluminio e litio, spesso abbreviato in LAH, è il più utile per la riduzione dei derivati dell’acido carbossilico. Grazie alla sua alta reattività, il LAH riduce facilmente tutte le classi di derivati dell’acido carbossilico, generalmente allo stato di ossidazione -1. Acidi, esteri, anidridi e cloruri acilici sono tutti ridotti a 1º-alcoli, e questo metodo è superiore alla riduzione catalitica nella maggior parte dei casi. Poiché i cloruri di acile e le anidridi sono costosi e richiedono tempo per essere preparati, gli acidi e gli esteri sono i reagenti più comunemente usati per questa trasformazione. Come nelle riduzioni di aldeidi e chetoni, si ritiene che il primo passo in ogni caso sia l’aggiunta irreversibile di idruro all’atomo di carbonio carbonilico elettrofilo. Il legame coordinativo dell’ossigeno carbonilico con un metallo acido di Lewis (Li o Al) aumenta senza dubbio il carattere elettrofilo di quel carbonio. Questa addizione di idruro è mostrata nei diagrammi seguenti, con l’idruro-donatore scritto come AlH4(-). Tutti e quattro gli idrogeni sono potenzialmente disponibili alla riduzione, ma quando gli acidi carbossilici sono ridotti, uno degli idruri reagisce con l’O-H acido per generare gas idrogeno. Anche se il litio non è mostrato, sarà presente nei prodotti come componente cationico dei sali ionici.
Le ammidi sono ridotte ad ammine mediante trattamento con LAH, e questo si è dimostrato uno dei metodi più generali per preparare tutte le classi di ammine (1º, 2º & 3º). Poiché il risultato della riduzione LAH è così diverso per gli esteri e le ammidi, dobbiamo esaminare meccanismi di reazione plausibili per queste reazioni per scoprire una ragione per questo comportamento divergente.
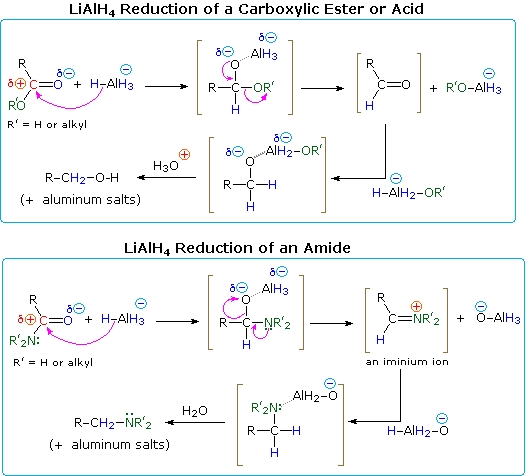
Una spiegazione del diverso andamento delle riduzioni degli esteri e delle ammidi sta nella natura dei diversi sostituenti etero atomici sul gruppo carbonilico (colorato in verde nel diagramma). L’azoto è più basico dell’ossigeno, e gli anioni amidici sono gruppi di partenza più poveri degli anioni alcossidi. Inoltre, l’ossigeno forma legami particolarmente forti con l’alluminio. L’aggiunta di idruro produce un intermedio tetraedrico, mostrato tra parentesi, che ha un legame polare ossigeno-alluminio. Né l’idrogeno né il gruppo alchilico (R) è un possibile gruppo di partenza, quindi se questa specie tetraedrica deve subire un’eliminazione per riformare un doppio legame etero atomico, uno dei due sostituenti rimanenti deve essere perso. Per l’estere questa è una scelta facile (descritta dalle frecce curve). Eliminando un alcossido di alluminio (R’O-Al), si forma un’aldeide, che viene rapidamente ridotta al sale di un 1º-alcol da LAH. Nel caso dell’ammide, la formazione dell’aldeide richiede la perdita di un’ammide di alluminio (R’2N-Al), un processo improbabile. In alternativa, l’azoto più basico può agire per espellere una specie di ossido metallico (ad esempio Al-O(-)), e il doppio legame iminio risultante verrebbe poi ridotto a un’ammina. Questo è il corso seguito dalla maggior parte delle riduzioni delle ammidi; ma nel caso delle 1º-ammidi, l’acidità degli idrogeni dell’azoto accoppiata con la basicità dell’idruro permette una facile eliminazione dell’ossigeno (come moiety di ossido). L’intermedio nitrile risultante viene poi ridotto a una 1º-ammina. I nitrili sono infatti un prodotto importante quando si usa meno di un’equivalenza completa di LiAlH4. Un meccanismo sarà mostrato sopra cliccando sul diagramma.
L’idruro di litio alluminio riduce i nitrili a 1º-ammine, come mostrato nella seguente equazione. Una prima aggiunta di idruro all’atomo di carbonio elettrofilo del nitrile genera il sale di un intermedio imminico. Questo è seguito da un secondo trasferimento di idruro, e il sale di ammina metallica risultante è idrolizzato a una 1º-ammina. Questo metodo fornisce un’utile alternativa alla riduzione catalitica dei nitrili, descritta sopra, quando sono presenti funzioni alcheniche o alchiniche.
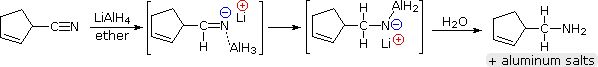
In contrasto con l’utilità dell’idruro di alluminio e litio nella riduzione di vari derivati dell’acido carbossilico, la boroidride di sodio è raramente scelta per questo scopo. In primo luogo, NaBH4 è spesso usato in solventi idrossilici (acqua e alcoli), e questi reagirebbero con cloruri acilici e anidridi. Inoltre, è scarsamente solubile in solventi relativamente non polari, soprattutto a basse temperature. In secondo luogo, NaBH4 è molto meno reattivo di LAH, non riuscendo a ridurre le ammidi e gli acidi (formano sali di carbossilato) a tutti, e riducendo gli esteri molto lentamente.
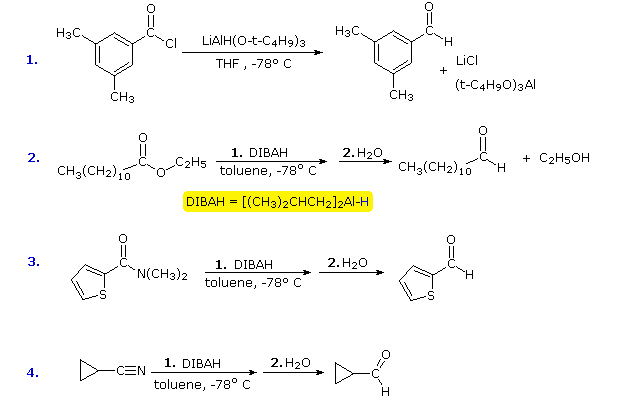
Poiché esistono relativamente pochi metodi per la riduzione dei derivati dell’acido carbossilico alle aldeidi, sarebbe utile modificare la reattività e la solubilità di LAH per consentire riduzioni parziali di questo tipo da ottenere. L’approccio più fruttuoso a questo scopo è stato quello di attaccare gruppi alcossi o alchilici sull’alluminio. Questo non solo modifica la reattività del reagente come donatore di idruro, ma aumenta anche la sua solubilità in solventi non polari. Due di questi reagenti saranno menzionati qui; l’atomo di idruro reattivo è colorato di blu.
![]() Litio tri-terz-butossiluminoidruro (LtBAH), LiAl3H : Solubile in THF, digliceme & etere.
Litio tri-terz-butossiluminoidruro (LtBAH), LiAl3H : Solubile in THF, digliceme & etere.![]() Diisobutylaluminum hydride (DIBAH), 2AlH : Solubile in toluene, THF & etere.
Diisobutylaluminum hydride (DIBAH), 2AlH : Solubile in toluene, THF & etere.
Ognuno di questi reagenti porta un equivalente di idruro. Il primo (LtBAH) è un idruro metallico complesso, ma il secondo è semplicemente un derivato alchilico dell’idruro di alluminio. In pratica, entrambi i reagenti sono usati in quantità equimolari, e di solito a temperature ben al di sotto di 0 ºC. I seguenti esempi illustrano come le aldeidi possono essere preparate da derivati dell’acido carbossilico con un’attenta applicazione di questi reagenti. Una temperatura di -78 ºC è facilmente mantenuta usando ghiaccio secco come refrigerante. Gli intermedi ridotti che portano alle aldeidi saranno visualizzati cliccando il pulsante “Show Intermediates”. Con un eccesso di reagente a temperature superiori a 0 ºC la maggior parte dei derivati degli acidi carbossilici sono ridotti ad alcoli o ammine.
Contributori
-
William Reusch, professore emerito (Michigan State U.), Virtual Textbook of Organic Chemistry
0 commenti