Descrizione
Brimonidine Tartrate Ophthalmic Solution 0.2% è un agonista alfa-2 adrenergico relativamente selettivo per uso oftalmico. In soluzione, la brimonidina tartrato soluzione oftalmica 0,2% ha un colore giallo-verde chiaro. Ha un’osmolalità di 280-330 mOsml/kg e un pH di 5,6-6,6 La formula strutturale è
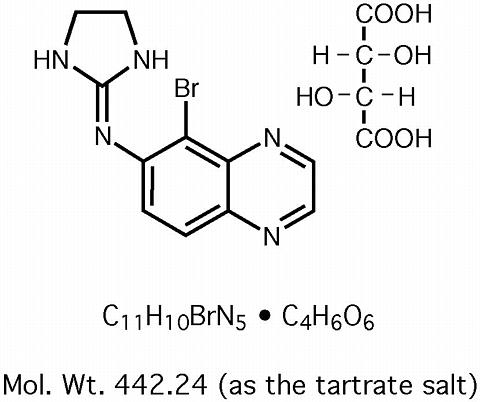
Nome chimico: 5-bromo-6-(2-imidazolidinylideneamino) quinoxaline L-tartrato.
Numero CAS 59803-98-4
Ogni mL contiene:
ATTIVO: Brimonidina tartrato: 0,2% (2 mg/mL).
INATTIVI: Acido citrico, alcool polivinilico, cloruro di sodio, citrato di sodio, acqua purificata. Acido cloridrico e/o idrossido di sodio possono essere aggiunti per regolare il pH.
PRESERVATIVO AGGIUNTO: cloruro di benzalconio (0,05 mg).
Farmacologia clinica
Meccanismo di azione: Brimonidina tartrato soluzione oftalmica 0,2% è un agonista del recettore alfa adrenergico. Ha un effetto ipotensivo oculare di picco che si verifica a due ore dopo la somministrazione. Studi fluorofotometrici negli animali e nell’uomo suggeriscono che la brimonidina tartrato ha un doppio meccanismo d’azione riducendo la produzione di umore acqueo e aumentando il deflusso uveosclerale.
Farmacocinetica: Dopo la somministrazione oculare di una soluzione allo 0,2%, le concentrazioni plasmatiche hanno raggiunto il picco entro 1-4 ore e sono diminuite con un’emivita sistemica di circa 3 ore. Negli esseri umani, il metabolismo sistemico della brimonidina è esteso. Viene metabolizzata principalmente dal fegato. L’escrezione urinaria è la via principale di eliminazione del farmaco e dei suoi metaboliti. Circa l’87% di una dose radioattiva somministrata per via orale è stata eliminata entro 120 ore, con il 74% trovato nelle urine.
Valutazioni cliniche: L’elevata IOP rappresenta un importante fattore di rischio nella perdita di campo glaucomatosa. Più alto è il livello di IOP, maggiore è la probabilità di danno al nervo ottico e di perdita del campo visivo. La brimonidina tartrato ha l’azione di abbassare la pressione intraoculare con un effetto minimo sui parametri cardiovascolari e polmonari.
In studi clinici comparativi con il timololo 0,5%, durati fino a un anno, l’effetto di abbassamento della IOP della brimonidina tartrato soluzione oftalmica 0,2% era di circa 4-6 mmHg rispetto a circa 6 mmHg per il timololo. In questi studi, entrambi i gruppi di pazienti sono stati dosati BID; tuttavia, a causa della durata d’azione di brimonidina tartrato soluzione oftalmica 0,2%, si raccomanda che brimonidina tartrato soluzione oftalmica 0,2% sia dosata TID. L’8% dei soggetti è stato interrotto dagli studi a causa di una pressione intraoculare non adeguatamente controllata, che nel 30% di questi pazienti si è verificata durante il primo mese di terapia. Circa il 20% è stato interrotto a causa di esperienze avverse.
Indicazioni e uso
Brimonidina tartrato soluzione oftalmica 0,2% è indicata per abbassare la pressione intraoculare in pazienti con glaucoma ad angolo aperto o ipertensione oculare. L’efficacia di abbassamento della IOP di brimonidina tartrato soluzione oftalmica 0,2% diminuisce nel tempo in alcuni pazienti. Questa perdita di effetto appare con un tempo di insorgenza variabile in ogni paziente e deve essere attentamente monitorata.
Contraindicazioni
Brimonidina tartrato soluzione oftalmica 0,2% è controindicata in pazienti con ipersensibilità alla brimonidina tartrato o a qualsiasi componente di questo farmaco. È anche controindicato in pazienti che ricevono una terapia con inibitori della monoamino ossidasi (MAO).
Precauzioni:
Generale: Sebbene brimonidina tartrato soluzione oftalmica 0,2% abbia avuto un effetto minimo sulla pressione sanguigna dei pazienti negli studi clinici, si deve usare cautela nel trattamento di pazienti con gravi malattie cardiovascolari.
Brimonidina tartrato soluzione oftalmica 0,2% non è stato studiato in pazienti con insufficienza epatica o renale; si deve usare cautela nel trattamento di tali pazienti.
Brimonidina tartrato soluzione oftalmica 0,2% deve essere usato con cautela in pazienti con depressione, insufficienza cerebrale o coronarica, fenomeno di Raynaud, ipotensione ortostatica o tromboangioite obliterante.
Durante gli studi si è verificata una perdita di effetto in alcuni pazienti. L’efficacia di abbassamento della IOP osservata con brimonidina tartrato soluzione oftalmica 0,2% durante il primo mese di terapia può non riflettere sempre il livello di riduzione della IOP a lungo termine. I pazienti a cui sono stati prescritti farmaci per l’abbassamento della IOP devono essere monitorati di routine per la IOP.
Informazioni per i pazienti: Il conservante in brimonidina tartrato soluzione oftalmica 0,2%, benzalconio cloruro, può essere assorbito dalle lenti a contatto morbide. I pazienti che indossano lenti a contatto morbide devono essere istruiti ad attendere almeno 15 minuti dopo l’instillazione di brimonidina tartrato soluzione oftalmica 0,2% per inserire le lenti a contatto morbide.
Come per altri farmaci di questa classe, brimonidina tartrato soluzione oftalmica 0,2% può causare affaticamento e/o sonnolenza in alcuni pazienti. I pazienti che si impegnano in attività pericolose devono essere avvertiti della possibilità di una diminuzione della vigilanza mentale.
Interazioni farmacologiche: Sebbene non siano stati condotti studi specifici di interazione farmacologica con brimonidina tartrato soluzione oftalmica 0,2%, deve essere considerata la possibilità di un effetto additivo o potenziante con depressori del SNC (alcol, barbiturici, oppiacei, sedativi o anestetici). Gli alfa-agonisti, come classe, possono ridurre il polso e la pressione sanguigna. Si consiglia cautela nell’uso di farmaci concomitanti come beta-bloccanti (oftalmici e sistemici), antipertensivi e/o glicosidi cardiaci.
Gli antidepressivi triciclici sono stati riportati per smussare l’effetto ipotensivo della clonidina sistemica. Non è noto se l’uso concomitante di questi agenti con brimonidina tartrato soluzione oftalmica 0,2% nell’uomo possa portare a una conseguente interferenza con l’effetto di abbassamento della IOP. Non sono disponibili dati sul livello di catecolamine circolanti dopo brimonidina tartrato soluzione oftalmica 0,2%. Si consiglia comunque cautela nei pazienti che assumono antidepressivi triciclici che possono influenzare il metabolismo e l’assorbimento delle amine circolanti.
Carcinogenesi, mutagenesi, compromissione della fertilità: Non sono stati osservati effetti cancerogeni legati al composto né nei topi né nei ratti dopo uno studio di 21 mesi e 24 mesi, rispettivamente. In questi studi, la somministrazione dietetica di brimonidina tartrato a dosi fino a 2,5 mg/kg/giorno nei topi e 1,0 mg/kg/giorno nei ratti ha raggiunto ~77 e 118 volte, rispettivamente, la concentrazione plasmatica del farmaco stimata negli esseri umani trattati con una goccia di brimonidina tartrato soluzione oftalmica 0,2% in entrambi gli occhi 3 volte al giorno.
Brimonidina tartrato non è risultata mutagena o citogenica in una serie di studi in vitro e in vivo tra cui il test di Ames, il test di aberrazione cromosomica in cellule ovariche di criceto cinese (CHO), un test ospite-mediato e studi citogenici nei topi, e il test letale dominante.
Studi riproduttivi eseguiti nei ratti con dosi orali di 0,66 mg base/kg non hanno rivelato alcuna prova di danno al feto dovuto alla brimonidina tartrato soluzione oftalmica 0,2%.
Gravidanza: Effetti teratogeni: Gravidanza Categoria B.
Studi riproduttivi eseguiti su ratti con dosi orali di 0,66 mg base/kg non hanno rivelato alcuna prova di danno al feto dovuto a brimonidina tartrato soluzione oftalmica 0,2%. Il dosaggio a questo livello ha prodotto 100 volte il livello di concentrazione plasmatica del farmaco visto nell’uomo in seguito a dosi oftalmiche multiple.
Non ci sono studi adeguati e ben controllati nelle donne in gravidanza. Negli studi sugli animali, la brominidina ha attraversato la placenta ed è entrata nella circolazione fetale in misura limitata. Brimonidina tartrato soluzione oftalmica 0,2% deve essere usato durante la gravidanza solo se il potenziale beneficio per la madre giustifica il potenziale rischio per il feto.
Madri che allattano: Non è noto se questo farmaco viene escreto nel latte umano; in studi su animali la brimonidina tartrato è stata escreta nel latte materno. Si deve decidere se interrompere l’allattamento o sospendere il farmaco, tenendo conto dell’importanza del farmaco per la madre.
Uso pediatrico: In uno studio clinico ben controllato condotto su pazienti pediatrici affetti da glaucoma (età da 2 a 7 anni) gli eventi avversi più comunemente osservati con brimonidina tartrato soluzione oftalmica 0,2% dosata tre volte al giorno erano sonnolenza (50% – 83% in pazienti di età da 2 a 6 anni) e diminuzione della vigilanza. Nei pazienti pediatrici di età pari o superiore a 7 anni (>20kg), la sonnolenza sembra verificarsi meno frequentemente (25%). L’evento avverso più comunemente osservato è stato la sonnolenza. Circa il 16% dei pazienti che assumevano brimonidina tartrato soluzione oftalmica hanno interrotto lo studio a causa della sonnolenza.
La sicurezza e l’efficacia di brimonidina tartrato soluzione oftalmica 0,2% non sono state studiate in pazienti pediatrici di età inferiore ai 2 anni. Brimonidina tartrato soluzione oftalmica 0,2% non è raccomandato per l’uso in pazienti pediatrici di età inferiore ai 2 anni. (Fare riferimento anche alla sezione Reazioni avverse).
Uso geriatrico: Non sono state osservate differenze complessive di sicurezza o efficacia tra pazienti anziani e altri pazienti adulti.
Reazioni avverse: Gli eventi avversi che si sono verificati in circa il 10-30% dei soggetti, in ordine decrescente di incidenza, hanno incluso secchezza orale, iperemia oculare, bruciore e puntura, mal di testa, offuscamento, sensazione di corpo estraneo, affaticamento/sonnolenza, follicoli congiuntivali, reazioni allergiche oculari e prurito oculare.
Gli eventi che si sono verificati in circa il 3-9% dei soggetti, in ordine decrescente, hanno incluso macchie corneali/erosione, fotofobia, eritema palpebrale, dolore oculare, secchezza oculare, lacrimazione, sintomi respiratori superiori, edema palpebrale, edema congiuntivale, vertigini, blefarite, irritazione oculare, sintomi gastrointestinali, astenia, sbiancamento congiuntivale, visione anomala e dolore muscolare.
Le seguenti reazioni avverse sono state riportate in meno del 3% dei pazienti: croste palpebrali, emorragia congiuntivale, gusto anormale, insonnia, perdite congiuntivali, depressione, ipertensione, ansia, palpitazioni/aritmie, secchezza nasale e sincope.
I seguenti eventi sono stati identificati durante l’uso post-marketing di brimonidina tartrato soluzione oftalmica 0,2% nella pratica clinica. Poiché sono stati segnalati volontariamente da una popolazione di dimensioni sconosciute, non è possibile effettuare stime e frequenze. Gli eventi, che sono stati scelti per l’inclusione a causa della loro gravità, frequenza di segnalazione, possibile connessione causale alla brimonidina tartrato soluzione oftalmica 0,2%, o una combinazione di questi fattori, includono: bradicardia; ipotensione; irite; miosi; reazioni cutanee (inclusi eritema, prurito palpebrale, eruzione cutanea e vasodilatazione); e tachicardia. Apnea, bradicardia, ipotensione, ipotermia, ipotonia e sonnolenza sono stati riportati in neonati che hanno ricevuto brimonidina tartrato soluzione oftalmica 0,2%.
Sovradosaggio:
Non sono disponibili informazioni sul sovradosaggio nell’uomo. Il trattamento di un sovradosaggio orale include una terapia di supporto e sintomatica; deve essere mantenuta una via aerea libera.
Dosaggio e somministrazione
La dose raccomandata è una goccia di brimonidina tartrato soluzione oftalmica 0.2% nell’occhio(i) interessato(i) tre volte al giorno, a distanza di circa 8 ore.
Brimonidine tartrate ophthalmic solution 0.2% può essere usato in concomitanza con altri prodotti farmaceutici oftalmici topici per abbassare la pressione intraoculare. Se viene usato più di un prodotto oftalmico topico, i prodotti devono essere somministrati ad almeno 5 minuti di distanza l’uno dall’altro.
Come viene fornito
Brimonidina tartrato soluzione oftalmica 0,2% viene fornita sterile in un flacone di plastica con una punta a goccia controllata nei seguenti formati:
flaconi da 5 mL – Prod. No. 41107
Bottiglie da 10 mL – Prod. No. 41109
Bottiglie da 15 mL – Prod. No. 41111
Conservazione: Conservare tra 15° – 25°C (59° – 77°F).
TENERE FUORI DALLA PORTATA DEI BAMBINI.
NON USARE SE IL “sigillo di protezione” STAMPATO IN GIALLO NON È INTATTO.
Bausch & Lomb
Pharmaceuticals, Inc.
Tampa, FL 33637
©Bausch & Lomb Incorporated
XO50280 (Folded) XM10082 (Flat)
REV. 2/04-02
Prod. No. 411
FOTO DEL PRODOTTO:
NOTA: Queste foto possono essere usate solo per l’identificazione per forma, colore e impronta. Non rappresentano le dimensioni reali o relative.
I campioni di prodotto mostrati qui sono stati forniti dal produttore. Mentre ogni sforzo è stato fatto per assicurare una riproduzione accurata, si prega di ricordare che qualsiasi identificazione visiva deve essere considerata preliminare. In caso di avvelenamento o sospetto sovradosaggio, l’identità del farmaco deve essere verificata mediante analisi chimica.
0 commenti