Introduction
Gatti e cani senza casa rappresentano una grande minaccia per la diffusione di malattie zoonotiche in tutto il mondo. 27 milioni di gatti e cani sono legati ogni anno solo negli Stati Uniti. Nel 1990, è stato previsto che negli Stati Uniti da 5,7 a 9,5 milioni di gatti e da 5,4 a 9,1 milioni di cani sono stati eutanasizzati in case per animali. Per mantenere la popolazione degli animali domestici, la sterilizzazione è espressa come il metodo più adeguato. La sterilizzazione è un approccio che danneggia i tessuti testicolari con varie sostanze chimiche, causando danni e atrofia delle cellule testicolari deducendo o fermando la consegna del sangue o la loro escissione chirurgica. La castrazione degli animali maschi è più significativa delle controparti femminili poiché i maschi hanno una maggiore capacità di produrre prole rispetto alle femmine. Oltre al suddetto obiettivo primario, la sterilizzazione è anche utilizzato per l’eradicazione delle caratteristiche sessuali secondarie dell’animale come la marcatura auricolare, il montaggio e il comportamento aggressivo verso gli altri animali. Con l’evoluzione della ricerca, gli scienziati hanno dedotto che miti come la letargia dei maschi castrati o l’ostruzione uretrale non hanno relazione con la castrazione, ma queste complicazioni sono principalmente legate al piano alimentare dell’animale e ai disturbi del tratto urinario. È generalmente percepito che i gatti non posseduti e in libertà soffrono di più di parassitismo e malattie e hanno una breve durata di vita rispetto ai gatti di proprietà. Pertanto, dedurre la popolazione di questi gatti non posseduti è un obiettivo degno di nota.
Varie tecniche di sterilizzazione sono state praticate che includono la sterilizzazione ormonale, chirurgica, meccanica e chimica. La castrazione con agenti chimici è un approccio non chirurgico per la sterilizzazione maschile. È stata praticata iniettando un agente tossico somenecrotico nei testicoli di animali appartenenti a diverse famiglie come Felidae, Canidae, Rodentia ecc. Il chemicalswhich vengono utilizzati per la sterilizzazione sono, cloruro di calcio, formalina, gluconato di zinco + arginina, soluzione salina ipertonica, permanganato di potassio, chlorhexidinegluconate + cetrimide, glicerolo, etanolo, fluoruro di sodio, mentre cloruro di sodio concentrato è stato utilizzato da. La somministrazione di questi agenti chimici nell’epididimo, nei testicoli e nel dotto di deferenza ha portato all’azoospermia perpetua, alla riduzione della produzione di testosterone e all’alterazione della struttura fisica dei testicoli. Causa anche una riduzione della produzione di androgeni e migliora i disturbi androgeno-dipendenti come la malattia prostatica, la malattia gonadica e il problema comportamentale (montaggio, aggressività, marcatura dell’urina). L’iniezione di queste sostanze chimiche sterilizzanti nell’epididimo, nei testicoli o nel dotto deferente induce la sterilità danneggiando il trasporto delle cellule spermatiche e producendo occlusioni fibrose che causano azoospermia. L’iniezione intratesticolare porta alla necrosi testicolare e diminuisce la spermatogenesi così come la riduzione della concentrazione sierica di testosterone. Pertanto, l’approccio chimico della castrazione è considerato un’alternativa adeguata al metodo chirurgico. È meno dispendioso in termini di tempo e richiede anche meno personale tecnico. Inoltre, è conveniente per la pratica e nessuna cura extra post-operatoria è richiesta. La soluzione salina ipertonica (HSS) non è stata ancora valutata per la castrazione chimica nei gatti maschi. Pertanto, lo studio attuale è stato pianificato con l’obiettivo di valutare e confrontare l’efficacia della soluzione salina ipertonica (HSS) con il cloruro di calcio come agente chemioterilizzante nei gatti maschi.
Materiali e metodi
Animali sperimentali e protocollo di trattamento
Gli animali sperimentali (n=20 tom) sono stati equamente e casualmente assegnati a quattro gruppi contenenti cinque animali in ciascuno. I tomsof gruppo A e B sono stati iniettati un singolo, bilaterale, intra-testicularinjection di soluzione salina ipertonica rispettivamente al concentrationof 20% e 30%. Cloruro di calcio è stato somministrato in testicoli ofanimals del gruppo C. Mentre, nel gruppo D, intra-testicular injectionof sterilizzato soluzione salina normale è stato dato, e questo gruppo wasconsidered come un gruppo di controllo. La quantità di soluzioni di test somministrate era in base alla larghezza dei testicoli in ogni animale.
Iniezione intratesticolare
Prima dell’iniezione, lo scroto è stato rasato e pulito con una soluzione antisettica di povidone-iodio. L’iniezione intratesticolare è stata fatta con un ago sterile da 21 gauge. Ago è stato inserito dall’aspetto caudoventrale del testicolo circa 1 cm dalla coda theepididymal e diretto verso l’aspetto dorso-cranial di quel testicolo in modo che quando l’ago viene ritirato dalla fine prossimale todistal, la soluzione è stata uniformemente somministrata in tutto il percorso. La tabella 1 fornisce una stima della quantità di soluzione da iniettare rispetto al peso dei testicoli
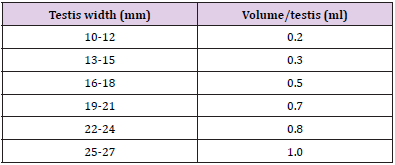
Tabella 1: Volume della soluzione da iniettare in ogni testicolo in base alla larghezza testicolare.
Criteri di valutazione
Valutazione clinica: Le alterazioni dello scroto (per esempio dolore, gonfiore, dermatite) sono state annotate una volta al giorno per 3 giorni e poi una volta alla settimana fino al completamento dell’esperimento. Calibri di Vernier sono stati utilizzati per misurare la larghezza dei testicoli post iniezione con thesame intervallo di tempo come descritto sopra.
Serum Testosterone Analisi della concentrazione: Il sangue è stato ottenuto in Gel vaccutainers dalla vena cefalica ed è stato centrifugato @2000 rpm per 15 minuti per separare il siero. Serumwas conservato a -20 ° C fino al completamento del experiment.Competitive ELISA è stato fatto utilizzando commercialmente disponibile Accu-Bind ® ELISA Microwells Testosterone Kit.
Esame istologico: Dopo la rimozione dei testicoli, i campioni sono stati lavati con soluzione fisiologica normale e fissati in soluzione di Bouin in contenitori di plastica da 50 ml per ogni testicolo destro e sinistro, separatamente. Il trattamento convenzionale del tessuto dei campioni è stato fatto. Le sezioni di tessuto con spessore 5μm sono state tagliate con l’aiuto del microtomo rotante e montate in seguito su vetrini di vetro. I vetrini sono stati poi colorati con la macchia di ematossilina ed eosina e le sue caratteristiche istologiche sono state confrontate con l’aiuto del software ImageJ®.
Analisi statistica
I dati così generati sono stati analizzati da Generalized LinearModel Complete randomized design (fattore CRD-2) e la differenza nei mezzi è stata confrontata con Least Significance Difference (LSD) al livello di significatività del 5%.
Risultati
Larghezza testicolare
Per quanto riguarda la larghezza testicolare è stata osservata una differenza statisticamente non significativa (p>0.05) in tutti i gruppi all’inizio del periodo dello studio. Somministrazione di farmaci di prova ha portato in significativo (p0.05) tra l’altro. Alla prima settimana dopo l’iniezione, una statisticamente non significativa (p>0.05) diminuzione della larghezza testicolare è stata osservata in tutti i gruppi rispetto al punto temporale di campionamento precedente. Un’ulteriore diminuzione della larghezza testicolare wasobserved nei gruppi A, B e C a 2 ° settimana post iniezione dove groupC era statisticamente significativo (p0.05) larghezza testicolare degli animali del gruppo D, mentre c’era asignificativo (p
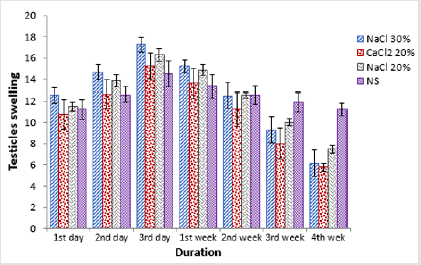
Figura 1:Confronto della larghezza testicolo di quattro gruppi a diversi intervalli di tempo.
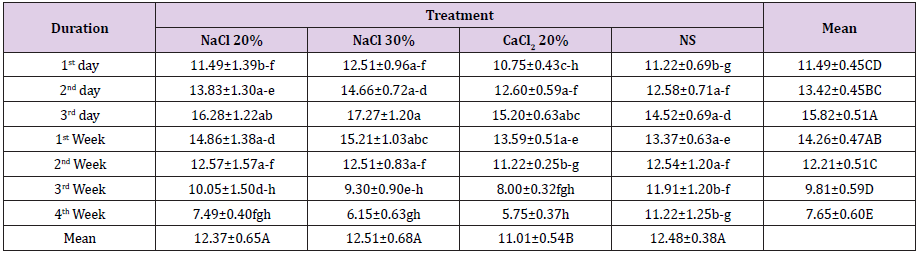
Tabella 2: Larghezza del testicolo (mm; Mezzi ± SE) a diversi intervalli di tempo di quattro gruppi: iniezione bilaterale intra testicolare di HSS 20% (Gruppo A), HSS 30% (Gruppo B), CaCl2 20% (Gruppo C) e soluzione salina normale (Gruppo D).
Esame istopatologico
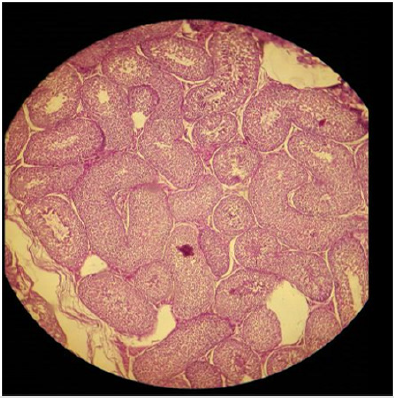
Plate 1: Effetto della soluzione salina normale (NSS) su (a) parenchima testicolare e (b) tubuli seminiferi in malati sessualmente adulti; si possono notare tubuli seminiferi intatti e paranchima testicolare normale. H&E; 400 X.
I risultati isto-patologici esposti che HSS efficacemente compromesso parenchima testicolare e portare a cambiamenti necrotici nel tessuto testicolare in commensura con cloruro di calcio. L’aumento della concentrazione di HSS ha prodotto cambiamenti necrotici inalterabili. Bilaterale intratesticularadministration di concentrazione del 20% di HSS producedpartially ai cambiamenti necrotici completi nei tessuti di testicles.Epithelium dei tubuli seminiferi era moderatamente destroyedtogether con alterazione in ordine di cellule del parenchima. Moderatecoagulated necrosi e vacuolizzazione di Interstitial e Sertolicells è stato notato tra cui pyknosis di nuclei (piastre 1 & 2).30% concentrazione di HSS prodotto necrosi acuta in tessuti oftesticles. Necrosi acuta e degenerazione dei tubuli seminiferi è stato notato. Le cellule interstiziali e le cellule di Sertoli erano anche gravemente degenerate insieme alla distruzione delle cellule del parenchima. Le cellule germinali erano diminuite dai tubuli seminiferi. Lumenwas vuoto notato in tubuli seminiferi (piastra 3). Bilaterale intratesticularadministration di concentrazione 20% di cloruro di calcioprodotto grave necrosi nei tessuti dei testicoli. È stata notata una necrosi acuta e la degenerazione dei tubuli seminiferi. Le cellule di Sertoli e le cellule interstiziali erano anche gravemente degenerate con la distruzione delle cellule del parenchima. Le cellule germinali erano diminuite dai tubuli seminiferi. Il lume vuoto è stato notato nei tubuli seminiferi (piastra 4). Intra-testicolare iniezione di 20% e 30% soluzione salina ipertonica indotta distruzione delle cellule interstiziali e tubuli seminiferi che porta ad atrofia dei testicoli. La concentrazione del 30% di soluzione salina ipertonica ha indotto la necrosi rispetto al 20% di cloruro di calcio.
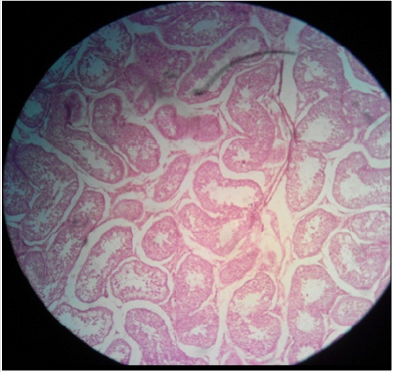
Plate 2: Effetto del 20% di HSS sull’epitelio tubolare seminifero del testicolo in gatti maschi sessualmente adulti; (a) disintegrazione dell’epitelio seminifero e delle associazioni di cellule germinali insieme a (b) diminuzione delle cellule germinali dai tubuli seminiferi può essere ben evidenziato. H&E; X400.
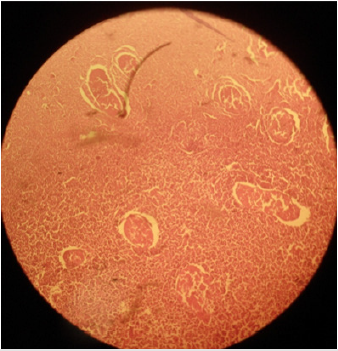
Plate 3: Effetto della soluzione salina ipertonica al 30% (HSS) sul parenchima testicolare e sui tubuli seminiferi in gatti sessualmente adulti; (a) necrosi coagulativa dei tubuli seminiferi e delle cellule di Leydig e (b) grave disorganizzazione delle cellule del parenchima con (c) diminuzione delle cellule germinali dei tubuli seminiferi. H&E; 400 X.
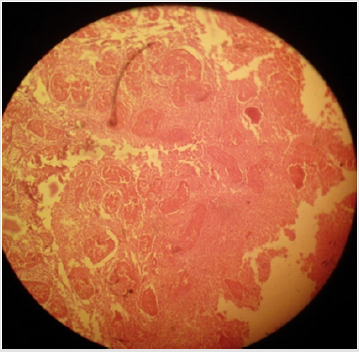
Plate 4: Effetto del cloruro di calcio al 20% (CaCl2) sul parenchima testicolare e sui tubuli seminiferi in gatti maschi sessualmente adulti; (a) necrosi coagulativa dei tubuli seminiferi e delle cellule di Leydig e (b) grave disorganizzazione delle cellule del parenchima insieme a (c) diminuzione delle cellule germinali dei tubuli seminiferi può essere notato. H&E; 400 X.
Concentrazione di testosterone nel siero
Al basale gli animali dei gruppi, A e D avevano una differenza statisticamente significativa (p0.05) in termini di livello di testosterone nel siero è stato osservato tra tutti i gruppi. A 3 ° settimana post trattamento statisticamente significativo (p0.05) cambiamento nel livello di testosterone nel siero di animali del gruppo B e D (Tabella 3). Una tendenza simile è stata osservata nel livello di testosterone nel siero di tutti i gruppi alla 4a settimana dopo il trattamento, dove il gruppo B era più basso e il gruppo D era più alto (Figura 2).
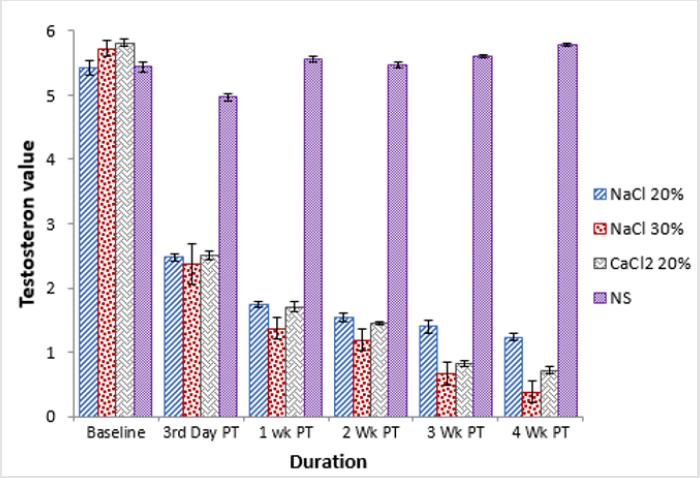
Figura 2:Confronto della concentrazione di testosterone di quattro gruppi a diversi intervalli di tempo.
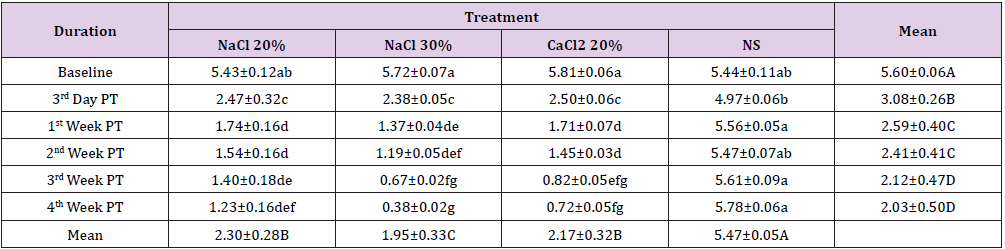
Tabella 3: Concentrazione di testosterone nel siero (ng/ml; Mezzi ± SE) a diversi intervalli di tempo di quattro gruppi: iniezione intratesticolare bilaterale di 20 HSS (Gruppo A), 30% HSS (Gruppo B) CaCl2 (Gruppo C) e soluzione salina normale (Gruppo D).
Discussione
La sterilizzazione chimica è una tecnica incruenta e non chirurgica per la sterilizzazione maschile. La tecnica chimica di sterilizzazione è molto più economica, meno impegnativa ed è fattibile per programmi colossali di controllo della popolazione sia nei gatti che nei cani. La somministrazione intra-testicolare di sterilizzante induce il deterioramento e la necrosi delle cellule del parenchima dei testicoli. Mentre intra-epidymaladministrations causare occlusione fibrosa e causare la distruzione oftransportation di cellule spermatiche e induce azoospermia. Vari agenti sterilizzanti come la formalina, acetato di zinco + arginina, gluconato di clorexidina + cetrimide, glicerolo, etanolo, fluoruro di sodio, permanganato di potassio e cloruro di calcio è stato utilizzato per questo obiettivo. Nel presente studio è stata valutata l’efficacia della somministrazione bilaterale intra-testicolare di una soluzione di soluzione salina ipertonica in diverse concentrazioni come agente chemioterilizzante e confrontata con il cloruro di calcio nei gatti maschi. È stato ottenuto eseguendo la stima clinica (dimensioni del testicolo), la concentrazione di testosterone nel siero e l’indagine istopatologica. L’orchiectomia è stata eseguita alla fine dello studio per l’esame istopatologico. I risultati ofpresent esperimento ha rivelato che intra-testicular iniezione di soluzione salinahypertonic e cloruro di calcio indotto testiculardeterioration e necrosi insieme alla riduzione della concentrazione di testosterone ofserum. Questi risultati concordano con l’esperimento di Emiret al., 2008 che ha registrato risultati analoghi nei ratti iniettando il 20% di HSS. A causa della necrosi e della degenerazione delle cellule testicolari, la spermatogenesi viene interrotta, e la distruzione delle cellule interstiziali è la probabile causa della riduzione della produzione di testosterone.
Risultati simili sono stati descritti da Jana e Samanta. La concentrazione plasmatica del testosterone è diminuita a causa delle proprietà necrotiche del cloruro di calcio iniettato per via intra-testicolare nei gatti; inoltre, la necrosi delle cellule interstiziali che secernono testosterone ha anche partecipato alla riduzione della concentrazione di testosterone nel sangue. Abshenas ha riferito che la concentrazione di testosterone sierico è stato ridotto notevolmente con la somministrazione di olio essenziale di Eugenia caryophyllata quando è stato iniettato intratesticular.Considerando la dimensione dei testicoli, il nostro studio ha mostrato una notevole riduzione della larghezza testicolare in confronto al gruppo di controllo al completamento della durata sperimentale dopo un rapido aumento delle dimensioni in 24-48 ore con un decreaseafter graduale somministrazione chimica. Questi risultati sono molto simili a Leociwho descritto che la somministrazione bilaterale intra-testicolare di cloruro di calcio soluzione sterilizzante prodotto un considerabileabledecrease in larghezza testicolare dopo un breve periodo di lieve gonfiore. deterioramento testicolare e distruzione di conseguenza portare toatrophy dopo una certa durata di tempo. Risultati simili sono stati riportati anche da Oliveria che ha riportato risultati simili con la somministrazione bilateraleintra-testicolare di soluzione di gluconato di zinco sterilizzato.è stata notata una solida correlazione tra la concentrazione ormonale di testosterone e l’età. Essi hanno concluso che la concentrazione di ormone testosterone non dipende dalle dimensioni del testicolo. I nostri risultati hanno dimostrato che sia le dimensioni del testicolo che la concentrazione di testosterone sono state ridotte con l’estensione del tempo.
Per quanto riguarda gli esami isto-patologici il currentexperiment ha rivelato che i testicoli iniettati con ipertonicsalina e cloruro di calcio hanno mostrato alterazioni distruttive nelle cellule del parenchima dei testicoli. Nei tubuli seminiferi, la fibrosi è stata indotta accompagnando le alterazioni distruttive nelpitelio germinale e la necrosi coagulativa delle cellule del Sertoli e delle cellule interstiziali. Questi risultati concordano con Neto che ha descritto che la somministrazione intratesticolare di cloruro di sodio concentrato induce alterazioni distruttive nei testicoli che hanno portato a fibrosi e necrosi. L’alta concentrazione di HSS e CaCl2 causano atrofia e formazione di tessuto cicatriziale nei tubuli seminiferi. Livello di degenerazione di spermatidi, spermatociti e aumenta rapidamente con l’aumento della concentrazione dello sterile. Un esperimento analogo è stato condotto da Oliveria che ha concluso che la somministrazione intratesticolare di una soluzione di base di zinco nei gatti maschi ha indotto la proliferazione di leucociti polimorfonucleati e altre cellule del sangue nei tubuli seminiferi. I nostri risultati sono anche supportati dai risultati di Cavalieri che ha rivelato che la soluzione di zinco acetato ha prodotto evidenti alterazioni distruttive nei tessuti dei testicoli nei vitelli toro. Queste alterazioni portano all’atrofia testicolare e infine all’infertilità.
Conclusione
I risultati dello studio portano alla conclusione che l’HSS ha il potenziale per sostituire altri metodi (fisici o chirurgici) nella pratica per neutralizzare i gatti maschi. Si è dimostrato essere meno lungo, meno doloroso ma ugualmente efficace.
- Abshenas J, MM Molaei, A Derakhshnfar, N Ghalekhani (2013) Sterilizzazione chimica mediante iniezione intratesticolare di olio essenziale di Eugenia caryophyllata nel cane: uno studio istopatologico. Ir J Vet Surg 8(19): 9-16.
- Benjamin MM (1978) Outline of Veterinary Clinical Pathology. In Benjamin MM (Eds.), (2nd Ed.) Thelowa State University Press, Ames, Iowa, USA.
- Bloomberg MS (1996) Neutering chirurgico e alternative non chirurgiche. J Am Vet Med. Assoc 208: 517-519.
- Cavalieri J, M Wang, L Johnson (2015) Sterilizzazione chimica di vitelli Bos indicus dopo iniezione intratesticolare di acetato di zinco: Effetti sulla qualità dello sperma e sui cambiamenti testicolari. Anim Reprod Sci 156: 23-33.
- Currah JM, SH Hendrick, JM Stooley (2009) La valutazione comportamentale e l’attenuazione del dolore associato alla castrazione in vitelli da carne trattati con fluxin meglumine e lidocaina caudale anestesia epidurale con epinefrina. Can Vet J 50(4): 375-382.
- Emir L, M Dadalı, M Sunay, D Erol, M Çaydere, et al. (2008) Castrazione chimica con iniezione intratesticolare di soluzione salina ipertonica al 20%: Un metodo minimamente invasivo. Urol Oncol Seminars and Original Investigations 26(4): 392-396.
- Fagundes AKF, ECS Oliveira, BM Tenorio, CCS Melo, LTB Nery, et al. (2014) L’iniezione di un agente di castrazione chimica, gluconato di zinco, nei testicoli del gatto risulta nella compromissione della spermatogenesi: Un approccio potenzialmente contraccettivo per questa specie. Theriogenology 81(2): 230-236.
- Hansen BD (2003) Valutazione del dolore nei cani: Studi clinici veterinari. Inst. Lab. Anim. Res J 44(3): 197-205.
- Jana K, D Ghosh, PK Samanta (2005) Valutazione della singola iniezione intratesticolare di cloruro di calcio per la sterilizzazione non chirurgica dei maschi di capra (Capra hircus): uno studio dose dipendente. Anim Reprod Sci 86(1-2): 89-108.
- Jana K, PK Samanta (2011) Valutazione clinica della sterilizzazione non chirurgica dei gatti maschi con singola iniezione intra-testicolare di cloruro di calcio. BMC Veterinary Research 7: 39.
- Kutzler M, Wood A (2006) Metodi non chirurgici di contraccezione e sterilizzazione. Theriogenoly 66(3): 524-525.
- Kwak BK, S Lee (2013) Iniezione intratesticolare di soluzione salina ipertonica: metodo alternativo non invasivo per il modello di castrazione animale. Dev Repord 17(4): 435-440
- Lecoi R, G Aiudi, F Silvestre, E Lissner, G Lacalandra (2014) Uno studio dose-finding, a lungo termine sull’uso del cloruro di calcio in soluzione salina come metodo di sterilizzazione non chirurgica nei cani: Valutazione della concentrazione più efficace con il rischio più basso. Acta Vet Scand 56: 62-68.
- Neto OA, BG Gasperin, MT Rovani, GF llha, JE Nobrega, et al. (2014) Intratesticular hypertonic sodium chloride solution treatment as a method of chemical castration in cattle. Theriogenology 82(7): 1007-1011.
- Oliveira ECS, MRP Moura, MJC Desa, VA Silva, JP Kastelic (2012) Contraccezione permanente dei cani indotta con iniezione intratesticolare di una soluzione a base di Zinco Gluconato. Theriogenology 77(6): 1056-1063.
- Rajkumar D (2013) Minimizzazione del dolore nella castrazione del bestiame in relazione al metodo, all’età e al sollievo dal dolore. Aust Vet J 55(6): 263-264.
- Soto FRM, WG Viana, AJ Sousa, SR Pinheiro, GB Mucciolo (2007) Valutazione del gluconato di zinco, associato o meno al dimetilsulfossido, come metodo contraccettivo per i cani maschi. J Anim Repord 4: 119-124.
- Steel RGD, JH Torrie (2004) Principi e procedure di statistica. McGraw Hill Book Co. Inc. New York, USA.
- Vanderstichel R, MJ Forzán, GE Pérez, JA Serpell, E Garde (2015) Changes in blood testosterone concentrations after surgical and chemical sterilization of male free-roaming dogs in southern Chile. Theriogenology 83(6): 1021-1027.
- Wang M (2004) Neutersol iniezione intratesticolare induce sterilità nei cani e nei gatti. Nel secondo simposio internazionale dell’ACC&D sul controllo contraccettivo non chirurgico in cani e gatti 165-169.
0 commenti