le fonti più comuni del nucleofilo idruro sono l’idruro di litio alluminio (LiAlH4) e la boroidruro di sodio (NaBH4). Nota! L’anione idruro non è presente durante questa reazione; piuttosto, questi reagenti servono come fonte di idruro a causa della presenza di un legame polare metallo-idrogeno. Poiché l’alluminio è meno elettronegativo del boro, il legame Al-H in LiAlH4 è più polare, rendendo così LiAlH4 un agente riducente più forte.
L’aggiunta di un anione idruro (H:-) a un’aldeide o a un chetone dà un anione alcossido, che per protonazione produce l’alcol corrispondente. Le aldeidi producono 1º-alcoli e i chetoni producono 2º-alcoli.
Nelle riduzioni degli idruri metallici i sali di alcossi risultanti sono insolubili e devono essere idrolizzati (con cura) prima che il prodotto alcolico possa essere isolato. Nella riduzione del boroidruro di sodio, il sistema solvente metanolo realizza automaticamente questa idrolisi. Nella riduzione dell’idruro di alluminio e litio, l’acqua viene solitamente aggiunta in una seconda fase. Il litio, il sodio, il boro e l’alluminio finiscono come sali inorganici solubili alla fine di entrambe le reazioni. Nota! LiAlH4 e NaBH4 sono entrambi capaci di ridurre aldeidi e chetoni all’alcool corrispondente.
Meccanismo
Questo meccanismo è per una riduzione LiAlH4. Il meccanismo per una riduzione di NaBH4 è lo stesso, tranne che il metanolo è la fonte di protoni usata nel secondo passo.
1) Attacco nucleopilico da parte dell’anione idruro
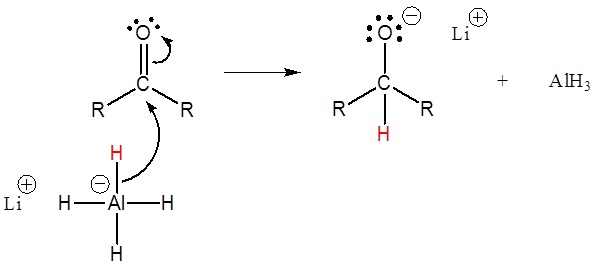
2) L’alcossido è protonato
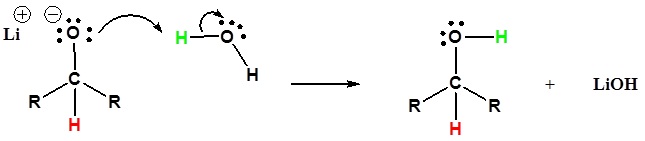
Andare dai reagenti ai prodotti semplificati
Proprietà delle fonti di idruro
Due fonti pratiche di reattività simile agli idruricome la reattività sono gli idruri metallici complessi idruro di alluminio litio (LiAlH4) e boroidruro di sodio (NaBH4). Sono entrambi solidi bianchi (o quasi bianchi), che si preparano dagli idruri di litio o di sodio per reazione con alogenuri ed esteri di alluminio o boro. L’idruro di litio e alluminio è di gran lunga il più reattivo dei due composti, reagendo violentemente con acqua, alcoli e altri gruppi acidi con l’evoluzione di gas idrogeno. La seguente tabella riassume alcune importanti caratteristiche di questi utili reagenti.
Sarebbe bello convertire questa tabella in testo.
Problemi
1) Disegna i prodotti delle seguenti reazioni:
2) Disegna la struttura della molecola che deve reagire per produrre il prodotto.
3) L’ossido di deuterio (D2O) è una forma di acqua dove gli idrogeni sono stati sostituiti da deuterio. Per la seguente riduzione LiAlH4 l’acqua tipicamente usata è stata sostituita da ossido di deuterio. Disegna il prodotto della reazione e metti il deuterio nella posizione corretta. Suggerimento! Guarda il meccanismo della reazione.
Risposte
1)
2)
3)
Contributors
- Prof. Steven Farmer (Sonoma State University)
- William Reusch, professore emerito (Michigan State U.), Virtual Textbook of Organic Chemistry
0 commenti