Una tipica cella elettrolitica può essere realizzata come mostrato nella figura \PageIndex{1}. Due conduttori elettrici (elettrodi) sono immersi nel liquido da elettrolizzare. Questi elettrodi sono spesso fatti di un materiale inerte come acciaio inossidabile, platino o grafite. Il liquido da elettrolizzare deve essere in grado di condurre l’elettricità, e quindi di solito è una soluzione acquosa di un elettrolita o un composto ionico fuso. Gli elettrodi sono collegati tramite fili a una batteria o altra fonte di corrente continua. Questa fonte di corrente può essere pensata come una “pompa di elettroni” che prende gli elettroni da un elettrodo e li spinge fuori nell’altro elettrodo. L’elettrodo da cui vengono rimossi gli elettroni diventa carico positivamente, mentre l’elettrodo a cui vengono forniti ha un eccesso di elettroni e una carica negativa.
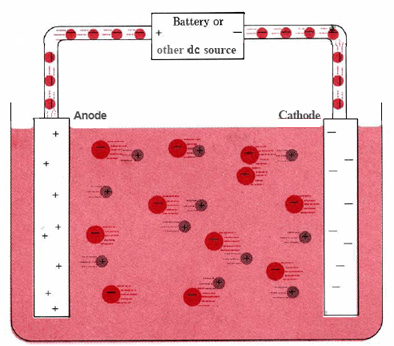
L’elettrodo carico negativamente attirerà verso di sé ioni positivi (cationi) dalla soluzione. Può donare alcuni dei suoi elettroni in eccesso a tali cationi o ad altre specie nel liquido da elettrolizzare. Quindi questo elettrodo è in effetti un agente riducente. In qualsiasi cella elettrochimica (elettrolitica o galvanica) l’elettrodo in cui avviene la riduzione è chiamato catodo.
L’elettrodo positivo, d’altra parte, attirerà ioni negativi (anioni) verso di sé. Questo elettrodo può accettare elettroni da quegli ioni negativi o da altre specie nella soluzione e quindi si comporta come un agente ossidante. In qualsiasi cella elettrochimica l’anodo è l’elettrodo in cui avviene l’ossidazione. Un modo semplice per ricordare qual è l’elettrodo è che l’anodo e l’ossidazione iniziano con le vocali mentre il catodo e la riduzione iniziano con le consonanti.
Il seguente video mostra questo processo che avviene in una soluzione neutra di acqua con alcuni elettroliti presenti.
Come esempio di come l’elettrolisi può causare una reazione chimica, supponiamo di passare una corrente elettrica diretta attraverso 1 M HCl. Gli ioni H3O+ in questa soluzione saranno attratti verso il catodo, e gli ioni Cl- migreranno verso l’anodo. Al catodo, H3O+ si ridurrà al gas H2 secondo la mezza equazione
\
(Come visto in altre sezioni, scriveremo H+ invece di H3O+ nelle mezze equazioni per risparmiare tempo). All’anodo, gli elettroni saranno accettati dagli ioni Cl-, ossidandoli a Cl2:
Durante l’elettrolisi H2(g) e Cl2(g) bolle dal catodo e dall’anodo, rispettivamente. L’equazione complessiva per l’elettrolisi è la somma delle Eq. \(\ref{1}\ e \(\ref{2}\) :
\
o
\
La reazione netta è l’inverso della combinazione spontanea di H2(g) con Cl2(g) per formare HCl(aq). Un tale risultato è vero per l’elettrolisi in generale: la corrente elettrica fornita dall’esterno del sistema causa una reazione chimica non spontanea.
Anche se l’elettrolisi inverte sempre una reazione redox spontanea, il risultato di una data elettrolisi può non essere sempre la reazione che vogliamo. In una soluzione acquosa, per esempio, ci sono sempre molte molecole d’acqua nelle vicinanze dell’anodo e del catodo. Queste molecole d’acqua possono donare elettroni all’anodo o accettare elettroni dal catodo proprio come gli anioni o i cationi. Di conseguenza l’elettrolisi può ossidare e/o ridurre l’acqua invece di far reagire l’elettrolita dissolto. Un esempio di questo problema è l’elettrolisi del fluoruro di litio, LiF. Potremmo aspettarci la riduzione di Li+ al catodo e l’ossidazione di F- all’anodo, secondo le mezze equazioni
\
\
Tuttavia, Li+ è un accettore di elettroni molto povero, e quindi è molto difficile forzare l’equazione \(\ref{5}\) a verificarsi. Di conseguenza, gli elettroni in eccesso dal catodo sono invece accettati dalle molecole di acqua:
Una situazione simile si verifica all’anodo. Gli ioni F- sono agenti riducenti estremamente deboli – molto più deboli delle molecole di H2O – quindi la mezza equazione è
L’equazione complessiva può essere ottenuta moltiplicando l’equazione \ref{7}} per 2, aggiungendola all’equazione \ref{8} e combinando H+ con OH- per formare H2O:
Il seguente video mostra l’elettrolisi dell’acqua che avviene, usando l’acido solforico come ponte per permettere il trasferimento della carica. Dopo che l’elettrolisi è stata completata, l’identità dei gas formati viene verificata con test di combustione.
Quindi questa elettrolisi inverte la combinazione spontanea di H2 e O2 per formare H2O. Nel discutere le reazioni redox menzioniamo diversi agenti ossidanti, come quelli che sono abbastanza forti da ossidare H2O. Allo stesso tempo descriviamo agenti riducenti che sono abbastanza forti da ridurre H2O, come i metalli alcalini e le terre alcaline più pesanti. Come regola generale, tali sostanze non possono essere prodotte dall’elettrolisi di soluzioni acquose perché H2O viene invece ossidata o ridotta. Le sostanze che subiscono una reazione redox spontanea con H2O sono solitamente prodotte per elettrolisi di sali fusi o in qualche altro solvente. Ci sono alcune eccezioni a questa regola, tuttavia, perché alcune reazioni elettrodiche sono più lente di altre. Usando la Tabella 11.5, per esempio, dovremmo prevedere che H2O è un agente riducente migliore di Cl-.
Da qui ci aspetteremmo che O2, non Cl2, sia prodotto dall’elettrolisi di 1 M HCl, in contraddizione con l’equazione \(\ref{1}). Si scopre che l’O2 è prodotto più lentamente del Cl2, e quest’ultimo bolle fuori dalla soluzione prima che l’H2O possa essere ossidato. Per questo motivo la tabella 1 che si trova nella sezione Coppie Redox non può essere sempre usata per prevedere cosa succederà in un’elettrolisi.
Contribuenti
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff e Adam Hahn.
0 commenti