COVID-19, déclenché par le bêtacoronavirus SARS-CoV-2, est devenu l’une des pandémies les plus graves de notre époque, provoquant une incidence élevée de pneumonie, de syndrome de détresse respiratoire aiguë (SDRA) et de décès3,4. L’une des caractéristiques les plus notables de l’infection par le SRAS-CoV-2 est qu’elle passe inaperçue pendant une période remarquablement longue, se manifestant par une maladie bénigne ou sans complication pendant des semaines jusqu’à ce que des symptômes soudains et graves apparaissent dans un sous-groupe de patients, nécessitant une hospitalisation, une assistance en oxygène et/ou l’admission dans une unité de soins intensifs (USI)3,4. Ce scénario est cohérent avec une période d’incubation exceptionnellement longue du virus, allant de 2 à 14 jours, et une présence exceptionnellement longue du virus dans les voies respiratoires, souvent détectable pendant plus d’un mois après l’infection initiale par les tests de diagnostic moléculaire classiques5,6. En comparaison, l’infection par le virus de la grippe, le principal virus respiratoire à l’origine des hospitalisations pour pneumonie jusqu’à présent, a une durée d’incubation de 1 à 4 jours, une courte fenêtre de positivité du virus de quelques jours et une apparition brutale des symptômes provoquant une pneumonie dans les 1 à 3 jours7,8. D’autres virus respiratoires fréquents, tels que les virus respiratoires syncytiaux, les rhinovirus, les virus de la parainfluenza, les métapneumonovirus et les coronavirus du rhume, ont également un temps d’incubation plus court (allant de 1 à 5 jours) et une manifestation plus rapide et plus aiguë des symptômes9, ce qui rend le SRAS-CoV-2 tout à fait unique à cet égard. La base de cette différence est inconnue, mais il est probable qu’elle soit un moteur clé de la physiopathologie du COVID-19 qui sous-tend son évolution distincte et ses manifestations cliniques.
La caractéristique du COVID-19 est le développement d’une réponse hyperinflammatoire, également connue sous le nom de » tempête de cytokines « , altérant la fonction d’échange gazeux et entraînant un SDRA, une défaillance multi-organique et la mort10,11,12. Nous avons déjà montré, avec d’autres, qu’une réponse antivirale finement ajustée, orchestrée par l’IFN-λ (IFN de type III) et l’IFN de type I, est essentielle pour équilibrer l’immunité en vue d’une protection optimale et de dommages minimaux13,14,15. Une rupture de cet équilibre peut déclencher une « tempête de cytokines » aux conséquences dévastatrices pour la santé humaine. Une étude récente a suggéré que chez les patients atteints de COVID-19, l’IFN de type I et l’IFN-λ ne sont pas produits car ils n’ont pas pu être détectés dans les sérums d’une petite cohorte de COVID-19 aux caractéristiques cliniques par ailleurs non spécifiées16. En revanche, une autre étude a rapporté que l’IFN de type I est induit chez les patients atteints de COVID-19 et a indiqué que sa concentration pourrait être réduite chez ceux qui sont gravement malades17. Ces divergences pourraient être dues au fait que chacune de ces études se concentre sur un instantané unique et probablement distinct d’un processus pathologique apparemment hétérogène. Par conséquent, la poursuite des analyses cinétiques est pertinente pour délimiter l’évolution de la réponse immunitaire, d’autant plus que les cytokines sont produites de manière transitoire. Ce critère est particulièrement vrai pour les IFN, qui sont exprimés au début de l’infection et sont rapidement régulés à la baisse par la suite.
Nous avons réalisé ici une analyse temporelle complète des IFN de type I et de type III et des principaux profils de cytokines inflammatoires chez 32 patients atteints de COVID-19 et 16 patients atteints de grippe hospitalisés pour une pneumonie communautaire et suivis longitudinalement selon les directives actuelles de l’Organisation mondiale de la santé18. Les deux groupes de patients présentaient des caractéristiques clinicopathologiques similaires et une gravité de la maladie comparable à l’admission (tableau supplémentaire 1). Nous avons également analysé 24 patients présentant des cas de grippe plus bénins, sans constatation radiologique de pneumonie et sans nécessité d’hospitalisation (appelés grippe bénigne ; tableau supplémentaire 1), ainsi que 10 personnes en bonne santé. En utilisant des tests Luminex et ELISA de haute sensibilité, nous avons quantifié 18 cytokines et chimiokines pertinentes pour l’immunité antivirale et l’hyperinflammation dans le sérum des patients collecté à des intervalles de temps définis après l’admission à l’hôpital (Fig. 1a et Données étendues Fig. 1a). Cette analyse permet d’aligner les patients sur la base des mêmes critères cliniques de symptômes et de gravité de la maladie, principalement la présence d’une pneumonie et le besoin d’une assistance en oxygène.

a, Schéma montrant le plan expérimental avec échantillonnage à des intervalles de temps spécifiques après l’admission à l’hôpital de 32 patients atteints de COVID-19 et de 16 patients atteints de grippe avec pneumonie suivis longitudinalement. Les lignes pointillées indiquent le moment de la première et de la dernière apparition de la maladie grave, respectivement. b, Taux sériques d’IFN-λ1, IFN-α, IFN-γ, TNF, IL-6, IL-7, IL-8, IL-10 et CCL3 à différents intervalles de temps après l’admission à l’hôpital. Les données sont présentées sous forme de diagrammes de dispersion, les points indiquant les mesures individuelles des patients, les colonnes les valeurs médianes et les barres d’erreur l’étendue. Pour COVID-19, n = 16, 17, 21, 15, 11 et 8 pour chacun des six intervalles de temps consécutifs. Pour la grippe, n = 16, 14 et 11, respectivement. Pour le virus sain, n = 10. L’ombrage gris marque la limite de quantification de l’essai. Les valeurs P ont été déterminées par un test U bilatéral de Mann-Whitney pour les comparaisons non paramétriques. *P < 0,05, **P < 0,01 et ***P < 0,001 montrent la signification par rapport aux contrôles sains. #P < 0,05, ##P < 0,01 et ###P < 0,001 montrent la signification entre les groupes COVID-19 et grippe.
Nous avons constaté que les patients atteints de COVID-19 présentaient une induction profondément altérée à la fois de l’IFN-λ et des IFN de type I. L’IFN-λ et les IFN de type I n’étaient pas détectables chez la plupart des patients atteints de COVID-19 (avec des niveaux médians à la limite de quantification du test), bien que certains patients aient fabriqué de l’IFN-λ et que moins d’entre eux aient également fabriqué de l’IFN-α (Fig. 1b). Cette observation contraste avec les patients atteints de grippe qui ont exprimé presque uniformément les deux types d’IFN, dans le premier intervalle de temps (jour 1-3) de l’admission et à des concentrations significativement plus élevées. Dans tous les cas, l’expression des IFN était transitoire, les niveaux d’IFN de type I diminuant rapidement après les 3 premiers jours d’hospitalisation, tandis que l’IFN-λ persistait plus longtemps. Notamment, malgré leur capacité limitée à fabriquer des IFN, les patients atteints de COVID-19 ont exprimé de manière robuste des cytokines pro-inflammatoires telles que le TNF, l’IL-6, l’IL-7, l’IL-8, l’IL-10, l’IFN-γ et le CCL3 qui ont été maintenues à des concentrations élevées pendant une période prolongée (Fig. 1b). D’autres cytokines telles que l’IL-1β, l’IL-12, l’IL-23 et le CCL4 étaient également significativement régulées à la hausse à des intervalles de temps spécifiques par rapport aux individus sains, reflétant l’hétérogénéité de l’évolution de la maladie (données étendues Fig. 2).
Un schéma similaire est apparu lorsque les comparaisons ont été effectuées en fonction de l’apparition des symptômes de la maladie (données étendues Fig. 1b). Les patients atteints de COVID-19 présentaient des niveaux d’IFN-λ et d’IFN de type I nettement retardés et réduits, qui n’étaient détectables que chez une fraction des patients et à partir des jours 7-10 de l’apparition des symptômes (Données étendues Fig. 3a,b). Par comparaison, tous les patients atteints de la grippe présentaient des niveaux élevés de ces cytokines au cours des 6 premiers jours (Données étendues Fig. 3a,b). Bien que les patients atteints de COVID-19 aient produit peu d’IFN au cours des 6 premiers jours de l’apparition des symptômes, ils ont produit des cytokines et des chimiokines pro-inflammatoires telles que le TNF, l’IL-6, l’IL-8, l’IL-10 et le CCL3 à des concentrations similaires à celles de la grippe (Données détaillées Fig. 3b,c). De plus, ils ont présenté une expression prolongée des médiateurs pro-inflammatoires, avec des concentrations élevées de TNF, IL-6, IL-7, IL-8, IL-10 et CCL4 restant détectables pendant plus de 3 semaines après l’apparition de la maladie, alors que chez les patients atteints de grippe, un certain nombre d’entre eux étaient à ce moment-là dérégulés.
Notamment, les patients atteints de COVID-19 ont été admis à l’hôpital avec des marqueurs d’inflammation systémique tels que les concentrations de protéine C-réactive (CRP), les numérations de globules blancs (WBC) et de neutrophiles et le rapport neutrophiles/lymphocytes (N/L) similaires à ceux des patients atteints de grippe (tableau supplémentaire 1 et données étendues Fig. 4a-f). Ils présentaient même une fièvre plus faible et un score CURB-65 plus bas, une mesure couramment utilisée de la gravité de la pneumonie19 (Fig. 4g,h des données étendues). Cependant, au cours du suivi, les patients avec COVID-19 ont développé une incidence beaucoup plus élevée de SDRA nécessitant une assistance en soins intensifs. Dans notre cohorte, 16 des 32 patients (50 %) ont développé une maladie critique, dont 3 sont décédés, contre seulement 3 des 16 patients atteints de la grippe (18,7 %), dont aucun n’est décédé (Données étendues, Fig. 5). Les patients atteints de COVID-19 sont devenus gravement malades sur une période beaucoup plus longue (le premier patient étant apparu le premier jour et le dernier le neuvième jour après l’admission à l’hôpital ; Fig. 1a et Données étendues Fig. 5) que les patients atteints de la grippe, qui ont manifesté une maladie grave dès le premier jour après l’admission. Ce résultat est en accord avec l’incidence élevée et l’évolution prolongée de l’insuffisance respiratoire sévère décrite pour le COVID-19 (réf. 4,12). Il est intéressant de noter que parmi les patients atteints de COVID-19, ceux qui sont devenus gravement malades présentaient des concentrations de CRP, des numérations de globules blancs et de neutrophiles et un rapport N/L plus élevés à l’admission (figure 4a-f des données étendues), mais pas de CURB-65 ni de fièvre (figure 4g,h des données étendues et tableau supplémentaire 2). Les patients grippés gravement malades avaient également tendance à présenter des numérations leucocytaires et neutrophiles, un rapport N/L et un CURB-65 plus élevés, alors que les patients grippés non hospitalisés ne présentaient aucune de ces augmentations (Données étendues Fig. 4a-h).
Nous avons donc cherché à savoir si les profils temporels des cytokines diffèrent entre les différents groupes de patients. Notamment, nous avons observé que, bien que les patients atteints de COVID-19 qui ne sont pas tombés gravement malades aient produit peu d’IFN de type I ou III, ceux qui sont tombés gravement malades présentaient des niveaux d’IFN-λ significativement plus élevés au jour 1-3 par rapport aux patients sains et non gravement malades (Fig. 2a). Certains des patients gravement malades ont également produit de l’IFN-α (Fig. 2a), bien qu’à des quantités significativement plus faibles par rapport aux patients non hospitalisés atteints de grippe légère (Fig. 2a) ou au nombre total de patients hospitalisés atteints de grippe (à la fois gravement et non gravement malades ; P < 0,05). Au contraire, tous les patients atteints de COVID-19 ont produit des cytokines pro-inflammatoires telles que le TNF, l’IL-6, l’IL-8, l’IL-10 et l’IFN-γ, les patients gravement malades présentant également des concentrations significativement plus élevées d’IL-6 et d’IL-7 que les patients non gravement malades à des intervalles de temps spécifiques et une tendance à l’augmentation de l’IFN-γ, ce qui est cohérent avec l’état hyper-inflammatoire accru dans lequel ils se trouvaient (Fig. 2a et Données étendues Fig. 6). Les données individuelles des patients ont confirmé ces tendances (données étendues Fig. 7). Le taux de CCL3 était significativement plus élevé que celui des témoins sains chez les patients non gravement malades atteints de COVID-19, mais pas chez ceux qui étaient gravement malades (Fig. 2a). En comparaison, les patients grippés gravement malades et non gravement malades ne différaient pas dans leur capacité à produire des IFN de type I et de type III, ni des cytokines pro-inflammatoires telles que le TNF, l’IL-6 ou l’IL-7 (Fig. 2a et Données étendues Fig. 6). De même, les patients non hospitalisés atteints de la grippe avec une maladie bénigne ont présenté une forte production d’IFN de type I et de type III, ce qui indique qu’à travers le spectre de la gravité de la grippe, la réponse antivirale reste robuste. Ils présentaient également une production similaire de cytokines pro-inflammatoires telles que le TNF, l’IL-6, l’IL-7, l’IL-8 et l’IFN-γ, mais des niveaux plus élevés de CCL3 par rapport aux patients grippés hospitalisés, qu’ils soient gravement malades ou non. La visualisation de ces profils sur un graphique radar révèle un déséquilibre majeur dans l’induction des réponses antivirales et pro-inflammatoires des patients atteints de COVID-19 qui ne se produit pas dans la grippe (Fig. 2b).

a, taux sériques d’IFN-λ1, IFN-α, IFN-γ, TNF, IL-6, IL-7, IL-8, IL-10 et CCL3 pour les patients gravement et non gravement malades atteints de COVID-19 et de grippe et les patients non hospitalisés atteints de grippe légère aux jours 1-3 et 7-10 intervalles de temps après l’admission ou la visite à l’hôpital, respectivement, ainsi que pour les individus sains. Les points montrent les mesures individuelles et les lignes les valeurs médianes des patients hospitalisés et des individus sains. Les carrés représentent les patients non hospitalisés atteints de la grippe. L’ombrage gris marque la limite de quantification du test. b. Graphiques radar des niveaux médians de cytokines et de la fourchette des patients hospitalisés atteints de COVID-19 et de la grippe développant une maladie critique ou non, des patients non hospitalisés atteints de la grippe et des individus sains au jour 1-3 après l’admission. Chaque cercle du graphique radar représente des concentrations logarithmiquement croissantes de 4-256 pg ml-1, comme indiqué chez les témoins sains. Pour les jours 1-3, n = 9, 7, 24, 13 et 3 pour chacun des cinq groupes consécutifs, respectivement. Pour les jours 7-10, n = 8, 13, 15, 12 et 2, respectivement. Pour les individus sains, n = 10. Les valeurs P ont été déterminées par un test U bilatéral de Mann-Whitney pour les comparaisons non paramétriques. *P < 0,05, **P < 0,01 et ***P < 0,001 montrent la signification par rapport aux témoins sains. #P < 0,05, ##P < 0,01 et ###P < 0,001 montrent la signification entre COVID-19 et les sous-groupes de grippe.
Nous avons ensuite cherché à déterminer si les profils de cytokines déséquilibrés chez les patients atteints de COVID-19 sont liés aux effets immunitaires systémiques et aux paramètres liés à la gravité de la maladie. À cette fin, nous avons obtenu les transcriptomes temporels des leucocytes de cinq individus sains et de neuf patients atteints de COVID-19, cinq non critiques et quatre gravement malades, à partir du jour 1 de l’entrée dans le service ou l’unité de soins intensifs et à différents points dans le temps par la suite. Au total, 24 ensembles complets de données d’expression génique RNA-seq ont été analysés. Les analyses de regroupement ont révélé que les échantillons se regroupent en fonction de la gravité du phénotype clinique, ce qui indique qu’il s’agit de la principale source de variation et permet de prédire quels patients évolueront vers une maladie critique ou non critique (figure 3a et figure 8 des données étendues). En nous concentrant sur le premier jour, qui est le moment le plus pertinent, nous avons constaté que 4 225 gènes étaient exprimés de manière différentielle chez les patients atteints de COVID-19 par rapport aux individus sains (tableau supplémentaire 3). Lorsque les patients gravement malades et les patients non gravement malades ont été comparés séparément aux témoins sains, 4 214 et 4 902 gènes exprimés de manière différentielle (DEG) ont été observés, respectivement, dont 1 979 étaient communs tandis que le reste se trouvait uniquement dans l’un ou l’autre groupe de patients (figure 3b et tableaux supplémentaires 3 et 4). Parmi ces DEG, 2 674 gènes étaient également significativement différents entre les patients gravement malades et les patients non gravement malades (tableau supplémentaire 5). Les diagrammes de Volcano ont mis en évidence des différences notables dans les gènes les plus régulés entre les groupes, les patients gravement malades présentant des profils génétiques de réponse immunitaire et antivirale plus forts (Fig. 3c-e). L’analyse des voies des DEG a en effet révélé que les voies les plus importantes surreprésentées chez les patients gravement malades étaient liées à la régulation positive du système immunitaire, à l’activation de la réponse immunitaire innée, à la réponse de défense contre les virus et à la réponse cellulaire à l’IFN (Fig. 3f et Tableau supplémentaire 6). L’induction de la voie de production de l’IL-1β et la réponse à l’IL-1 étaient également importantes. En revanche, chez les patients non gravement malades, ces voies n’étaient pas significativement régulées à la hausse, à l’exception de la voie de production de l’IL-1β (Fig. 3f). D’autres voies surreprésentées comprenaient plutôt la régulation de la taille des composants cellulaires et la cytotoxicité des cellules tueuses naturelles (NK) (Fig. 3f).
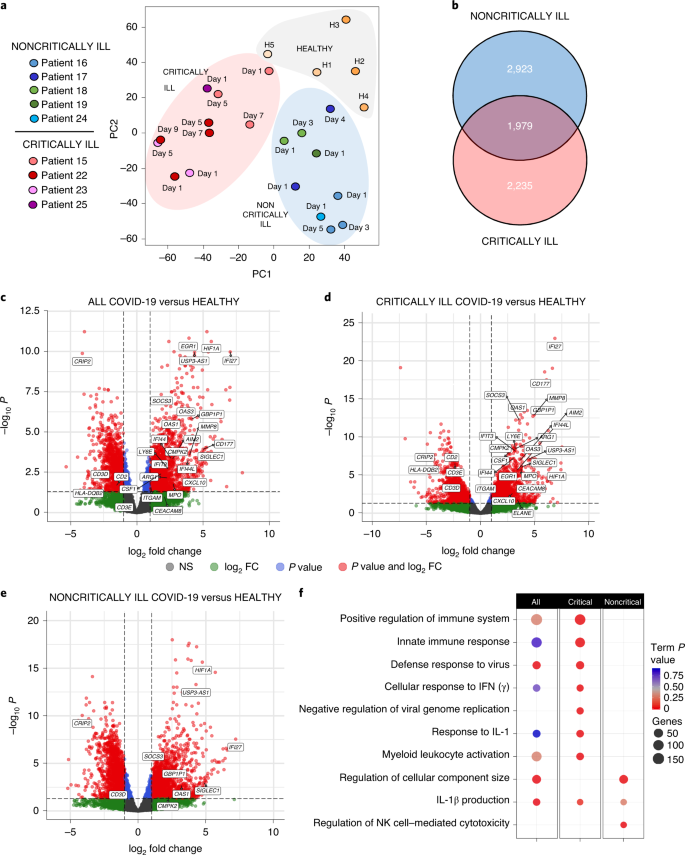
a, Analyse en composantes principales des transcriptomes de WBC périphériques de patients gravement malades (n = 4) et non gravement malades (n = 5) ou de témoins sains (H1-H5) (n = 5). b. Diagramme de Venn montrant les DEG uniques et communs des transcriptomes périphériques des leucocytes des patients gravement malades (n = 4) et non gravement malades (n = 5) par rapport aux individus sains (n = 5). c-e. Diagrammes de Volcano montrant les DEG les plus significativement régulés et pertinents chez tous les patients atteints de COVID-19 (c) et leurs sous-groupes gravement (d) et non gravement malades (e) par rapport aux individus sains au jour 1 de l’hospitalisation. L’analyse des DEG a été réalisée à l’aide de DESeq2 v.1.22.2. FC, fold change ; NS, non significatif. f, analyse d’enrichissement des voies de l’ontologie génétique (GO) des DEG de tous les patients, des patients gravement malades et des patients non gravement malades avec COVID-19 au premier jour de l’hospitalisation ou de l’entrée en soins intensifs. ClueGO a été utilisé et les valeurs P des termes ont été ajustées en utilisant la correction de Bonferroni pour les comparaisons multiples. La visualisation a été effectuée à l’aide du paquet R ggplot2. La taille des points indique le nombre de gènes exprimés de manière différentielle par voie, et la couleur rouge indique la signification statistique.
En conséquence, les cartes thermiques avec des informations temporelles ont dévoilé une forte induction d’un long ensemble de gènes antiviraux chez les patients gravement malades, alors que seule une fraction d’entre eux était régulée à la hausse dans le groupe non gravement malade (figure 4a et tableau supplémentaire 3). Cet ensemble comprend les gènes de réponse antivirale classiques, qui peuvent être induits par l’IFN de type I et III, tels que Stat1, Stat3, Irf1, Irf2, Socs3, Isg20, Oasl, Ifi5, Ifit1b, Ifit5, Ifitm10, Gbp1, Gbp2, Gbp4, Gbp5 et Gbp6, tous significativement régulés à la hausse chez les patients gravement malades par rapport aux individus sains ou non gravement malades, et Irf3, Socs3, Mx1, Oas1, Ifi27, Ifi44 et Ifitm5 également régulés à la hausse chez les patients non gravement malades, mais dans une moindre mesure que chez les patients gravement malades (tableau supplémentaire 5). La comparaison de l’ensemble des gènes antiviraux exprimés au jour 1, comme le montre la figure 4a, a confirmé une différence statistiquement significative entre les patients gravement malades et ceux qui ne le sont pas (P = 1,25 × 10-20), en accord avec les modèles distincts de production d’IFN-λ et d’IFN de type I chez ces patients. Cette réponse plus forte à l’IFN de type I/III chez les patients gravement malades n’était probablement pas due à une expression plus élevée des composants du récepteur de l’IFN, car aucune différence significative n’a été observée entre les niveaux d’ARNm d’Ifnlr1, d’Il10rb et d’Ifnar1 parmi les groupes de patients et les individus sains, à l’exception d’une augmentation de deux fois d’Ifnar2 chez les patients gravement malades (tableau supplémentaire 3).
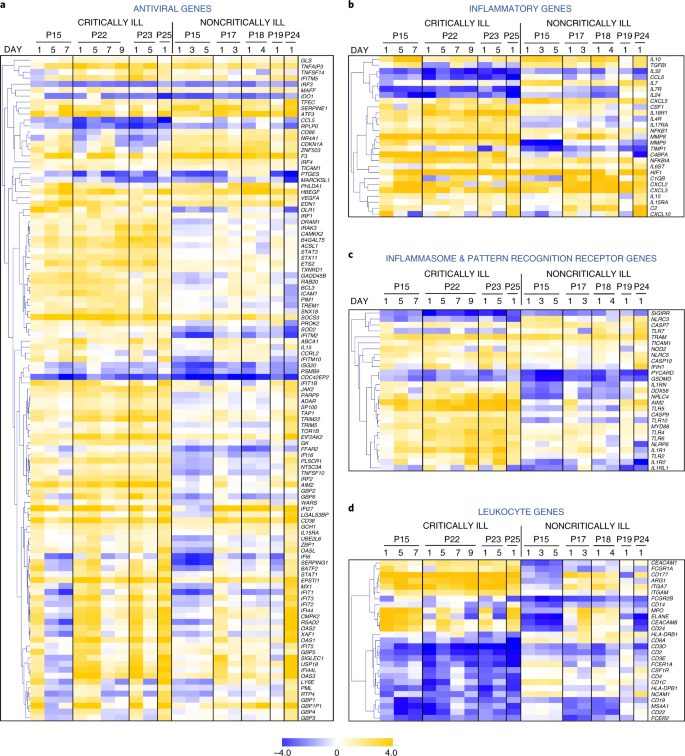
a-d, Cartes thermiques montrant les schémas temporels des gènes antiviraux différentiellement exprimés (a), des gènes inflammatoires (b), des gènes inflammasomes et PRR (c) et des gènes leucocytaires (d) des patients gravement malades et non gravement malades atteints de COVID-19 par rapport aux individus sains. Les couleurs bleues et jaunes représentent les gènes régulés à la baisse et à la hausse, respectivement. Les données sont exprimées en valeurs log2 fold par rapport aux contrôles sains. P, patient.
D’autres analyses de cartes thermiques ont mis en évidence une réponse immunitaire innée systémique plus forte chez les patients gravement malades, marquée par une expression accrue des médiateurs pro-inflammatoires clés, y compris les composants du complément (C2, C4bpa), les cytokines (Csf1, Cxcl10) et les métalloprotéinases matricielles (Mmp8, Mmp9) par rapport aux individus sains (Fig. 4b). Au contraire, les patients non gravement malades présentaient une expression accrue d’Il10, une cytokine anti-inflammatoire majeure qui amortit les tempêtes et d’Il7, qui est impliquée dans le maintien de l’homéostasie des cellules T dans la périphérie. Notamment, les gènes de l’inflammasome tels que Nlrp6, Nrlc4, Nod2, Aim2, Casp9, Casp10, Il1rn et Il1r1, tous liés à la production ou à la réponse de l’IL-1β20, étaient également régulés à la hausse chez les patients gravement malades atteints de COVID-19, tandis que Pycard (Asc), un composant clé de l’assemblage de l’inflammasome, était régulé à la baisse chez les patients non gravement malades par rapport aux individus sains, ce qui indique un rôle important de la voie de l’IL-1β dans les maladies plus graves (Fig. 4c). Les récepteurs de reconnaissance des formes (PRR) impliqués dans la reconnaissance microbienne, tels que Ddx58 (Rigi), Aim2, Ifih1 (Mda5), Ifi16, Tlr2 et Tlr4, étaient également régulés à la hausse. Globalement, lorsqu’ils sont comparés en tant qu’ensemble, les gènes de l’inflammasome et du PRR présentés dans la figure 4c étaient significativement différents entre les deux groupes (P = 9,72 × 10-7). Au niveau du type cellulaire, l’analyse de l’expression génétique a révélé une signature dominante de cellules neutrophiles/myéloïdes activées (Mpo, Elane, Cd177, Itgam, Arg1, Ceacam8 et Fcgr1a) dans le groupe des patients gravement malades, qui était plus légère et non significative chez les patients non gravement malades (Fig. 4d). Au contraire, les lignées lymphocytaires T, B et NK et les gènes associés (Cd3d, Cd3e, Cd4, Cd8a, Cd19, Cd22 et Ncam1) étaient nettement régulés à la baisse chez les patients gravement malades. Ces données sont cohérentes avec la lymphopénie, le nombre élevé de neutrophiles et le rapport N/L élevé également présents chez ces patients (données étendues Fig. 4) et précédemment signalés comme étant associés à une maladie plus grave et à des résultats plus mauvais chez les patients atteints de COVID-19 (réf. 3,4). Les cytokines telles que le TNF, l’IL-6 et l’IL-8 peuvent directement expliquer ces effets, car elles sont bien connues pour déclencher la mobilisation et l’activation des neutrophiles, le développement de la lymphopénie et l’induction de réponses immunitaires innées et d’une inflammation systémique21,22. Ainsi, les transcriptomes des leucocytes des patients atteints de COVID-19, au début de l’hospitalisation, peuvent fournir des informations vitales sur la gravité de la maladie et guider le traitement, tel que l’administration d’inhibiteurs de l’IL-1, de manière plus personnalisée.
Il est intéressant de noter que les schémas de cytokines déséquilibrés chez les patients atteints de COVID-19 avec une pneumonie étaient associés à un résultat de la maladie beaucoup plus mauvais par rapport à la grippe. Premièrement, le groupe COVID-19 a présenté une incidence plus élevée de maladie critique et de mortalité (données étendues Fig. 5). Deuxièmement, les patients atteints de COVID-19 dans leur ensemble, ainsi que lorsqu’ils sont regroupés selon qu’ils sont gravement ou non gravement malades, ont dû être hospitalisés plus longtemps que leurs homologues grippés (Fig. 5a-c). Chez les patients atteints de COVID-19, la durée médiane était respectivement de 14 et 23 jours, contre 7 et 19 jours pour la grippe (Fig. 5b,c). L’hospitalisation prolongée pourrait être attribuée aux réponses antivirales non réglées, entraînant une évolution clinique plus longue du COVID-19 par rapport à la grippe et la nécessité d’un rétablissement plus long, même pour le groupe non gravement malade.
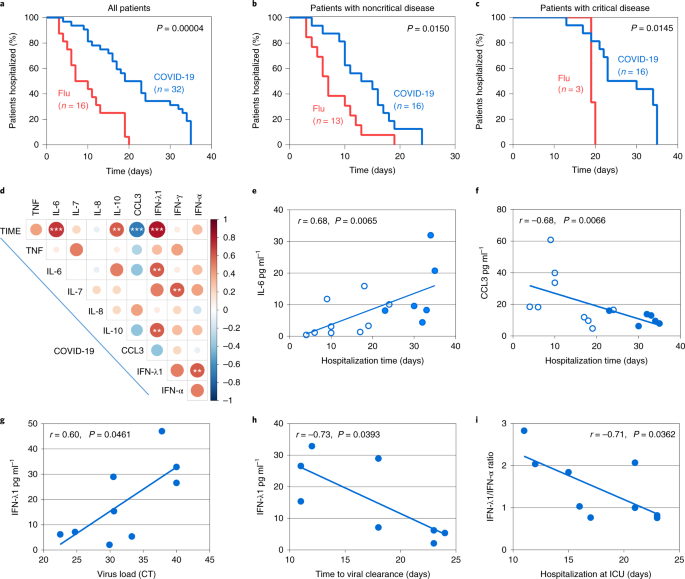
a-c, Comparaison de la durée d’hospitalisation entre les patients atteints de COVID-19 et de grippe. Tous les patients (a), les patients atteints d’une maladie non critique (b) et les patients atteints d’une maladie critique (c) sont représentés. d, Matrice de corrélation des niveaux de concentration des cytokines dans le sérum à l’intervalle de temps jour 1-3 après l’admission à l’hôpital des patients atteints de COVID-19, indiquant les corrélations entre les cytokines et la durée totale d’hospitalisation (TIME) ou d’autres cytokines. e,f, Corrélation des niveaux d’IL-6 (e) et de CCL3 (f) dans le sérum avec la durée d’hospitalisation totale de tous les patients atteints de COVID-19. g, Corrélation des niveaux d’IFN-λ1 avec la charge virale exprimée en valeurs tomodensitométriques dans les aspirats bronchiques prélevés au même intervalle de temps que les sérums utilisés pour la quantification de l’IFN-λ1. h, Corrélation des niveaux d’IFN-λ1 avec le temps nécessaire à la clairance virale évaluée comme le premier test négatif du SRAS-CoV-2. i, Corrélation du rapport IFN-λ1:IFN-α avec la durée d’hospitalisation en soins intensifs. Les points indiquent les mesures individuelles des patients atteints de COVID-19. Les points ouverts et ombragés correspondent aux patients non critiques et critiques atteints de COVID-19, respectivement (e-i). Pour a-c, les valeurs P pour la comparaison des courbes d’hospitalisation entre les groupes de patients ont été déterminées à l’aide du test log-rank. Pour d-i, les valeurs P pour la force et la direction de l’association entre les deux variables, comme indiqué dans chaque panneau, ont été déterminées en utilisant le coefficient de corrélation d’ordre de rang de Spearman pour les données non paramétriques. **P < 0,01 et ***P < 0,001.
Pour identifier les cytokines et les combinaisons de cytokines qui peuvent prédire la durée d’hospitalisation, et donc avoir une valeur pronostique pour la stratification du risque indépendamment des paramètres de laboratoire et de gravité clinique connus (tels que la saturation en O2, la fréquence respiratoire ou le rapport N/L), nous avons généré une matrice de corrélation des niveaux de cytokines à l’admission (intervalle jour 1-3) et de la durée d’hospitalisation (Fig. 4d). Nous avons constaté que des concentrations plus élevées d’IL-6 et d’IL-10, et plus faibles de CCL3, étaient directement proportionnelles à la durée de l’hospitalisation (Fig. 5d-f). La valeur de l’IL-6 et de l’IL-10 en tant que biomarqueurs pour le suivi de la sévérité du COVID-19 a été rapportée4,23,24 mais pour le CCL3, c’est nouveau. Notamment, la concentration d’IFN-λ était également corrélée à des taux plus élevés d’IL-6 et d’IL-10 et à une durée d’hospitalisation plus longue, ce qui est cohérent avec leur induction presque exclusive chez les patients gravement malades, mais pas chez les patients non gravement malades (Fig. 5d).
Une question qui se pose est de savoir si les niveaux d’IFN induits chez les patients gravement malades sont bénéfiques, car il a été démontré dans des modèles animaux qu’une production retardée d’IFN de type I ou de type III entraîne une immunopathologie13,14,25 ou interfère avec la réparation épithéliale26,27, respectivement. Nous avons constaté que des concentrations plus élevées d’IFN-λ pendant l’entrée en soins intensifs étaient associées à une charge virale SRAS-CoV-2 plus faible dans les voies respiratoires et à une clairance virale plus rapide (Fig. 5g,h). De plus, un rapport IFN-λ/IFN de type I plus élevé à ce moment-là était lié à un séjour plus court dans l’unité de soins intensifs (Fig. 5i), les deux patients présentant les niveaux d’IFN-α les plus élevés présentant également le séjour le plus long (23 jours chacun pour une médiane de 17 jours). Ces données suggèrent que l’induction retardée de l’IFN-λ peut encore être protectrice chez les patients gravement malades atteints de COVID-19, tandis que l’IFN-α peut faire plus de mal que de bien, au moins chez un sous-ensemble de patients.
Ensemble, nos résultats démontrent que l’infection par le SRAS-CoV-2 ne suit pas le paradigme conventionnel de l’immunité antivirale. Au lieu d’activer d’abord la réponse antivirale suivie du processus pro-inflammatoire comme deuxième ligne de protection, elle fait le contraire ; elle déclenche la réponse pro-inflammatoire bien avant que les défenses antivirales médiées par l’IFN ne soient induites, voire pas du tout. Ce scénario constitue un paradoxe majeur et contribue à expliquer bon nombre des caractéristiques uniques ou inhabituelles du COVID-19. La longue durée d’incubation du virus et sa persistance dans les voies respiratoires, donnant des tests positifs pour le SRAS-CoV-2 pendant des semaines, peuvent être attribuées à la production retardée et/ou réduite des IFN de type I et III. L’absence de symptômes ou des symptômes très légers chez les patients pendant une période exceptionnellement longue, peut être attribuée à l’absence ou à l’expression altérée et retardée des IFN de type I, principaux médiateurs de l’état grippal et des symptômes tels que l’écoulement nasal, la toux, la fatigue, la dyspnée et la fièvre chez l’homme28. Enfin, l’expression précoce et persistante de cytokines pro-inflammatoires aboutissant à une hyperinflammation prolongée peut favoriser le développement soudain d’une insuffisance respiratoire nécessitant une hospitalisation et souvent une admission en soins intensifs. Il convient de noter que, chez la grippe, l’induction rapide de la réponse IFN de type I et III, quel que soit le degré de gravité de la maladie, est corrélée à un rétablissement plus rapide et à une incidence nettement plus faible de maladie grave ou de mortalité13,25. La récente démonstration, dans le cadre d’une étude de cohorte rétrospective portant sur 446 patients atteints de COVID-19, que l’administration précoce d’IFN-α (IFN-a2b) est liée à une réduction de la mortalité hospitalière, alors qu’un traitement tardif par IFN-α entraîne une augmentation de la mortalité et un retard de guérison, ne laisse guère de doute sur le fait que le moment de la production d’IFN est également crucial chez les patients atteints de COVID-19 (réf. 29). Il est concevable que la production tardive d’IFN de type I ou III ne confère aucune résistance virale, mais favorise au contraire l’immunopathologie.
Si cette évolution clinique unique du COVID-19 est liée à la présence d’inhibiteurs de l’IFN dérivés du SRAS-CoV-2, comme cela a été proposé précédemment pour le SRAS-CoV30,31 et le MERS-CoV32, on ne sait pas mais c’est une possibilité. Comme pour d’autres virus, l’inhibition peut être surmontée une fois que des charges virales plus élevées sont atteintes, par exemple après incubation du virus et propagation éventuelle chez des individus sensibles. Dans notre étude, nous n’avons pas constaté de différences significatives dans les niveaux de virus entre les patients non critiques et les patients gravement malades au moment où les IFN ont été mesurés (Données étendues Fig. 9). Cependant, une charge virale plus élevée dans les cas de maladie grave que dans les cas de maladie légère a été décrite dans une étude mais n’a pas été confirmée dans une autre33,34. De plus, une charge virale plus élevée peut surmonter la suppression dose-dépendante du SRAS-CoV-2 de la production d’IFN dans les cellules épithéliales respiratoires en culture16.
Notre étude n’est pas sans mise en garde. Premièrement, elle caractérise les schémas de cytokines dans la circulation et bien que ceux-ci soient couramment utilisés pour analyser les » tempêtes de cytokines » en réponse à l’infection, il est difficile de savoir dans quelle mesure ils sont corrélés aux réponses immunitaires dans les voies respiratoires. Deuxièmement, notre étude est relativement petite et nos résultats doivent être validés par d’autres cohortes. Néanmoins, notre étude est particulièrement instructive car elle traite de la production d’IFN et de l’activation de la « tempête de cytokines » dans la cohorte COVID-19 de manière temporelle, de l’admission à l’hôpital à l’entrée en soins intensifs, et devrait donc être particulièrement utile pour la conception d’essais cliniques testant les thérapies IFN. Il décrit également des biomarqueurs tels que IL-6 et CCL3 et des signatures d’expression génique qui peuvent être particulièrement utiles pour évaluer le risque de développement d’une maladie grave et la durée d’hospitalisation des patients atteints de COVID-19 nouvellement admis à l’hôpital. Enfin, il fournit une comparaison côte à côte du COVID-19 avec la grippe, en étudiant des populations de patients présentant des caractéristiques génétiques, démographiques et clinicopathologiques similaires, et met donc en évidence des différences importantes dans la réponse immunitaire antivirale entre ces deux maladies, qui n’avaient pas été soupçonnées auparavant.
0 commentaire