Estrogènes et DE en recherche fondamentale
Intéressant, l’administration d’œstrogènes diminue la fonction érectile dans les modèles animaux . Les chercheurs ont administré de l’œstradiol par voie orale à des rats, ce qui a entraîné un taux élevé d’œstradiol et un faible taux de testostérone. En outre, la réponse de la pression intracaverneuse (PIC) à la stimulation nerveuse était également altérée dans tous les groupes traités, et la coloration au trichrome a démontré la présence d’une hyperplasie du tissu conjonctif caverneux dans les groupes étudiés à long terme . L’administration orale d’estradiol à des lapins a entraîné des taux élevés d’estradiol et des taux faibles de testostérone, semblables aux effets observés chez les rats. De plus, l’acétylcholine a induit une relaxation médiée par l’endothélium chez les animaux normaux, mais cet effet a été significativement atténué dans les groupes traités, et la neurotransmission non adrénergique et non cholinergique médiée par le NO a été diminuée dans les groupes de traitement .
Dans nos études précédentes, l’administration sous-cutanée (s.c.) d’œstradiol à des rats a entraîné des niveaux élevés d’œstradiol et des niveaux bas de testostérone, diminuant ainsi la fonction érectile . De plus, nous avons administré de la testostérone à des rats présentant un déficit élevé en testostérone induit par les œstrogènes ; cependant, la fonction érectile ne s’est pas améliorée. Il est intéressant de noter que l’administration d’œstrogènes augmente la contraction des muscles lisses dans les corps caverneux, régulant à la hausse la voie de signalisation RhoA/Rho-kinase, qui est impliquée dans la dysfonction érectile. Vignozzi et al. ont démontré que la DE induite par un régime riche en graisses est associée à des niveaux élevés d’œstradiol, plutôt qu’à de faibles niveaux de testostérone .
Nous avons également étudié l’influence du déséquilibre œstradiol-testostérone sur la fonction érectile chez le rat (figures 1-6 ; tableau 1). Des rats mâles Wistar ST (âgés de 11 semaines, Japan SLC Inc., Hamamatsu, Japon) ont été séparés en cinq groupes. Dans le groupe à faible taux de testostérone (Low-T) (n = 11), les rats ont reçu une injection de goséréline (agoniste de la LH-RH, 0,9 mg/kg, s.c.). Dans le groupe à faible taux de testostérone et à taux élevé d’œstrogènes (Low-T/High-E) (n = 11), les rats ont reçu une injection quotidienne de goséréline et d’œstradiol (3 μg/kg/jour, s.c.) de la semaine 2 à la semaine 4. Dans le groupe à taux élevé d’œstrogènes (High-E) (n = 11), les rats ont reçu une injection quotidienne d’œstradiol de la semaine 2 à la semaine 4. Dans le groupe à forte concentration d’œstrogènes et de testostérone (High-E/High-T) (n = 11), les rats ont reçu une injection quotidienne d’œstradiol et de testostérone (3 mg/kg/jour, s.c.) de la 2e à la 4e semaine. Dans le groupe témoin (n = 11), les rats n’ont reçu aucune injection d’hormone. Le tableau 1 montre les concentrations d’hormones sexuelles chez les rats. L’injection de goséréline a diminué de façon significative la testostérone biodisponible sérique (contrôle : 1,20 ± 0,13 ng/mL, Low-T : 0,55 ± 0,04 ng/mL, P < 0,01 par rapport au contrôle ; Low-T/High-E : 0,73 ± 0,06 ng/mL, P < 0,05 par rapport au contrôle). L’injection de testostérone a significativement augmenté la testostérone biodisponible sérique (témoin : 1,20 ± 0,13 ng/mL, High-E/High-T : 2,58 ± 0,31 ng/mL, P < 0,001 par rapport au témoin). L’injection d’estradiol a augmenté de manière significative les œstrogènes sériques (contrôle : 102,5 ± 8,7 pg./mL, Low-T/High-E : 275,4 ± 34,4 pg./mL, P < 0.01 par rapport au témoin ; High-E : 332,3 ± 17,4 pg./mL, P < 0,001 par rapport au témoin ; High-E/High-T : 401,5 ± 51,6 pg./mL, P < 0,001 par rapport au témoin).
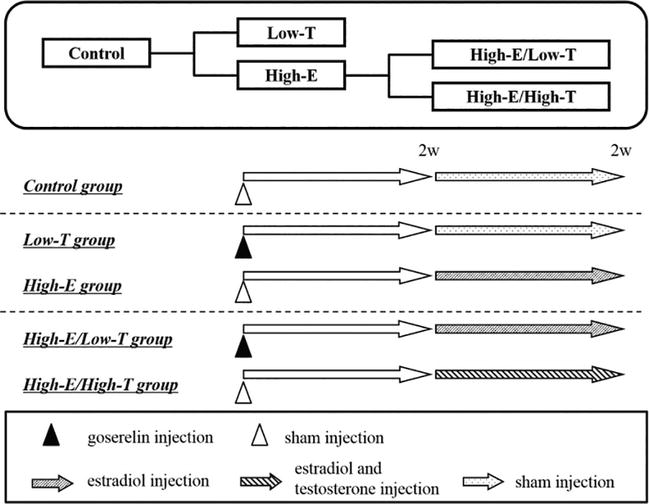
Figure 1.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceDispositif expérimental. Dans le groupe témoin, les rats ont reçu une injection de véhicule pendant 2 semaines. Dans les groupes Low-T et High-E, les rats ont reçu une injection d’acétate de goséréline (agoniste de la LH-RH, 0,9 mg/kg par voie sous-cutanée) au jour 0. Dans le groupe traité aux œstrogènes (High-E), les rats ont reçu une injection d’œstradiol (3 mg/kg/jour par voie sous-cutanée) pendant 2 semaines. Dans le groupe traité par œstrogènes et testostérone (High-E/High-T), les rats ont reçu une injection d’œstradiol (3 mg/kg/jour par voie sous-cutanée) et de testostérone (3 mg/kg/jour par voie sous-cutanée) pendant 2 semaines. A la fin de cette période, les rats ont subi des tests de fonction érectile in vivo ou in vitro.

Figure 2.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceMesure de la pression intracaverneuse (PIC). Variations maximales de la PIC pendant la stimulation électrique du nerf caverneux dans les groupes témoin, Low-T, High-E, High-E/Low-T et High-E/High-T. Les données représentent les moyennes ± les erreurs standard des moyennes (n = 6 par groupe). **P < 0,01 par rapport au groupe témoin par analyse de variance et tests t multiples de type Bonferroni.
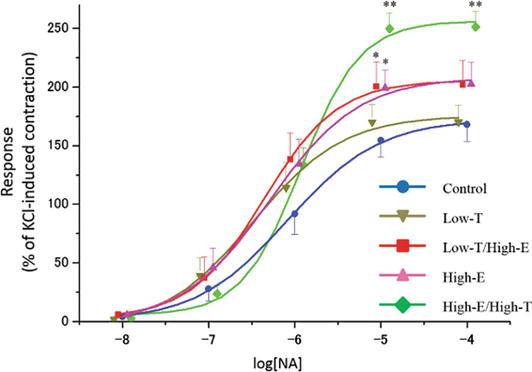
Figure 3.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceLes courbes de contraction induites par la noradrénaline (NA) dans les bandelettes des corps caverneux de rat. Le tonus contractile induit par 80 mM KCl a été considéré comme 100%. Les données rapportées dans tous les graphiques représentent les moyennes ± les erreurs standard des moyennes (n = 5 par groupe). *P < 0,05, **P < 0,01 par rapport au groupe témoin par analyse de variance et tests t multiples de type Bonferroni. Les valeurs Emax sont indiquées dans le texte.
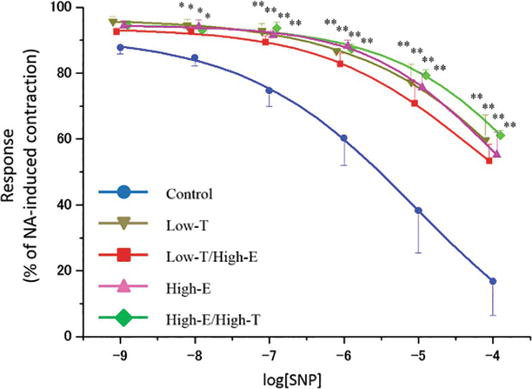
Figure 4.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceLa courbe de relaxation induite par le nitroprussiate de sodium (SNP) dans les bandelettes des corps caverneux de rat. Les bandes ont été précontractées avec 10-5 M NA. Les données rapportées dans tous les graphiques représentent les moyennes ± les erreurs standard des moyennes (n = 5 par groupe). *P < 0,05, **P < 0,01 par rapport au groupe témoin par analyse de variance et tests t multiples de type Bonferroni. Les valeurs Emax sont indiquées dans le texte.

Figure 5.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceLes courbes de relaxation induites par l’inhibiteur de la Rho-kinase Y-27632 dans les bandelettes du corps caverneux de rat. Les bandes ont été précontractées à l’aide de 10-5 M NA. Les données rapportées dans tous les graphiques représentent les moyennes ± les erreurs standard des moyennes (n = 5 par groupe). *P < 0,05, **P < 0,01 par rapport au groupe témoin par analyse de variance et tests t multiples de type Bonferroni. Les valeurs IC50 sont indiquées dans le texte.
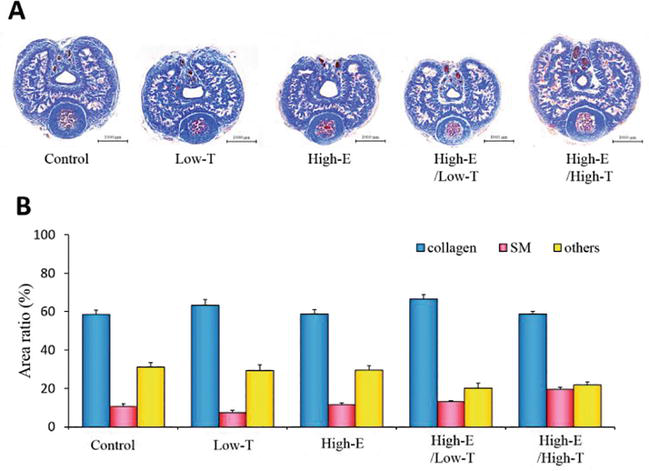
Figure 6.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceLes sections du pénis de rat de la coloration trichrome de Masson. (A) Spécimens représentatifs des corps caverneux des rats de chaque groupe. (B) Évaluation histologique des tissus. Les rapports de surface des fibres de collagène, du muscle lisse (SM) et autres ont été calculés à l’aide d’une analyse d’image informatisée. Les données rapportées dans tous les graphiques représentent les moyennes ± les erreurs standard des moyennes (n = 3 par groupe).
| Bio-T (ng/mL) | Estrogène (pg/mL) | |
|---|---|---|
| Contrôle | 1.20 ± 0,13 | 102,5 ± 8,7 |
| Low-T | 0,55 ± 0,04** | 51,2 ± 4.2 |
| High-E | 0,90 ± 0,12 | 332,3 ± 17,4** |
| High-E/Low-T | 0.73 ± 0,06* | 275,4 ± 34,4** |
High-E/High-T| 2,58 ± 0,31** |
401,5 ± 51.6** |
|
Tableau 1.
Taux sériques d’œstrogènes et de testostérone biodisponible (bio-T) chez le rat.
Les données sont exprimées en moyennes ± erreurs standard des moyennes. *P < 0,05, **P < 0,01 par rapport au groupe témoin par analyse de variance et tests t multiples de type Bonferroni (n = 6 par groupe).
La figure 2 montre la réponse érectile à la stimulation du champ électrique du nerf caverneux dans les différents groupes expérimentaux. L’analyse du rapport PIC/PAM a révélé que les rapports dans les groupes Low-T (0,52 ± 0,03), Low-T/High-E (0,46 ± 0,03), High-E (0,44 ± 0,03) et High-E/High-T (0,44 ± 0,02), qui représentaient tous les rats traités, étaient significativement plus faibles que dans le groupe témoin (0,70 ± 0,04, P < 0,01). Ces données suggèrent que les réponses érectiles étaient diminuées chez les rats présentant un déséquilibre des hormones sexuelles.
La figure 3 montre la réponse contractile des bandes de corps caverneux de rat à des concentrations croissantes de noradrénaline (NA). On a constaté que des concentrations croissantes de NA contractaient les bandelettes des corps caverneux de rat dans tous les groupes. En particulier, 10 μM de NA ont entraîné des différences statistiquement significatives dans la réponse contractile pénienne in vitro entre les groupes expérimentaux (contrôle : 154,5 ± 14,1 %, Low-T : 169,8 ± 14,8 %, Low-T/High-E : 200,2 ± 21,1 %, High-E : 198,9 ± 15,3 %, High-E/High-T : 249,7 ± 13,5 %). Bien que la réponse contractile ne diffère pas entre le groupe témoin et le groupe Low-T (P > 0,05), les réponses contractiles dans les groupes Low-T/High-E, High-E et High-E/High-T étaient supérieures à la réponse du groupe témoin (P < 0.05).
Les figures 4 et 5 montrent la réponse relaxante des bandes de corps caverneux de rat précontractées par la NA à des concentrations croissantes de nitroprussiate de sodium (SNP) et de Y-27632. Dans tous les groupes, des concentrations croissantes de SNP, donneur de NO, ont détendu les bandes des corps caverneux de rat (contrôle : Emax = 16,8 ± 10,3 %, Low-T : Emax = 59,7 ± 7,6 %, Low-T/High-E : Emax = 53,4 ± 5,0 %, High-E : Emax = 55,2 ± 6,8 %, High-E/High-T : Emax = 61,1 ± 1,5 %). Dans les groupes traités, les sensibilités au SNP étaient significativement plus faibles que dans le groupe témoin (P < 0,01). Des concentrations croissantes de l’inhibiteur de la Rho kinase Y-27632 ont complètement détendu les bandelettes des corps caverneux de rat dans tous les groupes (contrôle : concentration inhibitrice semi-maximale = 1,22 × 10-6 M, Low-T : IC50 = 2,43 × 10-7 M, Low-T/High-E : IC50 = 1,31 × 10-7 M, High-E : IC50 = 2,26 × 10-7 M, High-E/High-T : IC50 = 1,25 × 10-7 M). Lors de l’utilisation de 10-6 M et 10-5 M de Y-27632, les sensibilités au Y-27632 dans les groupes traités étaient significativement plus faibles que dans le groupe témoin (P < 0,01) ; ainsi, les graphiques des groupes traités ont été décalés vers la gauche.
La figure 6 montre l’analyse histologique des corps caverneux des rats. Le rapport de surface du muscle lisse caverneux a été analysé (contrôle : 10,5 ± 1,4 %, Low-T : 7,4 ± 1,1 %, Low-T/High-E : 13,2 ± 0,4 %, High-E : 11,6 ± 0,1 %, High-E/High-T : 19,4 ± 1,1 %). De même, le rapport de surface de la fibre de collagène a été analysé (témoin : 58,4 ± 2,5 %, Low-T : 63,2 ± 3,0 %, Low-T/High-E : 66,5 ± 2,3 %, High-E : 58,8 ± 2,2 %, High-E/High-T : 58,7 ± 1,4 %). Aucune différence statistiquement significative entre les groupes expérimentaux n’a été observée dans les rapports de surface globaux des muscles lisses, des fibres de collagène et des autres paramètres selon les tests de χ2 pour l’indépendance (P > 0,05). Dans l’ensemble, nous avons démontré que les changements dans le milieu des hormones sexuelles affectaient la fonction érectile chez les rats, et notre hypothèse selon laquelle le déséquilibre des hormones sexuelles est associé à la DE a été soutenue par des expériences in vivo et in vitro à l’aide d’outils pharmacologiques.
0 commentaire