Différence principale – Proton vs Positron
Les atomes sont les éléments constitutifs de toute matière. Un atome est composé d’un noyau et d’un nuage d’électrons. Le noyau contient des protons et des neutrons ainsi que d’autres particules telles que les particules alpha et bêta. Un proton est une particule subatomique ayant une charge électrique positive (+1). Un positron est également une particule subatomique chargée positivement. La principale différence entre le proton et le positron est que la masse d’un proton est considérablement plus élevée que celle d’un positron.
Domaines clés couverts
1. Qu’est-ce qu’un proton
– Définition, propriétés
2. Qu’est-ce qu’un positron
– Définition, annihilation
3. Quelles sont les similitudes entre le proton et le positron
– Aperçu des caractéristiques communes
4. Quelle est la différence entre le proton et le positron
– Comparaison des principales différences
Termes clés : Annihilation, antiélectron, masse atomique, nombre atomique, atomes, désintégration bêta, électron, positrons, Protons
Qu’est-ce qu’un proton
Un proton est une particule subatomique dont la charge électrique positive est de +1. Un proton est symbolisé par « p » ou « p+ ». Les protons, avec les neutrons, forment le noyau atomique, qui est le cœur d’un atome. La charge électrique d’un proton est de +1,6022 x 10-19 C (Coulomb). La charge atomique d’un proton est donnée par +1. La masse d’un proton est de 1,6726 x 10-24 g. Mais la masse atomique d’un proton est donnée par 1,0073 amu (unités de masse atomique). Cette valeur est généralement utilisée comme 1 amu. Mais la masse d’un proton est légèrement inférieure à celle d’un neutron.
Le numéro atomique, c’est-à-dire le nombre de protons dans le noyau d’un atome, d’un élément chimique est une propriété unique pour chaque élément. En effet, un élément chimique est reconnu en fonction de son numéro atomique. Le numéro atomique est le nombre total de protons présents dans un atome. Le tableau périodique des éléments est construit sur la base des numéros atomiques des éléments chimiques. Par conséquent, le tableau périodique est constitué d’éléments chimiques classés dans l’ordre croissant des protons présents dans leurs atomes.
Chaque atome et chaque atome est composé d’au moins un proton. Le plus petit atome neutre est un atome d’hydrogène. Il possède un seul proton. Les isotopes d’un élément chimique sont les atomes ayant le même numéro atomique (nombre de protons) et un nombre différent de neutrons.
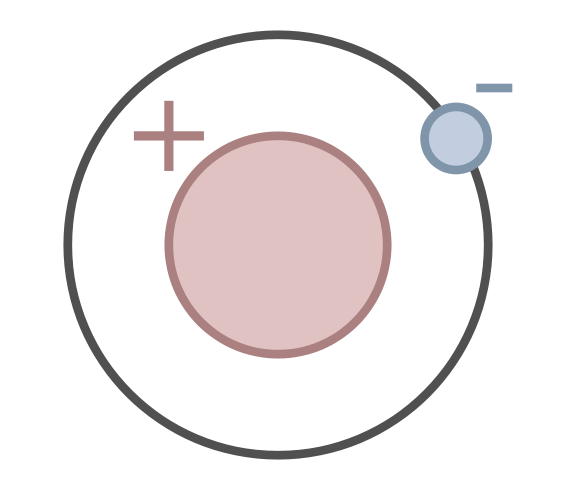
Figure 1 : Le protium est un isotope de l’hydrogène qui possède un proton et un électron
Un proton libre se trouve être stable. Un proton libre est un proton qui n’est pas attaché à des neutrons ou à des électrons. Le proton libre ne se brise pas ou ne se transforme pas en d’autres particules spontanément. Cependant, on sait que les protons peuvent être convertis en neutrons par un processus appelé capture d’électrons. Mais cette conversion est réversible. Les protons libres subissent cette conversion lorsque l’énergie requise est fournie.
p+ + e- ↔ n + Ve
Qu’est-ce qu’un positron
Le positron est une particule subatomique qui est considérée comme un antiélectron. Il s’agit de l’antiparticule de l’électron. Par conséquent, le positron a une charge électrique de +1. La masse du positron est exactement équivalente à celle d’un électron : 9,1094 x 10-28 g. La masse atomique du positron est de 0,00054858 amu. Sa charge électrique est opposée à celle de l’électron : +1,6022 x 10-19 C.
Les positrons sont produits naturellement par désintégration bêta (β+). Cette forme de désintégration se produit dans les isotopes radioactifs. Cette formation de positrons peut être naturelle ou artificielle en fonction de la nature du radioisotope (le radioisotope peut être naturel ou artificiel).
Annihilation des positons

Figure 2 : L’annihilation produit deux ou plusieurs photons de rayons gamma
L’annihilation est un processus dans lequel un positron entre en collision avec un électron, ce qui entraîne la production de deux ou plusieurs photons de rayons gamma, si la collision se produit à une faible énergie.
Similitudes entre le proton et le positron
- Les deux sont des particules subatomiques.
- Les deux ont une charge atomique de +1.
- Les deux ont une charge électrique de +1,6022 x 10-19
Différence entre le proton et le positron
Définition
Proton : Un proton est une particule subatomique dont la charge électrique positive est de +1.
Positron : Le positron est l’antiparticule ou la contrepartie antimatière de l’électron.
Masse
Proton : La masse d’un proton est de 1,6726 x 10-24 g.
Positron : La masse d’un positron est de 9,1094 x 10-28 g.
Masse atomique
Proton : La masse atomique d’un proton est donnée par 1,0073 amu
Positron : La masse atomique du positron est de 0,00054858 amu.
Nature
Proton : Les protons sont les principales particules subatomiques qui sont responsables du numéro atomique d’un élément chimique.
Positron : Les positrons sont les antiparticules des électrons.
Annihilation
Proton : Les protons ne subissent pas d’annihilation.
Positron : Les positrons subissent une annihilation.
Conclusion
Bien que les protons et les positrons soient tous deux des particules subatomiques chargées positivement, il existe des différences entre eux. La principale différence entre le proton et le positron est que la masse d’un proton (1,6726 x 10-24 g) est considérablement plus élevée que celle d’un positron (9,1094 x 10-28 g).
Référence:
1. « Particules subatomiques ». Chemistry LibreTexts, Libretexts, 21 juillet 2016, Disponible ici.
2. « Positron. » Wikipédia, Wikimedia Foundation, 24 janv. 2018, Disponible ici.
3. « Positron ». Encyclopædia Britannica, Encyclopædia Britannica, inc, 3 juin 2013, Disponible ici.
Image courtoisie:
1. « Protium » Par Blacklemon67 sur English Wikipedia – Own work (Texte original : I (Blacklemon67 (talk)) (Public Domain) via Commons Wikimedia
2. « Mutual Annihilation of a Positron Electron pair » By Manticorp – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()
.
0 commentaire