On a noté l’utilisation de l’hydrure de lithium aluminium (LiAlH4) et du borohydrure de sodium (NaBH4) comme réactifs pour la réduction des aldéhydes et des cétones en alcools 1º et 2º respectivement. Parmi ceux-ci, l’hydrure de lithium et d’aluminium, souvent abrégé en LAH, est le plus utile pour la réduction des dérivés d’acides carboxyliques. Grâce à sa grande réactivité, le LAH réduit facilement toutes les classes de dérivés d’acides carboxyliques, généralement à l’état d’oxydation -1. Les acides, les esters, les anhydrides et les chlorures d’acyle sont tous réduits en alcools 1º, et cette méthode est supérieure à la réduction catalytique dans la plupart des cas. Comme les chlorures d’acyle et les anhydrides sont chers et longs à préparer, les acides et les esters sont les réactifs les plus couramment utilisés pour cette transformation. Comme dans les réductions des aldéhydes et des cétones, la première étape dans chaque cas serait l’addition irréversible d’un hydrure à l’atome de carbone carbonyle électrophile. La liaison coordonnée de l’oxygène du carbonyle à un métal acide de Lewis (Li ou Al) renforce sans aucun doute le caractère électrophile de ce carbone. Cette addition d’hydrure est illustrée dans les diagrammes suivants, le fragment donneur d’hydrure étant écrit AlH4(-). Les quatre hydrogènes sont potentiellement disponibles pour la réduction, mais lorsque les acides carboxyliques sont réduits, l’un des hydrures réagit avec le O-H acide pour générer du gaz hydrogène. Bien que le lithium ne soit pas montré, il sera présent dans les produits en tant que composant cationique des sels ioniques.
Les amides sont réduits en amines par traitement avec le LAH, et cela s’est avéré être l’une des méthodes les plus générales pour préparer toutes les classes d’amines (1º, 2º & 3º). Puisque le résultat de la réduction LAH est si différent pour les esters et les amides, nous devons examiner les mécanismes de réaction plausibles pour ces réactions afin de découvrir une raison pour ce comportement divergent.
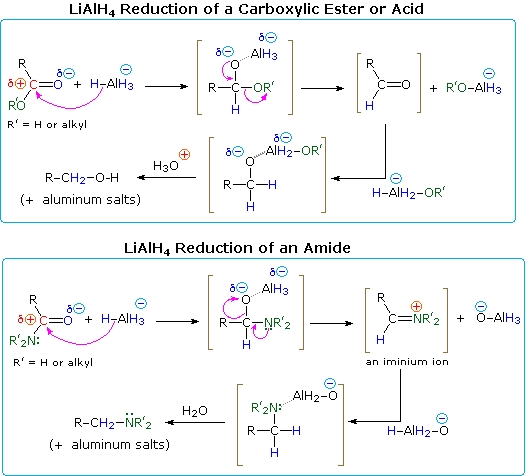
Une explication du cours différent pris par les réductions des esters et des amides réside dans la nature des différents substituants hétéroatomes sur le groupe carbonyle (coloré en vert dans le schéma). L’azote est plus basique que l’oxygène, et les anions amides sont de moins bons groupes partants que les anions alcoxydes. De plus, l’oxygène forme des liaisons particulièrement fortes avec l’aluminium. L’ajout d’un hydrure produit un intermédiaire tétraédrique, représenté entre parenthèses, qui présente une liaison polaire oxygène-aluminium. Ni l’hydrogène ni le groupe alkyle (R) n’est un groupe partant possible, donc si cette espèce tétraédrique doit subir une élimination pour reformer une double liaison hétéroatomique, l’un des deux substituants restants doit être perdu. Pour l’ester, ce choix est facile (décrit par les flèches courbes). En éliminant un alcoxyde d’aluminium (R’O-Al), un aldéhyde est formé, et celui-ci est rapidement réduit en sel d’un 1º-alcool par LAH. Dans le cas de l’amide, la formation de l’aldéhyde nécessite la perte d’un amide d’aluminium (R’2N-Al), un processus peu probable. Alternativement, l’azote plus basique peut agir pour éjecter une espèce d’oxyde métallique (par exemple Al-O(-)), et la double liaison iminium résultante serait alors réduite en une amine. C’est le processus suivi par la plupart des réductions d’amides ; mais dans le cas des 1º-amides, l’acidité des hydrogènes de l’azote associée à la basicité de l’hydrure permet une élimination facile de l’oxygène (sous forme d’oxyde). L’intermédiaire nitrile résultant est ensuite réduit en 1º-amine. Les nitriles sont en fait un produit majeur lorsque moins d’une équivalence complète de LiAlH4 est utilisée. Un mécanisme sera montré ci-dessus en cliquant sur le schéma.
L’hydrure de lithium et d’aluminium réduit les nitriles en 1º-amines, comme le montre l’équation suivante. Une première addition d’hydrure sur l’atome de carbone électrophile du nitrile génère le sel d’une imine intermédiaire. Ceci est suivi d’un second transfert d’hydrure, et le sel d’amine métallique résultant est hydrolysé en une 1º-amine. Cette méthode constitue une alternative utile à la réduction catalytique des nitriles, décrite ci-dessus, lorsque des fonctions alcène ou alcyne sont présentes.
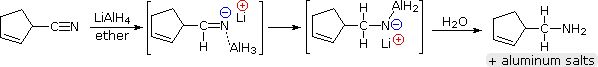
Contrairement à l’utilité de l’hydrure de lithium et d’aluminium pour réduire divers dérivés d’acides carboxyliques, le borohydrure de sodium est rarement choisi à cette fin. Tout d’abord, le NaBH4 est souvent utilisé dans des solvants hydroxyliques (eau et alcools), et ceux-ci réagiraient avec les chlorures et anhydrides d’acyle. De plus, il est peu soluble dans les solvants relativement non polaires, en particulier à basse température. Deuxièmement, le NaBH4 est beaucoup moins réactif que le LAH, ne parvenant pas du tout à réduire les amides et les acides (ils forment des sels de carboxylate), et réduisant les esters très lentement.
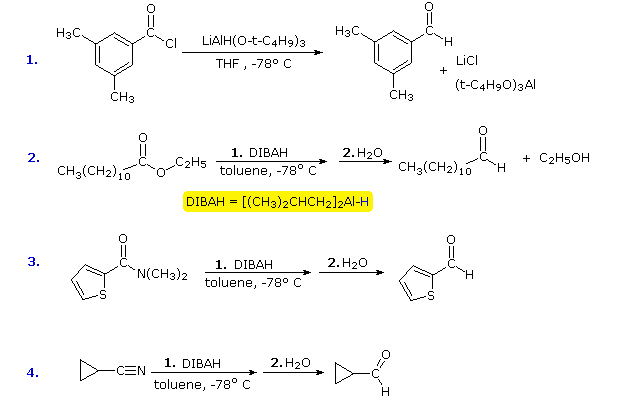
Puisqu’il existe relativement peu de méthodes pour la réduction des dérivés d’acides carboxyliques en aldéhydes, il serait utile de modifier la réactivité et la solubilité du LAH pour permettre la réalisation de réductions partielles de ce type. L’approche la plus fructueuse à cette fin a été de fixer des groupes alcoxy ou alkyle sur l’aluminium. Cela modifie non seulement la réactivité du réactif en tant que donneur d’hydrure, mais augmente également sa solubilité dans les solvants non polaires. Deux réactifs de ce type seront mentionnés ici ; l’atome d’hydrure réactif est coloré en bleu.
![]() Tri-tert-butoxyaluminohydrure de lithium (LtBAH), LiAl3H : Soluble dans le THF, le diglyme & éther.
Tri-tert-butoxyaluminohydrure de lithium (LtBAH), LiAl3H : Soluble dans le THF, le diglyme & éther.![]() Hydrure de diisobutylaluminium (DIBAH), 2AlH : Soluble dans le toluène, le THF & éther.
Hydrure de diisobutylaluminium (DIBAH), 2AlH : Soluble dans le toluène, le THF & éther.
Chacun de ces réactifs porte un équivalent d’hydrure. Le premier (LtBAH) est un hydrure métallique complexe, mais le second est simplement un dérivé alkylique de l’hydrure d’aluminium. En pratique, les deux réactifs sont utilisés en quantités équimolaires, et généralement à des températures bien inférieures à 0 ºC. Les exemples suivants illustrent la façon dont les aldéhydes peuvent être préparés à partir de dérivés d’acides carboxyliques en appliquant soigneusement ces réactifs. Une température de -78 ºC est facilement maintenue en utilisant de la glace sèche comme réfrigérant. Les intermédiaires réduits qui conduisent aux aldéhydes seront affichés en cliquant sur le bouton « Show Intermediates ». Avec un excès de réactif à des températures supérieures à 0 ºC, la plupart des dérivés d’acides carboxyliques sont réduits en alcools ou en amines.
Contributeurs
-
William Reusch, professeur émérite (Michigan State U.), Manuel virtuel de chimie organique
.
0 commentaire