Les poils sont une caractéristique déterminante des mammifères : on ne les trouve que chez les mammifères, et chaque mammifère a des poils à un moment donné de sa vie. Au cours de l’évolution des mammifères, les poils ont été modifiés et spécialisés pour remplir de nombreuses fonctions, notamment l’isolation, le camouflage, la signalisation (aux partenaires potentiels ou aux prédateurs potentiels), la détection (via les moustaches ou les vibrisses) et la défense.
Certains mammifères possèdent des poils modifiés qui sont agrandis, rigidifiés et renforcés pour former des pointes de différentes formes et tailles. Ces structures, appelées épines ou parfois piquants, ont toujours un tube extérieur épais et dur de kératine (la protéine fibreuse qui compose tous les poils ainsi que les griffes, les ongles et les gaines de corne) et des extrémités effilées et pointues.
Au delà de cette conception de base, cependant, les épines des différentes espèces sont très variables en taille, forme et fonction. Les piquants de porc-épic, par exemple, sont de différentes longueurs sur différentes parties du corps, tombent relativement facilement et se brisent aisément lorsqu’ils sont pliés, alors que les épines du hérisson sont de la même longueur sur tout le corps, sont bien enfoncées dans la peau ( » vous pouvez soulever un hérisson par une seule épine ! » Vincent 2002, p.30), et sont robustes et légèrement courbées. Sur le plan fonctionnel, la plupart des épines servent de défense contre les prédateurs, mais les épines sont également des outils importants pour la communication, l’absorption des chocs et la protection contre la pluie.
Bien que les deux termes soient souvent utilisés de manière interchangeable, « épines » et « piquants » ont des définitions légèrement différentes. » Épine » est un terme plus général pour tout poil modifié en une structure durcie et hérissée, alors que les piquants sont un type spécifique d’épine. Les « vrais » piquants ont un noyau spongieux et se trouvent chez les échidnés ainsi que chez certains rongeurs.
Les épines et les piquants ont évolué indépendamment à de multiples endroits et moments dans l’arbre de vie des mammifères ; ils sont donc un exemple de convergence. Le plus ancien mammifère connu pour avoir des poils élargis et durcis pour se défendre est Pholidocerus, un ancêtre éteint du hérisson qui vivait il y a plus de 40 millions d’années. Cependant, les poils ne se fossilisent pas aussi facilement que d’autres structures comme les dents et les os, de sorte que les épines et les piquants peuvent avoir évolué beaucoup plus tôt.
Aujourd’hui, on trouve des épines ou des piquants dans quatre grands groupes de mammifères vivants : les hérissons (Erinaceomorpha : Erinaceidae, Erinaceinae), les tenrecs (Afrosoricida : Tenrecidae, Tenrecinae), les échidnés (Monotremata : Tachyglossidae) et les rongeurs (Rodentia). Ce dernier groupe comprend les porcs-épics de l’Ancien et du Nouveau Monde (Hystricidae et Erethizontidae, respectivement), les rats épineux (Echimyidae) et les rats et souris de l’Ancien Monde (Muridae), qui comptent tous des espèces au pelage épineux.
Porcupine Quills
De tous les mammifères épineux, les porcs-épics sont peut-être les plus connus – et les plus intimidants ! Il existe deux familles de porcs-épics, les porcs-épics de l’Ancien Monde (Hystricidae), qui vivent en Europe, en Afrique et en Asie, et les porcs-épics du Nouveau Monde (Erethizontidae), qui vivent en Amérique du Nord et du Sud. Dans les deux familles, le dos et les flancs du porc-épic sont recouverts de véritables piquants, qu’il dresse et déploie si un prédateur s’approche de trop près. Les porcs-épics de l’Ancien Monde ont des épines ou des poils courts et aplatis sur la tête, le cou, les pieds et le ventre, tandis que le dessous des porcs-épics du Nouveau Monde est recouvert d’une fourrure beaucoup plus douce. Tous les bébés porcs-épics (ou porcs-épics) naissent avec leurs piquants, mais ceux-ci sont trop petits et trop flexibles pour être très efficaces contre les prédateurs avant que le porc-épic ait atteint l’âge de plusieurs mois. Les piquants de porc-épic ont des racines lâches, ils se détachent donc facilement lorsqu’ils sont enfoncés dans un agresseur ou lorsque le porc-épic secoue son corps (bien que le mythe populaire selon lequel les porcs-épics tirent des piquants sur leurs ennemis soit faux).

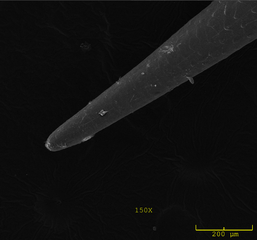
Les piquants de porc-épic du Nouveau Monde sont des armes si redoutables et efficaces qu’ils ont même été connus pour tuer des prédateurs potentiels comme les chiens et les renards. La raison pour laquelle ces piquants sont si dangereux devient évidente au niveau microscopique (Fig 1). Les extrémités de chaque piquant sont incroyablement pointues et capables de percer la peau plus facilement qu’une aiguille hypodermique de calibre 18 (de la même taille que le piquant). Une fois qu’elle a pénétré dans la peau, ses barbes microscopiques tournées vers l’arrière empêchent de retirer la plume sans causer une douleur importante et des dommages aux tissus environnants. Pour aggraver les choses, la pointe de la plume se casse facilement pour rester dans l’agresseur, et elle peut s’enfoncer de plus en plus profondément dans la peau au fil du temps, à chaque contraction ou mouvement musculaire. Dans son livre Le porc-épic d’Amérique du Nord, le chercheur Uldis Roze décrit une piqure de porc-épic du Nouveau Monde se brisant dans son biceps, pour ressortir deux jours plus tard dans son avant-bras (p. 24)!
Les prédateurs gardent souvent leurs distances, cependant, car les porcs-épics utilisent une variété de signaux aposématiques, ou avertissant leurs ennemis de rester à l’écart. Les piquants, en particulier ceux de la crête et du croupion, peuvent être érigés en un déploiement intimidant et épineux avec des mouvements de « vrombissement » ou d’éventail. La coloration noire et blanche très contrastée des piquants, qui est pleinement développée chez les porcs-épics du Nouveau Monde à l’âge de trois mois, peut également constituer un signe d’avertissement visuel pour leurs prédateurs nocturnes, et souvent daltoniens.
Les porcs-épics du vieux monde peuvent également utiliser l’aposématisme acoustique. Les extrémités terminales de leur queue sont recouvertes de piquants creux en forme de capsule de 5 à 8 cm de long appelés « piquants de hochet » qui, comme leur nom l’indique, produisent un bruit de hochet lorsqu’on les fait vibrer. Le cliquetis de la queue semble à lui seul dissuader la plupart des prédateurs solitaires, qui ont probablement appris à associer le bruit du cliquetis à la douleur. Contrairement aux porcs-épics du Nouveau Monde, les piquants des porcs-épics de l’Ancien Monde ne sont pas barbelés, bien qu’ils soient encore assez pointus et capables de pénétrer la chair.
Mais comment les porcs-épics se protègent-ils pour ne pas être blessés par leurs propres piquants ? En effet, de nombreux exemples tirés de la littérature scientifique et anecdotique montrent que les porcs-épics du Nouveau Monde tombent relativement fréquemment des arbres, forçant vraisemblablement leurs propres piquants dans leur peau. Les porcs-épics semblent limiter l’automutilation grâce aux antibiotiques naturels contenus dans leurs piquants. Roze et al. (1989) ont découvert que les piquants des porcs-épics du Nouveau Monde sont recouverts d’acides gras provenant de sécrétions exocrines qui empêchent la croissance bactérienne, probablement pour prévenir l’infection des blessures auto-infligées.
Les épines d’autres rongeurs
Les épines offrent un avantage évident aux espèces comme les porcs-épics, dont les piquants sont connus pour dissuader, et parfois même tuer, les prédateurs. Cependant, les épines des autres familles de rongeurs (par exemple, Muridae et Echimyidae) sont comparativement inefficaces pour repousser les attaquants, de sorte que leur fonction n’est pas entièrement comprise.
Structurellement, les épines des rongeurs echimyidés ne sont pas rondes mais aplaties et facilement pliées, et elles sont rarement colorées de manière aposématique. De nombreuses espèces épineuses sont la proie de serpents, d’oiseaux et d’autres mammifères, qui ne semblent pas être dissuadés par les épines. Malgré tout, les épines fournissent probablement une certaine protection, bien que minime, en servant d’armure passive.
Une autre hypothèse (Lekagul & McNeely 1977) est que les épines de nombreux rongeurs fonctionnent pour se protéger de la pluie, qui maintient les poils isolants et de garde au sec. En effet, le rat blindé (Hoplomys gymnurus), qui possède les épines les plus grandes et les mieux développées parmi les rongeurs echimyides, est abondant dans les forêts de plaine très humides des Néotropiques. La thermorégulation est très importante pour les petits mammifères, qui peuvent perdre rapidement leur chaleur corporelle, et les épines peuvent donc être essentielles pour garder ces espèces au sec et au chaud.
Les épines du hérisson

Les hérissons (Erinaceidae : Erinaceinae ; Fig. 2) sont bien connus à travers l’Europe, l’Asie et l’Afrique pour leur manteau distinctif d’épines, qui sont parfois appelées piquants ou « piquants ». Par rapport aux porcs-épics du Nouveau Monde, dont les piquants sont barbelés et varient en taille et en forme sur le corps, les épines du hérisson ne sont pas barbelées et sont plus ou moins uniformes. L’épine s’effile en une pointe acérée à l’extrémité distale, mais elle est bulbeuse à l’endroit où elle sort de la peau, ce qui permet à l’épine de rester fermement ancrée dans la peau et de ne pas être facilement retirée.
Les bébés hérissons naissent avec leurs épines, mais elles sont recouvertes d’une membrane remplie de liquide pour protéger la mère pendant la naissance. En l’espace d’une journée, cette enveloppe rétrécit, sèche et disparaît pour laisser apparaître environ 150 épines blanches et flexibles. Ces épines sont relativement molles au début, mais elles durcissent et s’assombrissent au cours des premières semaines de vie et sont finalement remplacées par des épines dures et adultes via le « piquage », un processus qui se produit dans les six premiers mois.
Parce que leurs épines sont non barbelées et indétachables, les hérissons ne se défendent pas activement contre les prédateurs comme le fait le porc-épic. Les épines – plus de 5 000 en moyenne – servent plutôt d’armure corporelle passive, et la meilleure défense du hérisson est de se rouler en une boule peu appétissante. Le fait de se rouler fait pointer toutes les épines vers l’extérieur, et un muscle puissant appelé orbicularis panniculi, situé à la marge de l’interface piquant-fourrure, agit comme un cordon de serrage pour maintenir la tête, les pattes et le ventre du hérisson bien cachés dans la boule impénétrable d’épines et inaccessibles aux prédateurs.
Au niveau microscopique, les épines du hérisson ont une apparence assez différente de celles des rongeurs. Les parois extérieures sont relativement lisses et le noyau est composé de poches d’air séparées par des septa régulièrement espacés et des » limons longitudinaux » pour plus de solidité. En effet, les épines des hérissons sont incroyablement solides et résistantes à la rupture et au flambage – Vincent et Owers (1986, p. 68) ont noté qu’ils « n’ont jamais vu une épine de hérisson avec une pointe cassée. »
Cette observation a conduit Vincent et Owers à émettre l’hypothèse que les épines des hérissons fournissent plus qu’une simple défense passive contre les prédateurs. Dans une expérience qui a testé la résistance et les propriétés mécaniques des piquants et des épines, ces scientifiques ont constaté que les épines des hérissons sont très élastiques aux forces d’impact importantes. De nombreux rapports font état de hérissons grimpant aux arbres et aux murs, puis redescendant simplement en roulant et en tombant au sol. Il est donc possible que les épines des hérissons aient évolué comme amortisseurs de chocs lors de chutes plutôt que comme moyen de défense contre les prédateurs.
Les épines des hérissons sont également adeptes de l’évacuation des fluides (elles peuvent absorber jusqu’à 11% du poids de l’épine en eau), ce qui est utile pour un comportement appelé « onction ». On parle d’onction lorsque le hérisson rencontre une nouvelle odeur, lèche ou mâche la source, puis produit une mousse dans sa bouche qu’il répand sur ses épines. Le but de l’onction est mal compris, mais Burton (1969) a listé sept explications possibles :
- C’est une forme de salutation ;
- C’est une forme de comportement sexuel ;
- C’est un moyen de se débarrasser des ectoparasites ;
- Il rend le hérisson peu appétissant pour ses ennemis ;
- Il maintient les épines souples ;
- Les substances étrangères présentes sur les épines les rendent toxiques ou peu appétissantes ; et
- C’est une relique d’une activité autrefois utile, peut-être un mécanisme de refroidissement hérité des ancêtres tropicaux du hérisson.
Des études de suivi ont permis de préciser lesquelles des sept fonctions possibles de l’onction étaient les plus probablement utilisées par les hérissons. Robert Brockie (1976) a constaté que l’onction était fortement corrélée à l’accouplement et a suggéré que les épines conservent des odeurs importantes dans le comportement sexuel et la communication intra-spécifique. L’année suivante (1977), Edmund Brodie a rapporté que les hérissons utilisent les sécrétions toxiques des crapauds pour dissuader les prédateurs. Les toxines sont absorbées par la bouche des hérissons et transférées à leur colonne vertébrale par léchage, ce qui est susceptible d’augmenter la douleur chez un prédateur potentiel. Cela montre que l’onction des épines a de multiples fonctions importantes pour les hérissons.
Les épines de Tenrec
Les Tenrecs (Tenrecidae) sont des mammifères placentaires présents en Afrique tropicale et à Madagascar. Ces animaux de taille petite à moyenne (2-2000 grammes) présentent une étonnante variété de comportements, de physiologies et d’apparences. Une sous-famille de tenrec a développé des épines et est donc nommée à juste titre les « tenrecs épineux » (Tenrecinae). Il existe cinq espèces de tenrecs épineux, toutes endémiques (uniquement présentes à) Madagascar : les tenrecs hérissons (Setifer setosus et Echinops telfairi), les tenrecs striés (Hemicentetes nigriceps et Hemicentetes semispinosus), et le tenrec commun ou sans queue (Tenrec ecaudatus).
Les noms communs des tenrecs, comme tenrec hérisson, tenrec musaraigne et tenrec taupe, font référence à leurs ressemblances superficielles avec d’autres mammifères (bien qu’en réalité ils soient plus proches des éléphants et des oryctéropes que de leurs homonymes). C’est particulièrement vrai pour les deux espèces de tenrec hérisson, Setifer setosus et Echinops telfairi, qui ressemblent étonnamment aux « vrais » hérissons (Erinaceidae). Comme les hérissons, les tenrecs hérissons sont couverts dorsalement d’un manteau d’épines durcies et peuvent se rouler en une boule presque impénétrable lorsqu’ils sont menacés, bien que les muscles pour se rouler soient très différents (non homologues) entre les deux (Fig. 3). En fait, les hérissons et les tenrecs se ressemblent tellement que le département de l’agriculture des États-Unis a interdit l’importation de ces espèces. Department of Agriculture a interdit l’importation des tenrecs hérissons – populaires dans le commerce des animaux de compagnie exotiques – pour tenter de contrôler la propagation de la fièvre aphteuse dans le bétail, non pas parce que les tenrecs sont connus pour transmettre la maladie mais parce que les hérissons le sont, et que les hérissons infectés peuvent être confondus avec les tenrecs hérissons.

Les épines du tenrec hérisson sont plutôt courtes et robustes par rapport à des espèces comme le porc-épic, elles sont de taille uniforme sur le dos et ne sont pas barbelées. À la naissance, les épines sont déjà visibles et dépassent légèrement de la peau, bien qu’elles soient initialement molles et ressemblent à des poils. Les épines ne se détachent pas facilement, car les fibres du muscle sous-cutané (m. cutaneous maximus) sont insérées dans les bases des épines. Au niveau microscopique, le noyau de chaque épine est constitué d’une série de septa, comme chez les vrais hérissons. Cependant, contrairement aux hérissons, les septa des tenrecs hérissons sont plus rapprochés, les parois externes des épines sont plus minces et il n’y a pas de limons longitudinaux.
Si les épines des tenrecs hérissons sont certainement utilisées pour la défense et ont également une fonction hypothétique à la fois d’onction (Eisenberg & Gould 1970) et d’absorption des chocs (Vincent 1986), elles pourraient avoir une autre fonction : la communication. Pendant les comportements de parade nuptiale et de marquage, Echinops bouge souvent les muscles de son corps de manière rythmique, ce qui provoque le frottement de ses piquants dorsolatéraux les uns contre les autres et la production d’un son grave.
Les tenrecs sont les seuls mammifères au monde connus pour communiquer entre eux grâce à des sons produits par des épines. Ce comportement est le plus développé chez les parents des tenrecs hérissons appelés les tenrecs striés (genre Hemicentetes). Les tenrecs striés ont développé un « organe stridulant » spécial, c’est-à-dire un muscle qui contrôle le mouvement d’une plaque d’épines modifiées près de leur croupe (Fig. 4). Ces épines sont plus grandes, n’ont pas de barbes et sont plus difficiles à enlever que les autres épines de leur corps, car elles sont profondément liées aux muscles qui contrôlent leurs mouvements. La stridulation, c’est-à-dire le frottement des épines les unes contre les autres, produit des impulsions sonores comprises entre 2 et 200 KHz (les humains entendent généralement dans une gamme de 12 à 20 KHz). Bien que les tenrecs striés produisent également des bruits à partir de leur bouche, la stridulation semble être une forme importante de communication car elle se produit pendant l’alimentation, pendant les contacts sociaux, pendant la parade nuptiale, pendant l’exploration et pendant les combats ou la fuite.

Le tenrec commun ou sans queue (Tenrec ecaudatus) possède une structure similaire à l’organe stridulant des Hemicentetes, bien qu’elle ne soit présente que chez les juvéniles. Chez le tenrec commun, les épines (Fig. 5) sont muées par les juvéniles et sont remplacées par une fourrure plus douce chez les adultes, les épines de l’organe stridulant étant remplacées en dernier. L’organe stridulant n’est pas aussi actif chez le tenrec commun que chez le tenrec strié ; le tenrec commun ne fait vibrer ses épines que lorsqu’il est effrayé, souvent en même temps que l’érection des piquants sur son cou et son dos, et le son qu’il produit se situe dans une gamme de fréquences réduite (12 à 15 KHz). Chez les tenrecs communs adultes, même après la disparition de l’organe stridulant, la fourrure de cette zone du dos vibre rapidement lorsque les individus sont menacés ou effrayés.
Les sons de stridulation produits par les tenrecs semblent être utilisés uniquement pour la communication intra-espèce et non pour avertir les prédateurs, mais les rayures jaunes et noires brillantes des épines chez les tenrecs striés et les tenrecs communs juvéniles peuvent être aposématiques — un message aux ennemis pour qu’ils restent à l’écart ! En effet, les tenrecs striés sont les seuls tenrecs à posséder des épines barbelées et détachables pour leur défense active. Lorsqu’ils sont menacés, les tenrecs striés érigent un cercle d’épines menaçantes autour de leur tête et, si nécessaire, se ruent sur leurs attaquants pour enfoncer les épines profondément dans leur peau.
Les échidnés ou « fourmiliers à épines » (Tachyglossidae) sont des mammifères obscurs de taille moyenne (jusqu’à 16 kg) d’Australie et de Nouvelle-Guinée. Bien qu’ils ressemblent superficiellement à un croisement entre les fourmiliers d’Amérique du Sud et les hérissons d’Eurasie et d’Afrique, ils ne sont pas étroitement liés à ces derniers. En réalité, ils appartiennent à l’ordre des Monotremata, une ancienne lignée de mammifères pondeurs qui ne contient que cinq espèces vivantes : quatre espèces d’échidnés et l’ornithorynque.
De tous les mammifères épineux, les piquants de l’échidné sont peut-être les moins étudiés. Alors qu’ils ressemblent aux piquants des hérissons par leur forme – ils sont courts, épais et non barbelés – leur structure est plus proche de celle des porcs-épics – le cœur du piquant est rempli d’un matériau ressemblant à de la mousse. Les piquants ont des parois très robustes par rapport à leur diamètre (2 mm de diamètre pour des parois de 0,5 mm d’épaisseur) et sont donc extrêmement résistants à la flexion. Ceci et les extrémités relativement émoussées de chaque piquant suggèrent qu’ils fonctionnent comme une armure corporelle résistante, mais des recherches futures pourraient révéler si les piquants des échidnés sont également utilisés pour l’onction, l’absorption des chocs ou l’une des nombreuses autres fonctions associées aux mammifères épineux.
Contributeurs
Kathryn M. Everson (auteur) ; Link Olson (instructeur)
Brockie, R. 1976. L’auto-nomination par les hérissons sauvages, Erinaceus europaeus, en Nouvelle-Zélande. Animal Behaviour, 24(1), 68-71.
Brodie, E.D. 1977. Les hérissons utilisent le venin des crapauds pour leur propre défense. Nature, 268 : 627-28.
Burton, M. 1969. The Hedgehog. Worchester et Londres : André Deutsch Ltd.
Caro, T.M. 2005. Les défenses anti-prédateurs chez les oiseaux et les mammifères. University of Chicago Press : Chicago.
Caro, T. 2009. La coloration contrastée chez les mammifères terrestres. Philos. Trans. R. Soc. Lond. B Biol. Sci. 364 : 537-548.
Chapman, R.E. 1986. Poil, laine, plume, ongle, griffe, sabot et corne. Biologie du tégument 2 : les vertébrés. Springer Berlin Heidelberg : 293-317.
Chernova, O.F. 2002. Signification architectonique et diagnostique de la cuticule des cheveux. Izvestiia Akademii nauk. Seriia biologicheskaia / Rossiĭskaia akademiia nauk, 29(3), 296-305.
Chernova, O.F. & Kuznetsov, G. V. 2001. Caractéristiques structurelles des épines chez certains rongeurs (Rodentia : Myomorpha, Hystricomorpha). Biology Bulletin of the Russian Academy of Sciences, 28(4), 371-383.
Chernova, O. & Hoffmann, R. 2004. Une étude comparative de la structure fine des épines de tenrec. Zoologichesky Zhurnal, 83(2), 159-165.
Cho, W.K. et al. 2012. Les barbillons microstructurés de la plume du porc-épic nord-américain permettent une pénétration facile des tissus et un retrait difficile. Proceedings of the National Academy of Sciences of the United States of America, 109(52), 21289-94.
Eisenberg, J. F., & Gould, E. 1970. Les tenrecs : une étude du comportement et de l’évolution des mammifères. Ville de Washington : Smithsonian Institution.
Endo, H. et al. 2010. Un mécanisme de vibration de la plume pour un appareil de sondage chez le tenrec strié (Hemicentetes semispinosus). Zoological Science, 27(5), 427-32.
Gould, E. 1965. Preuves d’écholocation chez les Tenrecidae de Madagascar. Proceedings of the American Philosophical Society, 109(6) : 352-360.
Hoey, K.A., Wise, R.R. & Adler, G.H. 2004. Ultrastructure des épines des rongeurs echimyides et muridés. Journal of Zoology, 263(3), 307-315.
Lekagul, B., & McNeely, J. A. 1977. Mammifères de Thaïlande. Saha Karn Bhaet Co : Thaïlande.
Mohr, E. 1965. Altweltliche Stachelschweine. A. Ziemsen Verlag (Eds.), Wittenburg Lutherstadt, Allemagne. 164.
Olson, L.E. 2013. Tenrecs. Current Biology, 23(1) : R5-R8.
Rose, K.D. 2009. Le début de l’ère des mammifères. Johns Hopkins University Press : Baltimore, MD.
Roze, U. 2009. Le porc-épic nord-américain. Cornell University Press : Ithaca, NY.
Roze, U., Locke, D.C. & Vatakis, N. 1990. Propriétés antibiotiques des piquants de porc-épic. Journal of Chemical Ecology, 16(3), 725-734.
Stankowich, T. 2011. Armé et dangereux : prédire la présence et la fonction de l’armement défensif chez les mammifères. Adaptive Behavior, 20(1) : 32-43.
Vaughan, T., Ryan, J., & Czaplewski, N. 2011. Mammalogie. Jones & Bartlett Learning.
Vincent, J.F.V. 2002. La survie du moins cher. Materials Today, 5(12) : 28-41.
Vincent, J.F.V. & Owers, P. 1986. Conception mécanique des épines de hérisson et des piquants de porc-épic Hystricidae (porcs-épics de l’Ancien Monde), Journal de zoologie, 210 : 55-75.
Zherebtsova, O.V. 2000. Couverture épineuse et stratégie de défense des mammifères. Trans. Zool. Inst., Russian Ac. Sci. 286 : 169-174.
Il s’agit d’une étude de cas.
0 commentaire